擠壓對大豆蛋白構象及其組織化結構的影響研究進展
朱秀清,欒濱羽,黃雨洋,王逢秋節(jié),李 楊*
( 1.哈爾濱商業(yè)大學食品工程學院,黑龍江省谷物食品與谷物資源綜合加工重點實驗室,黑龍江 哈爾濱 150028;2.東北農(nóng)業(yè)大學食品學院,黑龍江 哈爾濱 150030)
動物蛋白為人類飲食提供了很好的蛋白源,但是畜牧業(yè)的發(fā)展會帶來一些環(huán)境污染的問題[1-2]。為緩解肉類加工產(chǎn)生的污染,一些研究者認為組織化植物蛋白和細胞培養(yǎng)肉等仿肉制品可部分補充肉制品,降低肉制品的消費比重。其中組織化植物蛋白由于其相對較低的成本且與肉相似度較高,而被認為是一種可行性較大的未來食品。
植物蛋白是人類膳食中重要的蛋白來源。與動物蛋白相比,植物蛋白廉價易得,且具有降血糖、預防心血管疾病等多種生理功能[3]。目前我國對花生蛋白、大豆蛋白、豌豆蛋白的研究較為深入。組織化植物蛋白即以大豆、花生、豌豆等富含蛋白的油料或谷物及其衍生物為原料,通過擠壓能量的輸入使其蛋白發(fā)生充分變性,蛋白原有結構被破壞并在適宜條件下發(fā)生重排,最終形成具有緊致組織結構的制品。組織化植物蛋白成品的蛋白質(zhì)量分數(shù)在50%以上,具有動物肌肉纖維狀結構和緊致,故也被稱為“植物蛋白肉”[4]、“蛋白素肉”(以下簡稱“素肉”)等。
作為一種全價植物蛋白,大豆蛋白富含各種人體必需氨基酸,生物利用率高[5],因此大豆基素肉制品在我國市場上較為普遍。大豆基素肉制品采用大豆粉、大豆?jié)饪s蛋白、大豆分離蛋白為主要原料,輔以淀粉、脂肪等[6]。原料組成上的差別使其品質(zhì)多變且不易控制,擠壓過程中各原料組分的化學變化過程尚不明確。此外,不同加工企業(yè)使用的原料不同,生產(chǎn)企業(yè)常為控制成本而對最佳配方進行不合適的改動,受工藝、原料的影響,素肉產(chǎn)品質(zhì)量產(chǎn)品品質(zhì)不穩(wěn)定,常出現(xiàn)產(chǎn)品纖維狀結構不明顯、咀嚼性差等問題,在生產(chǎn)加工中亟需突破技術瓶頸以解決這些問題。
擠壓技術是目前生產(chǎn)組織化大豆素肉的主要方式。表1列出了兩種水分條件擠壓的差異。在低水分條件下(水分質(zhì)量分數(shù)20%~40%)可以制得具有一定纖維結構的拉絲蛋白,內(nèi)部呈現(xiàn)孔隙不均的海綿狀結構,復水后口感松軟,且形狀、大小豐富多樣[7],是目前國內(nèi)外市場上的素肉產(chǎn)品的主要原料。我國生產(chǎn)低水分擠壓蛋白的食品企業(yè)超過50 家,其產(chǎn)品作為肉制品添加物已廣泛應用于肉制品、冷凍食品、方便食品、肉丸、休閑食品等,這些食品的生產(chǎn)可以降低生產(chǎn)成本、增加食品中蛋白質(zhì)含量、改善膳食結構,其中的代表食品有火腿腸、冷凍餃子、方便面調(diào)料、魚丸、辣條、豆干等[8]。隨著對擠壓技術研究的深入,在20世紀90年代高水分擠壓技術逐漸興起。與低水分擠壓技術不同的除了高水分條件(水分質(zhì)量分數(shù)40%~80%)外,其在擠壓機末端還需安裝一個較長的冷卻模口[9-10]。這種高水分擠壓生產(chǎn)的大豆素肉產(chǎn)品組織化程度高,彈性強,具有類似動物肌原纖維蛋白組成的纖維狀結構,使擠壓后的植物蛋白素肉的口感、質(zhì)地、表觀形態(tài)都得到了很大的改善[11]。擠壓使大豆蛋白中抗營養(yǎng)因子鈍化,隨之提高蛋白消化吸收能力。相較于低水分擠壓,高水分擠壓素肉賦予大豆蛋白更強的吸水、吸油及風味吸附能力[12]。但高水分擠壓成本較高,對原料要求更為嚴格,目前仍處于不斷發(fā)展階段。

表1 低水分擠壓技術與高水分擠壓技術的基本特征比較[7,13-14]Table 1 Comparison of basic characteristics of low-moisture extrusion and high-moisture extrusion[7,13-14]
本文圍繞擠壓組織化大豆蛋白,對大豆蛋白組成及功能特性進行簡述,綜述擠壓對大豆蛋白微觀結構和功能性的影響,重點闡述擠壓大豆蛋白組織化結構形成機制,并總結擠壓條件對素肉產(chǎn)品結構的影響,旨在為大豆蛋白擠壓組織化的工業(yè)應用提供理論支撐。
1 大豆蛋白組成
大豆種子中的蛋白質(zhì)約占干物質(zhì)總質(zhì)量的40%[15],主要由4 種球蛋白組成,根據(jù)其在離子強度0.5 mol/L下的沉降系數(shù)分為4 種:2S、7S、11S、15S[16]。7S和11S是兩種主要的大豆貯藏蛋白,關于其蛋白具體組成目前已較為明確[17]。11S球蛋白主要由含硫氨基酸較多的大豆球蛋白組成,分子質(zhì)量在320 kDa左右,其四級結構是由6 個亞基環(huán)繞成的空心六聚體,每個亞基由一條酸性多肽和一條堿性多肽通過二硫鍵連接構成[18];β-伴球蛋白是7S球蛋白的主要組分,以三聚體形式存在,其四級結構由α、α’、β3 種亞基構成[19]。
大豆分離蛋白在pH值約5.0時溶解度最低,在pH 6~9其溶解性均強于豌豆蛋白和小麥蛋白,因此中性條件下大豆分離蛋白能顯著降低界面張力并在液滴周圍形成堅韌薄膜,表現(xiàn)出較強的起泡穩(wěn)定性、乳化活性和乳化穩(wěn)定性[20-21]。中性條件下大豆球蛋白的熱穩(wěn)定性強于β-大豆伴球蛋白,β-大豆伴球蛋白的變性溫度在68~75 ℃,而大豆球蛋白的變性溫度在85~93 ℃;80 ℃時β-大豆伴球蛋白完全變性吸熱峰消失,大豆球蛋白部分展開露出疏水基團,部分解離后重新聚合形成更緊致的聚集體,同時焓值降低[22]。Mo Xiaoqun等[23]通過差示掃描量熱分析進一步證明大豆球蛋白新聚集體的形成是由于其堿性亞基的存在,即堿性亞基的熱變性后形成熱穩(wěn)定性較高的有序結構,且堿性亞基的強疏水相互作用可促使蛋白質(zhì)酰胺基團與羰基之間氫鍵形成,使低聚體的結構穩(wěn)定性提高。對于決定凝膠乳化性和溶解性的β-大豆伴球蛋白[21],其β亞基含疏水性氨基酸較多(質(zhì)量分數(shù)為34.2%),在pH 5.0時形成球形團簇,熱穩(wěn)定性強于α和α’亞基[24]。
2 擠壓對大豆蛋白構象的影響
伴隨著高溫高壓高剪切力的擠壓過程中,蛋白逐漸展開原有的天然結構進而發(fā)生重排,這是擠壓產(chǎn)品宏觀結構改變的契機,即微尺度蛋白分子中的亞基、多肽等亞單位的變化引起的中尺度蛋白功能性改變對擠壓產(chǎn)品質(zhì)地形成起決定作用,但尚缺乏充分依據(jù)直接表征擠壓過程中分子構象變化。Renkema等[25-26]發(fā)現(xiàn)中性條件下11S的酸性和堿性多肽之間的二硫鍵在加熱時易被破壞;大豆蛋白加熱時的結合或解離行為和蛋白濃度對蛋白凝膠流變性質(zhì)均有影響;當更多蛋白間互作交聯(lián)形成網(wǎng)絡而非與水互作時,凝膠性越強;反之凝膠硬度降低。
2.1 擠壓對大豆蛋白分子結構的影響
熱能與機械能的共同作用不利于對擠壓過程的系統(tǒng)分析。有學者探討了擠壓溫度對于大豆蛋白分子二級結構的變化[27]。擠壓溫度決定著蛋白變性的劇烈程度,較低溫度下(<100 ℃)擠壓使蛋白變性后會發(fā)生局部的聚集,而溫度過高(高于150 ℃)則會造成聚集體重新展開,甚至影響如β-折疊等肽鏈間的作用從而改變二級結構相對含量,具體要根據(jù)蛋白熱穩(wěn)定性確定[28]。Ma Wenjun等[29]探究了60~100 ℃下擠壓對全脂豆粉微觀結構的影響,表明β-大豆伴球蛋白比大豆球蛋白更易于變性,且β-大豆伴球蛋白的3 種亞基在擠壓過程會通過共價鍵和非共價鍵聚合形成低聚體;二級結構中α-螺旋含量隨擠壓溫度升高而顯著降低,但β-折疊含量略有增加[28]。康立寧[30]使用傅里葉變換紅外光譜研究了大豆蛋白在120~160 ℃擠壓過程中二級結構的變化,結果表明由分子間局部相互作用維持的α-螺旋結構最不穩(wěn)定,會逐漸轉變?yōu)榉€(wěn)定的β-轉角結構,該轉變在140 ℃時基本完成;β-折疊在140 ℃以下時保持穩(wěn)定,溫度過高時開始轉變?yōu)闊o規(guī)卷曲,而β-轉角結構即使在160 ℃也基本保持不變。
2.2 擠壓對大豆蛋白功能性的影響
將大豆原料應用于擠壓的實例最早可以追溯到20世紀60年代,Mustakas等[31]通過實驗證明擠壓是生產(chǎn)全脂大豆粉的優(yōu)良手段,可降低豆粉中原有腐敗微生物數(shù)量,延長其保質(zhì)期,同時可去除部分致敏因子,為后續(xù)研究擠壓對大豆蛋白影響奠定基礎。
擠壓會改變蛋白在水中的溶解程度,形成不溶性聚集體,改變蛋白中的分子質(zhì)量分布,但不同亞基形成的聚集體其溶解狀態(tài)也不盡相同[32-33]。通常高溫高壓條件可促使蛋白變性和聚集,從而降低蛋白溶解度,但過高螺桿轉速和過高溫度又會破壞形成的蛋白聚集體[33-36]。
乳化性也是決定蛋白應用廣度的重要界面性質(zhì),常通過在均質(zhì)過程中形成液滴的乳化活性和形成液滴后保持穩(wěn)定不破碎的乳化穩(wěn)定性來表征其強弱[37]。大豆蛋白作為乳化劑的本質(zhì)是由于肽鏈上氨基酸極性的不同,既有疏水基團也存在親水基團,乳化性能隨著疏水基團暴露出來而提高[38]。故蛋白質(zhì)變性可使球狀蛋白質(zhì)轉變?yōu)楦呷犴g性、表面活性高的結構,還可提高乳化過程中油-水界面的吸附量[39]。Ma Wenjun等[40]表明擠壓后大豆蛋白變性致使其乳化活性上升,但小分子多肽之間的靜電相互作用增強和非極性基團增多,不利于維持脂肪球膜結構,結果表現(xiàn)為乳化穩(wěn)定性下降[41]。
3 擠壓對大豆蛋白分子重組程度的影響
3.1 擠壓參數(shù)對大豆蛋白擠壓產(chǎn)物形貌特征的影響
素肉制品的質(zhì)地是決定消費者接受程度的首要因素。除了采用兩次咀嚼測試模擬人體口腔咀嚼運動表征其彈性、硬度和咀嚼性等參數(shù)外,還存在用組織化度來表示素肉制品形貌特征的感官指標。其中硬度被定義為第一次壓縮樣品時應力的峰值;彈性為變性樣品去除壓力后恢復到變形前的高度的比率;咀嚼性則定義為固體咀嚼成吞咽穩(wěn)定狀態(tài)所需要的能量;組織化度則表示擠壓物纖維化的形成程度,組織化度越大,產(chǎn)品的纖維化程度越大,與動物肉質(zhì)地越接近,數(shù)值上表示為沿擠出方向的剪切力和垂直擠出方向的剪切力的比值[42-43]。對于組織化大豆蛋白,通常探討擠壓溫度、水分質(zhì)量分數(shù)、螺桿轉速以及送料速度4 個條件參數(shù)與產(chǎn)品品質(zhì)、擠壓響應參數(shù)三者之間的關系[27]。
3.1.1 擠壓溫度
擠壓溫度一般指在擠壓筒內(nèi)物料發(fā)生熔化和蛋白組織化時所承受的溫度,是物料熱能的主要來源[44]。作為促進蛋白質(zhì)纖維結構形成的關鍵因素[45],能保證大豆蛋白形成穩(wěn)定的纖維結構的擠壓溫度應在130~150 ℃[10,46]。當溫度升至150~160 ℃時,組織化程度會下降,表面會產(chǎn)生孔洞,且顏色變棕色[47]。此外,冷卻模頭溫度會影響壓力變化、扭矩、比機械能,進而改變?nèi)垠w黏度,這對纖維結構的形成至關重要[48],低水分擠壓需要冷卻溫度在100 ℃以上,高水分擠壓應控制在75 ℃以下,以保證物料形成黏度梯度從而以層流狀態(tài)運動[27,49],最終呈現(xiàn)多層結構。
3.1.2 螺桿轉速
擠壓機內(nèi)螺桿轉動為物料以剪切力的形式提供機械能,同時螺桿旋轉產(chǎn)生的黏性耗散會引起物料局部溫度過高,螺桿轉速可改變分散相在連續(xù)相中的分散程度,螺桿構型則可影響螺桿填充度和比機械能輸入[44]。隨著螺桿轉速增加,混合效果增強,螺桿提供阻力延長了物料在擠壓機筒中的停留時間,從而增加了扭矩和比機械能[27]。Sun等[50]發(fā)現(xiàn),對于高水分擠壓的大豆蛋白,其組織化度隨螺桿轉速增大呈先增加后降低的趨勢,增大轉速促使其混合充分,但轉速過高停留時間過短不能使蛋白充分發(fā)生熱變性形成熔融狀態(tài)便于后期形成組織化纖維結構,轉速在300 r/min時組織化度達到最大值;但Zhang Jinchuang等認為組織化大豆蛋白螺桿轉速應保持在80~100 r/min之間[27]。如果轉速高于120 r/min,纖維結構的強度就會減弱[51]。
3.1.3 水分質(zhì)量分數(shù)
水分既是傳遞機械能和熱能的媒介,同時也是影響物料黏度的直接因素[27]。魏益民等[52]以低溫脫脂豆粕為原料生產(chǎn)組織化大豆蛋白,結果表明水分質(zhì)量分數(shù)從35%增加到50%會使其產(chǎn)品的組織化度提高,但會降低咀嚼性。在相對較高的水分質(zhì)量分數(shù)(45%或50%)下,蛋白質(zhì)-蛋白質(zhì)及蛋白質(zhì)-水的相互作用更強烈,暴露更多的疏水基團,從而導致氮溶解度指數(shù)降低和高持水能力。Chen Fengliang等[53]研究表明,水分質(zhì)量分數(shù)從28%增加到60%,蛋白質(zhì)聚集性降低,硬度和咀嚼性顯著降低,纖維結構在水分質(zhì)量分數(shù)為60%時開始形成。Sun等[54]研究表明在大豆分離蛋白含量一定情況下,高水分組織化大豆蛋白組織化度隨水分質(zhì)量分數(shù)增加而增大,當擠壓溫度一定時組織化度隨水分質(zhì)量分數(shù)增加至一定值后呈下降趨勢。
3.1.4 進料速率
進料速率主要影響物料在擠壓機內(nèi)的填充程度、停留時間分布和模具內(nèi)壓力,進而影響物料所受的機械作用[55]。在低進料速率下,物料在擠出機中的停留時間較長,從而導致蛋白質(zhì)變性增加,擠出物變黑/褐變。進料速率過高蛋白質(zhì)則無法完全變性[56]。
康立寧的研究表明,進料速率對組織化度、硬度、咀嚼性和色澤有負影響,而對持水性有正影響[57]。當進料速率從10 g/min增加到50 g/min時,組織化度從1.3降低到1.1,表面質(zhì)地變粗糙,咀嚼性明顯降低[57]。組織化大豆蛋白可在25~30 g/min的進料速率內(nèi)形成較好的紋理結構[27]。
3.2 擠壓過程中其他組分對大豆蛋白組織化結構的影響
3.2.1 淀粉
碳水化合物可根據(jù)水解程度分為大分子糖類和小分子糖類兩部分,兩種糖類在擠壓中的作用不同。小分子糖類是發(fā)生影響素肉外觀的美拉德反應和焦糖化反應的重要底物。大分子類的淀粉和膳食纖維對素肉質(zhì)地有重要影響,其添加量不應超過混合物的10%[27]。作為常見的擠壓原料,淀粉在高溫和高剪切作用下氫鍵斷裂并發(fā)生糊化,改變物料黏度同時降解形成小分子糖類,從而影響擠壓產(chǎn)品質(zhì)構形成[58]。
Li Shujing等[59]通過研究大豆分離蛋白和玉米淀粉混合擠壓后熱性能變化,結果表明淀粉和大豆分離蛋白之間在20~130 ℃加熱過程中并沒有發(fā)生互作,但混合狀態(tài)下大豆分離蛋白抑制了淀粉糊化,而淀粉顆粒膨脹會使包裹它的蛋白凝膠網(wǎng)絡失水,阻止大豆分離蛋白充分變性,而水分質(zhì)量分數(shù)和水分遷移對該混合物的熱性能有較大影響;Zhang Wei等[60]進一步分析表明大豆分離蛋白與淀粉共混物的焓變與扭矩、比機械能和表觀黏度呈正相關,而與擠壓物的纖維化程度呈負相關,共混物的焓變越大會導致更高的比機械能和更大的壓力變化,從而使擠壓物的硬度和拉伸強度增強,纖維化程度下降。此外直鏈與支鏈淀粉比例、淀粉的粒徑大小對擠壓物黏度和膨化度也存在一定影響,一般粒徑越小,擠壓物膨脹率越高[61-62]。
3.2.2 谷朊粉
基于大豆蛋白的擠壓研究為進一步探討其他植物蛋白材料的擠壓加工適應性奠定了基礎,大豆存在豆腥味和致敏性等不良因素促使人們開始研發(fā)其他代替或改良材料,比如工業(yè)中常見輔料谷朊粉。與大豆蛋白相比,谷朊粉的理化性質(zhì)使其更適合作為一種黏合劑,其麥谷蛋白在水和過程中會形成具有可逆變形性質(zhì)的交聯(lián)網(wǎng)絡[49]。Zhang Jinchuang等[63]研究表明谷朊粉與花生蛋白混合擠壓會產(chǎn)生黏度較高的熔融體,導致更大的黏性耗散促使局部溫度更高;但最終產(chǎn)品結構較粗糙松散,不如大豆與花生混合的均勻緊致。Chiang等[12]將大豆?jié)饪s蛋白和谷朊粉混合進行高水分擠壓。結果表明兩種蛋白的比例會對素肉產(chǎn)品有影響,無谷朊粉和含10%(質(zhì)量分數(shù),下同)谷朊粉的擠壓物顯示層狀結構,而含20%和30%谷朊粉的擠壓物在掃描電子顯微鏡下呈現(xiàn)出大纖維與小纖維相互連接的網(wǎng)絡結構,故一定范圍內(nèi)更高的谷朊粉含量有助于纖維微結構形成。
但擠壓加工所采用的谷朊粉實際是由結構不同的麥谷蛋白和醇溶蛋白組成的混合物,其中麥谷蛋白為有二硫鍵相連的聚合物,賦予面團強度和彈性,而醇溶蛋白為單體賦予面團黏性[64]。Feng Jia等[65]僅對谷朊粉進行擠壓,發(fā)現(xiàn)麥谷蛋白的低分子質(zhì)量亞基在擠壓過程中會由于巰基氧化形成二硫鍵從而促使蛋白團形成高分子質(zhì)量聚合物,溫度提高可進一步促進該過程進行。但有關擠壓谷朊粉各組分蛋白的詳細變化和互作方式仍留有空白。
此外,谷朊粉還對擠壓物的風味具有一定改善作用[66]。小麥等谷物在高溫下產(chǎn)生的焙烤風味和美拉德反應可提高擠壓物感官品質(zhì),通常堿性條件更合適美拉德反應所需的游離氨基酸的產(chǎn)生[67]。Guo Zengwang等[68]通過低場核磁共振技術測定了一種大豆分離蛋白和谷朊粉的擠壓物的水分分布情況;表明提高谷朊粉用量可使產(chǎn)品更加致密,從而導致更強的結構組織間夾持效應,進而增大風味物質(zhì)的保留率。
3.2.3 離子
NaCl等添加劑中的離子主要通過影響蛋白表面電荷量從而間接影響蛋白間互作。Tian Yan等[69]表明NaCl添加量的增加可通過產(chǎn)生靜電屏蔽降低7S蛋白吸附的靜電壁壘,但這種效應不利于蛋白質(zhì)間互作,反而會減小7S的黏彈性界面層。此外谷氨酰胺轉氨酶(glutamine transaminase,TG)作為一種新潮的添加劑可通過催化蛋白質(zhì)分子內(nèi)或分子間-谷氨酸和賴氨酸交聯(lián)的形成,改善蛋白質(zhì)功能性[70]。但對于大豆中球蛋白的天然結構,還需要通過預處理使蛋白部分展開才能有較好的酶促效果[71]。Zhang Jinchuang等[72]研究了TG對高水分擠壓花生蛋白品質(zhì)的影響,表明在高水分擠壓過程中,TG可以促進蛋白質(zhì)分子鏈的展開、聚集和交聯(lián),有助于破壞氫鍵和二硫鍵,增強疏水相互作用。在冷卻模頭中,加入適量TG可通過促進形成新的氫鍵和二硫鍵,從而促進分子重排。TG處理后的各蛋白質(zhì)二級結構的相對含量為β-折疊>α-螺旋>β-轉角>無規(guī)卷曲。但TG添加量不應超過0.2%,否則會加速交聯(lián)不利于蛋白質(zhì)分子的重排和纖維結構的改善。
4 光譜學、色譜學在擠壓大豆蛋白研究中的應用
擠壓大豆蛋白的研究中需要對蛋白結構及擠壓產(chǎn)物的品質(zhì)和組分互作進行解析,從而為探討擠壓機制提供幫助。擠壓大豆蛋白結構可從疏水基團位置、蛋白聚集體大小、蛋白二級結構等微尺度參數(shù)和孔隙大小、蛋白網(wǎng)絡疏密程度等方面進行表征。其中擠壓大豆蛋白二級結構常用傅里葉變換紅外光譜表征,Guo Zengwang等[68]采用傅里葉變換紅外光譜結合傅里葉自去卷積法、二階導數(shù)和高斯曲線定量分析大豆分離蛋白、麥谷蛋白和天然香精混合擠壓產(chǎn)物的二級結構,在1 646~1 662 cm-1處為α-螺旋條帶,在1 608~1 622 cm-1和1 682~1 700 cm-1處為反向平行的β-折疊條帶,1 622~1 639 cm-1處為分子內(nèi)β-折疊條帶,1661~1681 cm-1處為β-轉角條帶,1637~1645 cm-1處為無規(guī)卷曲條帶;圓二色譜常用于表征擠壓過程中和擠壓后蛋白形成的凝膠和溶液中蛋白的二級結構,根據(jù)電子躍遷能級能量大小,蛋白的圓二光譜可分成250 nm以下遠紫外光區(qū)、250~300 nm近紫外光區(qū)和300~700 nm紫外-可見光區(qū)[73-74]。其中遠紫外光區(qū)可表征大豆分離蛋白肽鏈骨架二級結構信息,齊寶坤等[75]將大豆分離蛋白樣品溶于pH 7.0、濃度0.01 mol/L的磷酸鹽緩沖液中,在波長200~250 nm處進行圓二色譜掃描。拉曼光譜同樣可獲得蛋白二級和三級結構信息,但與紅外光譜相比所需樣品量更少且受水的干擾較小。呂博等[76]測定了不同均質(zhì)處理條件下大豆分離蛋白溶液的拉曼光譜,其中大豆分離蛋白的二級結構主要由酰胺I帶(1 630~1 700 cm-1)和酰胺III帶(1 230~1 310 cm-1)的拉曼特征峰確定,但實際所得酰胺III帶圖形復雜故該實驗中僅對酰胺I帶進行分析;色氨酸側鏈、酪氨酸的環(huán)吸收振動和酪氨酸的面彎曲振動產(chǎn)生的特征振動頻率則分別出現(xiàn)在760、830、850 cm-1處。
紫外光譜和熒光光譜主要表征蛋白三維結構變化和蛋白微環(huán)境變化,不同在于紫外光譜利用蛋白發(fā)色團的吸光性質(zhì),蛋白構象變化導致發(fā)色團位置改變和吸光度變化從而影響吸收光譜,而熒光光譜則利用對溶液極性環(huán)境較敏感的Trp和Tyr殘基的熒光光譜反映蛋白構象變化,因此這兩種方法多結合蛋白表面疏水性和乳化性變化結果進一步推斷蛋白空間構象[77]。一般295 nm處激發(fā)的大豆分離蛋白其熒光發(fā)射光譜主要是由色氨酸產(chǎn)生,峰位在325~350 nm之間[78]。朱穎等[79]采用紅外光譜、紫外光譜、熒光光譜分析不同品種大豆蛋白乳液中界面蛋白的柔性結構,通過分析不同品種界面蛋白的表面疏水性、二硫鍵含量、溶解性和乳化性等功能性,解析界面蛋白的柔性結構對功能性的影響機制;其熒光光譜的測定條件為:激發(fā)波長280 nm、掃描波長300~500 nm。在波長250~350 nm范圍內(nèi)進行紫外掃描;結果表明柔性較強的蛋白分子結構更易伸展,從而使內(nèi)部疏水性基團暴露,更易吸附到水-油界面,使乳液穩(wěn)定性增加。此外X射線衍射法也可通過衍射圖譜間接構建分子結構模型,但只適用于測定蛋白晶體結構。
掃描電子顯微鏡、X射線顯微成像可觀察蛋白網(wǎng)絡結構。其中掃描電子顯微鏡在擠壓大豆蛋白中有較多應用,可直觀看出樣品的緊實程度和堆積現(xiàn)象。其原理是采用高能電子束掃描樣品,利用產(chǎn)生的電子信號成像觀察樣品表面形態(tài)[80]。X射線顯微成像可利用X射線對樣品進行斷層掃描后的重構圖像分析樣品三維結構及纖維孔隙率[81]。
隨著近幾年計算機科學的發(fā)展,將其與蛋白質(zhì)化學和生物信息學技術結合使得模擬蛋白質(zhì)互作方式成為可能。Yang Yaxuan等[82]采用多色譜和分子對接技術分別分析11S和7S分別與綠茶中一種兒茶素互作的結構變化以及11S/7S與兒茶素的交聯(lián)機理。Chen Gang等[83]同樣使用圓二色光譜、熒光光譜和分子對接技術評估了多酚和高靜水壓處理的蛋白質(zhì)之間的相互作用。這種方法與以往相比,更加直觀地表明了蛋白質(zhì)互作的結果,但是軟件模擬的準確性還有待商榷。
5 擠壓大豆蛋白結構重組機制
目前工業(yè)上對擠壓大豆蛋白素肉制品的結構改良仍多憑經(jīng)驗摸索,雖然各種技術和儀器能較系統(tǒng)地表征擠壓前后分子結構和質(zhì)地狀態(tài),但對組織化過程中擠壓機筒內(nèi)局部細節(jié)的精準表征仍不夠完整,致使對組織化形成機理的觀點不能統(tǒng)一,且存在一定局限性。
作為原料中的主要功能性成分,蛋白質(zhì)-蛋白質(zhì)相互作用被認為是組織化形成的主要原因之一。如圖1所示,擠壓大豆蛋白結構變化具體是指蛋白質(zhì)在高溫高剪切條件下其二級、三級和四級結構被破壞,進而肽鏈重新排列,折疊并聚集形成新的分子結構,但分子間何種相互作用主導這一過程以及各亞基和多肽的具體行為仍不確定,同時蛋白與水分、糖類等物質(zhì)的互作使體系更加復雜。這與蛋白凝膠的形成機理較為相似,同樣需要經(jīng)歷蛋白質(zhì)受熱變性球蛋白展開重組形成大聚集體的過程,區(qū)別在于凝膠的實驗條件更為簡單,不需要考慮高溫和高剪切力的影響,但有關凝膠的研究可為擠壓中的蛋白互作提供依據(jù)。先前研究人員對大豆蛋白凝膠開展過深入的研究[84],天然狀態(tài)下大豆球蛋白比β-大豆伴球蛋白更易于聚集,但β-大豆伴球蛋白發(fā)生有限聚集形成可溶性聚集體,而大豆球蛋白中缺乏與多肽相連的多糖,無法阻止單體聚集,可迅速形成不溶性聚集體,兩者混合后可使大豆球蛋白聚集體的溶解度上升,此外α和α’亞基比β亞基更能抑制堿性多肽熱聚集[32,84]。目前有關擠壓過程中蛋白互作結論并不統(tǒng)一,且對亞基、多肽的行為沒有明確的表征。Liu Keshun等[47]將大豆蛋白、谷朊粉和小麥淀粉作為原料進行高水分擠壓,采用可選擇性破壞分子間作用力的不同溶液對擠壓機5 個區(qū)段所產(chǎn)生的物料中可溶性蛋白含量進行測定;結果表明二硫鍵對于物料纖維結構形成比非共價鍵更重要。但國內(nèi)Chen Fengliang等[37]將大豆分離蛋白作為唯一蛋白源進行擠壓,結果表明疏水相互作用、氫鍵、二硫鍵及其相互作用共同決定了擠壓物的結構,且非共價鍵的作用要大于共價鍵。
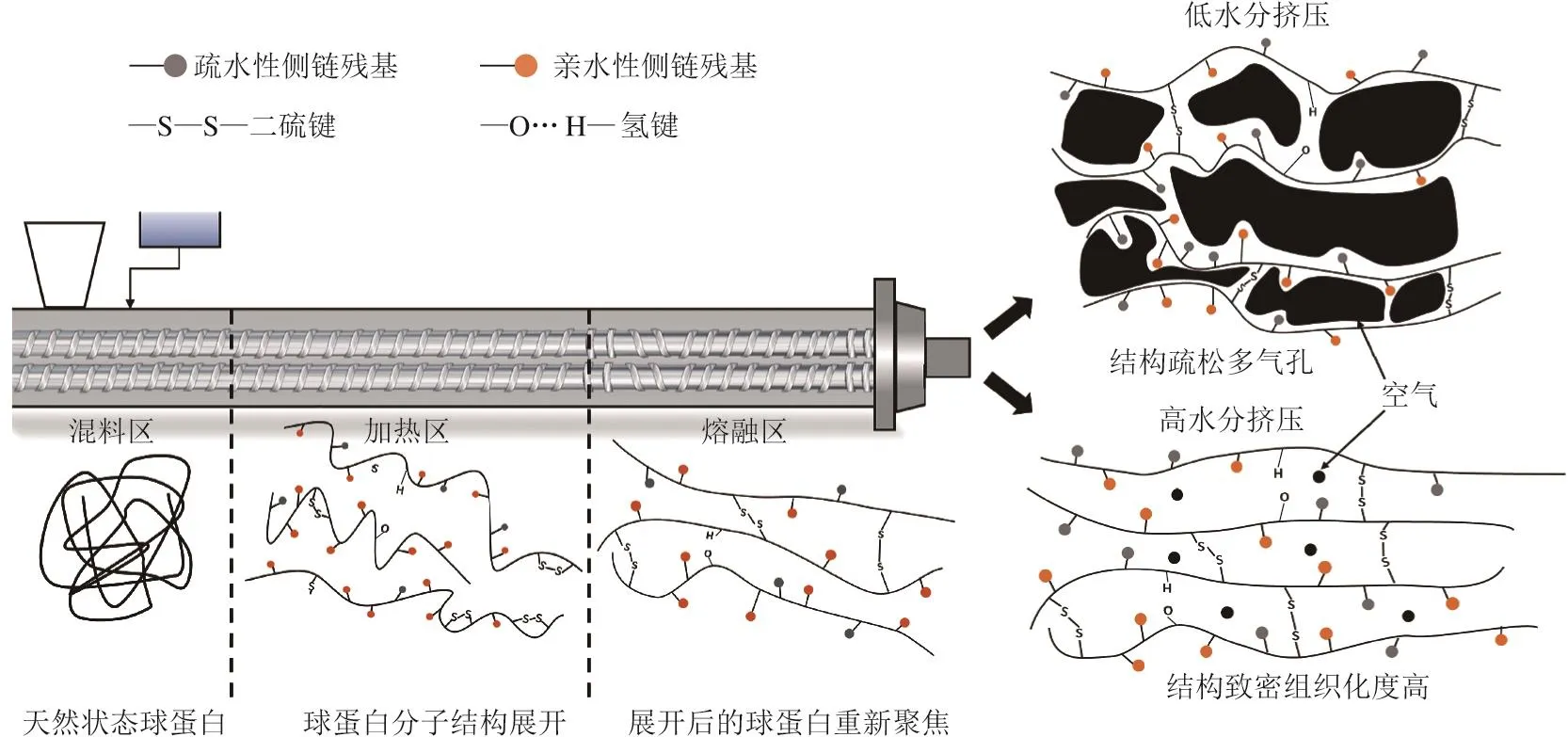
圖1 擠壓過程中大豆蛋白結構變化機理[27]Fig.1 Structural changes of soybean proteins during extrusion[27]
黏性熔體的多相體系的形成是組織化形成的另一主要原因[49,85]。實驗表明,在大豆蛋白和面筋蛋白形成水合混合物中由于水分分布不均會形成獨立分離的兩相[86-87]。一些學者認為需要多種成分才能獲得兩相體系,例如大豆分離蛋白雖由多種蛋白組成,但在熔化時通常被認為是單相。而一些單組分擠壓實驗結果中出現(xiàn)的纖維化結構則被認為是單組分系統(tǒng)中的不溶性和非熔融性組分充當了另一相的作用,例如大豆?jié)饪s蛋白中的多糖等[89-90]。此外,熔體的流動行為不同也會導致不同的結果,比如層流或湍流[49]。
6 結 語
素肉制品仍是一個極具發(fā)展前景的未來健康食品。我國低水分擠壓生產(chǎn)素肉制品已十分普遍,但高水分擠壓素肉制品市場規(guī)模與國外尚有差距,需要加大研發(fā)力度并實施相關政策調(diào)控,促進素肉制品擴大產(chǎn)業(yè)規(guī)模。當前素肉制品仍需突破以下幾個方面的問題:1)擠壓產(chǎn)品的纖維結構形成機理不明確,具體是各研究在形成機理上的探究深度不一致,且相關結論在不同蛋白間不存在普遍性;2)整合化學、物理、食品加工等多學科研究成果,從植物蛋白質(zhì)資源開發(fā)、組織化技術、重組和產(chǎn)品色香味形以及營養(yǎng)健康品質(zhì)等多方面進行綜合考量,確定最佳產(chǎn)品工藝參數(shù);3)對相關原料和產(chǎn)品屬性的測定與分析不夠精準。相信未來植物基肉制品能憑借健康環(huán)保等優(yōu)勢,為廣大消費者所接受并喜愛,成為一種必不可少的餐桌食品。

