抗煙草花葉病毒(TMV)生防菌的鑒定及其發酵條件優化
趙譽強,朱三榮,劉天波,,滕 凱,蔡海林,周向平,曾維愛,楊紅武,戴良英,周志成,周 鵬,唐前君*
1.湖南農業大學植物保護學院,長沙市芙蓉區農大路1號 410128
2.中國煙草總公司湖南省公司,長沙市天心區芙蓉南路一段628號 410004
煙草普通花葉病毒病是一種在世界范圍內廣泛傳播的植物病害,由煙草花葉病毒(Tobacco mosaic virus,TMV)通過微傷口侵入宿主引起感染[1]。該病毒傳播速度快,寄主廣,遺傳變異性高,復合侵染,傳統的化學方法難以控制煙草普通花葉病毒病的侵染[2]。生防微生物的應用成為植物病蟲害防治的重要手段,利用拮抗細菌防治煙草病害已有相關報道。李軍營等[3]用平板對峙法從云南昆明青枯病發病煙田中篩選出1株對青枯病有拮抗作用的菌株Y4;王雯麗等[4]從煙草產區的健康煙苗中分離篩選出2株對赤星病有良好抗性的菌株,并對種子萌發有顯著的促生效應;付博等[5]從煙草根結線蟲卵囊中分離鑒定出1株貝萊斯芽胞桿菌(Bacillus velezensis),其發酵濾液對二齡幼蟲的校正死亡率達到91.7%。在煙草病毒病防治上,芽胞桿菌屬(Bacillus)拮抗菌可有效降低TMV的傳播和發病程度[6];申莉莉等[7-8]從煙田土壤中分離出的兩株TMV拮抗細菌By33和By88,發酵產物對TMV有預防和鈍化作用,活性物質可抑制病毒在煙株體內復制且誘導植物產生抗性;Park等[9]從綠針假單胞菌(Pseudomonas chlororaphis)O6中提取的抗病毒肽對TMV病毒的抑制率超過95%;余惠榮等[10]和厲彥芳等[11]從土壤中篩選鑒定的側孢短芽胞桿菌(Brevibacillus laterosporus)對TMV的抑制率為87.52%。郭叢等[12]從病毒病土壤中分離鑒定出1株對TMV有顯著拮抗作用的惡臭假單胞菌(Pseudomonas putida)A3,發酵上清液對病毒的抑制率為95%,該菌劑還能降低煙葉內煙堿含量。生防菌劑的田間應用和工業化生產還需對發酵培養基和培養條件進行篩選和優化,許大鳳等[13]、陳越等[14]通過單因素和響應面法優化培養基和發酵條件,優化后的拮抗效果和抗菌活性物質產量均顯著提高。此外,生防菌的田間應用效果并不穩定,防治對象單一,不同產區種煙制度和生態環境的差異都會影響生防菌劑的定殖,并產生耐藥性,同時菌種多次轉接傳代,優良遺傳性狀可能發生變異退化現象。因此,在不同的生態環境中挖掘和發現新的土著有益微生物防治煙草普通花葉病毒病十分重要。近年來貝萊斯芽胞桿菌(Bacillus velezensis)作為芽胞桿菌屬的一個新種而被廣泛關注,該菌在抑制病原物和生物防治上具有顯著優勢,但國內利用貝萊斯芽胞桿菌在植物病毒病防治中的應用報道較少。為此,從感染TMV病株的根際土壤中篩選出對TMV有顯著拮抗作用的菌株Z5,并開展形態學觀察、生理生化試驗和分子生物學鑒定,篩選最適發酵培養基,確定最佳發酵條件,旨在為煙草普通花葉病的有效防治和生防菌的田間應用提供依據。
1 材料與方法
1.1 試驗材料
土壤樣品:湖南農業大學耘園煙草試驗基地普通煙草花葉病毒病發病K326品種的煙株根際土壤;供試植物:三生煙(Nicotiana tabacumvar.samsun nn),種植于湖南農業大學植物病理學防蟲溫室;供試毒源:采自長沙市寧鄉煙田,經過4次單斑分離,分子檢測為純TMV,保存在湖南農業大學東沙植保基地;磷酸緩沖液(0.02 mol/L):NaH2PO4·12H2O 4.37 g,Na2HPO4·2H2O 1.22 g,pH 7,溶 于1 000 mL ddH2O,121℃滅菌20 min。
試劑:配置培養基、生理生化試驗所需藥品均為滬試國藥集團產品(分析純),16S rDNA片段擴增試劑購自北京全式金生物公司,DNA提取試劑盒購自天根生化科技公司,鹽酸嗎啉胍(20%可濕性粉劑,上海慧光化學公司);儀器:電熱恒溫培養箱(DHP-9082A,上海精宏實驗設備有限公司);熒光顯微鏡(Nikon-80i,日本尼康公司);小型高速離心機(Centrifuge 5424,德國Effendorf公司);PCR擴增儀(T00TMThermal Cycle,美國BIO-RAD公司)。
1.2 拮抗菌株的篩選與鑒定
1.2.1 拮抗菌株的篩選
稀釋分離法分離細菌,將5 g根際土壤樣品放入盛有45 mL無菌水的錐形瓶中,振蕩器振蕩1 h,在28℃恒溫培養箱靜置12 h或過夜培養。抽濾棄去沉淀后,獲得1×10-1菌懸液。無菌水梯度稀釋得到1×10-2、1×10-3、1×10-4、1×10-5、1×10-6和1×10-7不同濃度的菌懸液,各吸取200μL涂布于NA培養基,28℃恒溫培養箱倒置培養1 d,間隔12 h觀察菌落生長情況,挑取特征不同的單菌落畫線純化2~3次,-80℃保存備用[15]。
1.2.2 拮抗菌株的活性鑒定
初篩選菌種用局部枯斑法復篩獲得具有生防潛力菌種,即取單菌落接種到25 mL NB培養基中,放置在30℃、180 r/min搖床中培養52 h,所得發酵液于10 500 r/min離心15 min除去菌體,上清液經細菌過濾器(0.45μm)過濾得無菌培養液[12]。
稱取適量感病葉片,加少許綠色碳化硅研磨至勻漿,按1∶100(質量體積比)加入磷酸緩沖液配制成100倍TMV接種液,分別與NB培養基和無菌培養液等體積混合。選擇葉片大小、長勢一致的健康5~6葉期三生煙煙苗進行摩擦接種,右半葉接種NB培養基與病毒液的混合液為對照,左半葉接種無菌培養液與病毒液混合液為處理,接種5 min后用清水噴灑葉面。每株接種2~4個葉片,重復3次,早晚各噴清水1次。3 d后統計枯斑數,并計算抑制率[16](局部枯斑法)。

1.2.3 菌種鑒定
1.2.3.1 形態特征觀察
用交叉劃線法將拮抗菌株接種到LB培養基上,30℃恒溫培養24~48 h,觀察單菌落在培養基上的大小、顏色等特征;分別進行芽胞、莢膜、鞭毛染色,干燥后顯微鏡觀察形態。
1.2.3.2 生理生化試驗
依據細菌鑒定手冊[17]進行生理生化試驗,每組試驗設置空白對照,重復兩次。
1.2.3.3 菌株16S rDNA序列測序
用TIANGEN TIANamp Bacteria DNA Kit試劑盒(天根生化科技公司)提取細菌基因組DNA。依據呂翠等[18]的方法使用PCR進行菌落鑒定,擴增產物由上海生物工程技術公司測序。測序結果上傳NCBI數據庫進行Blast比對,下載同源性較高的屬內菌株基因序列。利用Mega 7.0軟件采用鄰接法構建系統進化樹。
1.2.3.4 全基因組測序
利用Illumina Miseq測序平臺對Z5基因組DNA進行測序,使用soapdefve包進行組裝,利用Glimmer軟件對編碼序列(CDSs)進行預測。利用在線平臺tRNAscan-SE和RNAmmer分別對tRNA和rRNA進行鑒定。使用在線平臺antiSMASH 2.0對次生代謝產物進行預測。
1.3 田間試驗
在歷年煙草普通花葉病毒病發病嚴重的煙田(湖南省長沙市寧鄉煙草站)中進行拮抗菌株防治效果的小區試驗。煙苗于3月中旬移栽,行株距為1.2 m×0.5 m。設置3個處理,分別為空白(清水對照),處理(Z5培養液,菌液濃度為6.1×106cfu/mL,直接噴霧),藥劑對照(鹽酸嗎啉胍,800倍稀釋液,3 kg/hm2),每處理4次重復,共計12個小區。各小區采取隨機區組排列方式,每小區4行,每行栽煙60株。大田期共用藥3次,第1次在移栽后10 d施藥,第2次和第3次分別在移栽后15 d和移栽后20 d施藥。施藥方法:煙株正反面均勻噴霧,最后一次施藥后30 d按照GB/T 23222—2008[19]調查煙草普通花葉病毒病發病情況,并計算各處理發病率、病情指數和防治效果。

1.4 發酵培養基的篩選
參考文獻[12]的方法,拮抗菌株在NA培養基上平板劃線,28℃恒溫培養64 h后,挑取單菌落接種NB培養基,每500 mL錐形瓶中裝200 mL培養基,28℃、180 r/min搖床培養64 h,得到的發酵液作為種子液用于后續試驗。
基礎培養基:備好裝有60 mL的NB培養基、LB液體培養基和金氏液體培養基,在超凈工作臺中接種2 mL種子液于3種培養基上,3次重復,放置在28℃,180 r/min恒溫搖床培養64 h后,發酵液用局部枯斑法進行抗病毒拮抗活性測定(方法同1.2.2節)。用平板菌落計數法來測定菌落生長情況,將培養的發酵液稀釋至1×10-7,取100μL菌稀釋液涂布于NA培養基,每處理3次重復,12 h后用菌落計數器計算菌落總數[12]。
最佳碳源、氮源:分別添加等量的麥芽糖、葡萄糖、蔗糖、乳糖和可溶性淀粉代替基礎培養基的碳源;分別添加等量的魚粉、蛋白胨、酵母膏、硫酸銨和硝酸銨替換基礎培養基中的氮源,每處理3次重復,接種2 mL種子液后搖床培養64 h,篩選最佳碳源、氮源種類。
1.5 發酵條件的優化
參考文獻[12]的方法,采用最適培養基發酵,分別對不同發酵條件進行優化篩選。發酵時間分別設置為24、36、48、60和72 h;初始pH分別設置為5.0、6.0、7.0、8.0、9.0、10.0和11.0;培養溫度分別設置為20、24、28、32、36和40℃;裝液量設置為250 mL的三角瓶中分別裝入25、50、75、100和125 mL培養基。
以上試驗每組處理接種2 mL的種子液,3次重復,確定最佳發酵條件。菌數計量方法同1.4節,菌株抗TMV活性的測定方法同1.2.2節。
1.6 數據處理
使用SPSS 17.0和Excel 2019軟件對試驗數據進行統計分析和制圖,采用Duncan's新差復極法進行差異顯著性檢驗。
2 結果與分析
2.1 拮抗菌株的篩選與活性鑒定
從土壤中共分離出細菌菌株64株,用局部枯斑法計算菌株抗TMV平均抑制率,篩選出5株菌株對TMV抑制率超過70%(表1),其中Z5無菌培養液對TMV拮抗效果最佳,抑制率達96.40%(圖1)。

表1 分離菌株對TMV的抑制率Tab.1 Inhibition rates of isolated bacterial strains against TMV

圖1 菌株Z5對TMV的拮抗活性Fig.1 Antagonistic activity of bacterial strain Z5 against TMV
2.2 拮抗菌株的鑒定分析
2.2.1 菌株形態
平板上的菌株Z5為白色不透明菌落,外表無光澤,邊緣不規則,正面凸起,初期水漬、較粘,后期褶皺,呈擴散狀。Z5內生芽胞,芽胞呈橢圓形,具莢膜和鞭毛,是兩端鈍圓的短桿狀菌體。
2.2.2 生理生化試驗鑒定
生理生化試驗結果顯示,除氧化酶試驗、硫化氫試驗、吲哚試驗結果為陰性外,其他均為陽性(表2),結合菌落及菌體形態特征,初步鑒定菌株Z5為芽胞桿菌屬(Bacillus)。
表2 菌株Z5的生理生化特性Tab.2 Physiological and biochemical characteristics of bacterial strain Z5
2.2.3 分子生物學鑒定
菌株測序結果通過NCBI比對,以NCBI中已發表的16S rDNA基因序列為基礎,構建系統進化樹。拮抗菌株Z5與貝萊斯芽胞桿菌(Bacillus velezensis)親緣關系最近(圖2),同源性達到99%以上。
圖2 菌株Z5的16S r DNA系統進化樹Fig.2 Phylogenetic tree of bacterial strain Z5 based on 16Sr DNA sequence
2.2.4 全基因組測序
通過測序和組裝獲得了貝萊斯芽胞桿菌Z5的基因組數據。其中包含3 913 900 bp,GC含量(質量分數)為46.5%,分布于283個contigs中。根據基因組數據,鑒定出1個5S-16S-23S操縱子、32個tRNAs和3 975個蛋白編碼序列(CDSs)。
菌株Z5的基因組中含有多種合成抗菌代謝產物和抗生素(次生代謝產物)的基因簇,包括具有生物控制功能的脂肽(LP)和聚酮(polyketides)。通過antiSMASH 2.0預測,在菌株Z5中發現非核糖體肽合成酶(NRPSs),編碼4'-磷酸腺苷基轉移酶(phospho-pantheinyl transferase,Sfp)。Z5還包括表面活性素(surfactin)、豐原素(fengycin)、桿狀肌動蛋白(bacillibactin)和桿菌霉素D(bacillomycin D)。
2.3 貝萊斯芽胞桿菌Z5的田間防治效果
田間小區試驗煙苗發病情況調查結果(表3)顯示,菌株Z5培養液處理的煙株發病率和病情指數較清水對照顯著降低,Z5培養液對煙草普通花葉病毒病的田間防效達到50.43%,和鹽酸嗎啉胍800倍稀釋液處理的防治效果(54.80%)差異不顯著。

表3 Z5培養液對TMV的田間防效①Tab.3 Field control efficacy of Z5 culture solution against TMV
2.4 發酵培養基的篩選
培養基:Z5在3種培養基中生長情況不同,菌數差異顯著,NB培養基中Z5菌數最多(5.79×1010cfu/mL),對TMV抑制率最高(98.02%)。因此,選用NB培養基進行后續發酵條件試驗(圖3A)。
碳源、氮源:以葡萄糖為碳源的培養基中菌株Z5菌數最多(5.68×1010cfu/mL),且發酵液抗病毒效果最好(97.18%)(圖3B)。Z5在常見的氮源中生長存在明顯差異,在酵母膏中的菌數最多,且病毒的抑制率最高(98.14%)(圖3C)。因此,葡萄糖、酵母膏為最適碳源和氮源。
圖3 培養基(A)、碳源(B)和氮源(C)對菌株Z5的菌數及其抗病毒活性影響Fig.3 Effects of culture mediums(A),carbon sources(B),nitrogen sources(C)on bacterial count and antiviral activity of bacterial strain Z5
2.5 發酵條件的優化
2.5.1 發酵時間對Z5抗TMV活性的影響
隨著發酵時間的推移,菌數在穩定增長,并在培養72 h后達到最大值;同時菌株的抗病毒物質逐漸積累,48 h后抗病毒效果顯著增強,60~72 h之間,逐漸穩定,病毒抑制率達94.14%,72 h時達到最大菌數4.91×1010cfu/mL(圖4)。因此,選擇72 h為最佳發酵時間。
圖4 發酵時間對菌株Z5及其抗病毒活性的影響Fig.4 Effects of fermentation time on bacterial count and antiviral activity of bacterial strain Z5
2.5.2 初始pH對Z5抗TMV活性的影響
初始pH對菌體Z5的菌數和抗病毒效果的影響有顯著差異(圖5)。初始pH在7.0~10.0,較適合菌株生長,初始pH為10.0時菌數最多(6.35×1010cfu/mL),初始pH繼續升高到11時,菌數驟降;對病毒抑制率也呈現相似的趨勢,初始pH為7.0時抗病毒效果最好(97.14%)。綜合分析認為,菌株Z5最佳發酵初始pH為7。
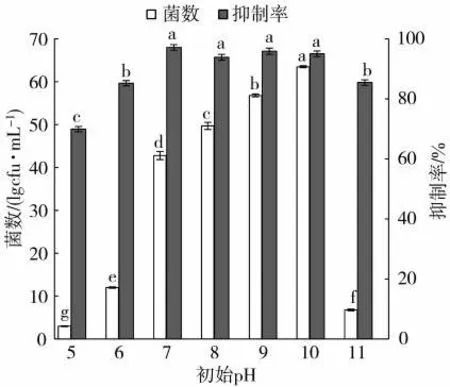
圖5 初始p H對菌株Z5的菌數和抗病毒活性影響Fig.5 Effects of initial pH on bacterial count and antiviral activity of bacterial strain Z5
2.5.3 培養溫度對Z5抗TMV活性的影響
在28℃條件下發酵,Z5的產菌數達到最大(6.98×1010cfu/mL),對病毒抑制率也最高(95.04%),低于和高于28℃時,Z5的產菌數出現了明顯下降。36℃時Z5發酵液的抗病毒效果明顯下降,40℃時產菌數遠低于28℃,且病毒抑制率低于10%(圖6)。可見,Z5的最佳發酵溫度為28℃。
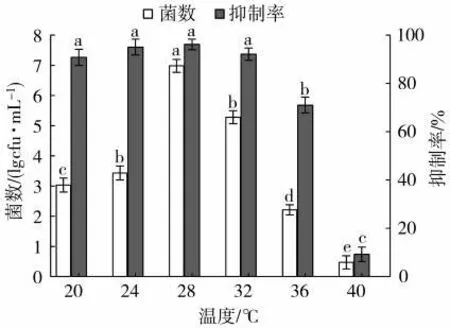
圖6 不同溫度對菌株Z5的菌數及其抗病毒活性的影響Fig.6 Effects of fermentation temperature on bacterial count and antiviral activity of bacterial strain Z5
2.5.4 裝液量對Z5抗TMV活性的影響
裝液量的不同對菌株的生長和病毒抑制效果有顯著影響(圖7)。當裝液量為100 mL時,菌株Z5的產菌數達到最大(8.36×1010cfu/mL),同時對病毒抑制率達到最大(98.71%)。裝液量低于或高于100 mL時,其產菌數和對病毒抑制率均有明顯下降,出現了供氧不足的情況。因此,Z5的最適裝液量為100 mL/250 mL。
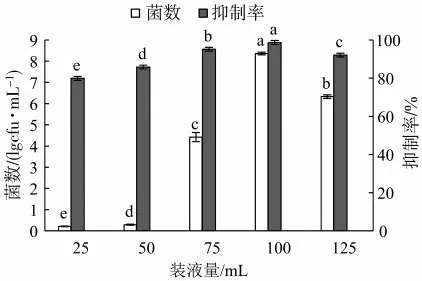
圖7 不同裝液量對菌株Z5的菌數及其抗病毒活性的影響Fig.7 Effects of medium volumes on bacterial count and antiviral activity of bacterial strain Z5
3 討論
本試驗中從湖南省長沙市芙蓉區耘園煙草普通花葉病發病植株根際土壤中篩選出1株對TMV拮抗效果良好的細菌菌株Z5,對TMV的枯斑抑制率高達96.40%,經形態學鑒定為貝萊斯芽胞桿菌。為增加菌株Z5的發酵產量和抗病毒活性物質產出,以Z5的菌數和對TMV的抑制率為主要評價指標,對發酵培養基和發酵條件進行優化,不同的培養基和不同的發酵條件產生的拮抗物質含量和抑制效果存在明顯差異。Z5在以葡萄糖為碳源和以酵母膏為氮源的NB培養基上生長情況最好,更容易產生拮抗物質;優化試驗結果表明菌株Z5的初始pH和發酵時間與多數芽胞桿菌屬的試驗結果一致,但培養溫度和裝液量有所差異[20-23],這可能是由菌株的遺傳特性、生活環境或作用對象不同所致。貝萊斯芽胞桿菌Z5對TMV有明顯的抑制作用,與申莉莉等[7-8]分離到的B.amyloliquefaciens菌株Ba33相似,該菌通過體外鈍化、抑制侵染和誘導抗性等機制來抑制TMV的侵染。基于全基因組測序和功能預測,推測貝萊斯芽胞桿菌Z5產生的拮抗物質如表面活性素、桿菌霉素等脂肽類和聚酮類物質可能對病毒粒體的完整性造成破壞,會損傷細胞膜、細胞壁。Z5還可能會影響煙草的SA和JA信號通路,誘導系統抗性。但有關活性物質成分和作用機理、是否具有促進植物生長和其他作用等還需進一步的深入研究。此外,本試驗中僅在搖床條件下對Z5培養基及發酵條件進行優化,而相關發酵工藝以及Z5發酵液與其他生物活性成分的復配等還需要進一步驗證和完善。
4 結論
篩選鑒定出1株對TMV有明顯抑制作用的貝萊斯芽胞桿菌Z5,對TMV抑制率為96.40%,貝拉斯芽胞桿菌Z5的最適培養基和發酵條件是采用NB培養基作為基礎培養基,葡萄糖為碳源,酵母膏為氮源,初始pH 7.0,裝液量100 mL/250 mL,培養溫度28℃,發酵時間60~72 h。優化后菌數增長44.38%,對TMV抑制率穩定,可達到98.71%。田間小區試驗對普通煙草花葉病毒病防效達到50.43%,與鹽酸嗎啉胍(可濕性粉劑)的防效基本相當。

