透明質酸對大鼠胃黏膜損傷的保護作用研究
劉 磊,張美霞,廉少杰,康傳利,湯麗偉,劉 薔,張夢益,李 慶
(山東焦點福瑞達生物股份有限公司,山東 曲阜 273100)
胃病的發生與胃黏膜損傷密切相關,胃黏膜受損將加快病情進展。導致胃黏膜損傷的主要因素包括物理因素和化學因素[1]。其中,長期進食過熱或過冷的食物、烈酒、濃茶或刺激性藥物如消炎痛(吲哚美辛腸溶片)等,均使胃內黏液減少,引起黏膜微循環障礙,削弱脂蛋白膜對胃的保護作用[2]。臨床治療中,西藥治療雖有一定療效,但停藥后易復發,長期使用毒副作用大。天然活性物質因其長效、溫和、低毒副作用等諸多優勢越來越得到重視。
透明質酸(HA)又稱玻璃酸、玻尿酸,廣泛存在于生物體內[3],常見形式是透明質酸鈉(SH)。研究表明,HA有調控細胞與細胞間的黏附、分化,促進細胞的增生與移動等活性,并參與保濕潤滑、傷口愈合、組織修復和再生、胚胎發育等生物進程[4]。因此,HA被認為是最具有生物發展前景的生物活性物質之一[5]。為考察HA對胃黏膜損傷的保護作用,本實驗通過設計酒精性急性胃黏膜損傷模型、消炎痛性胃黏膜損傷模型和冰醋酸注射法胃黏膜損傷模型實驗并予以實施,為HA的進一步應用提供實驗基礎及參考依據。
1 材料與方法
1.1 材料與儀器
1.1.1 動物和試劑 SPF級SD健康大鼠,雄性,5~7周齡,購自濟南朋悅實驗動物繁育有限公司,實驗動物生產許可證號:SCXK(魯)20190003,使用許可證編號:SYXK(魯)2018 0031,飼養條件符合飼養環境條件標準GB14925-2010要求。
SH由山東焦點福瑞達生物股份有限公司提供,平均相對分子質量為1.05×106,硫酸-咔唑法測定SH含量為98.6 %。無水乙醇(分析純,國藥集團化學試劑有限公司),冰醋酸(分析純,國藥集團化學試劑有限公司);硫糖鋁口服混懸液(批號201225,廣東華南藥業集團有限公司)、吲哚美辛腸溶片(批號210101,廣東華南藥業集團有限公司)。
1.1.2 儀器和設備 LE203E/02電子天平、ACS-JJTiger電子秤(梅特勒-托利多儀器(上海)有限公司);電子數顯卡尺(哈爾濱量具刃具集團有限公司);微量進樣器(上海高鴿工貿有限公司);Honeywell EBI環境監控系統。
1.2 實驗方法
1.2.1 實驗動物飼養及分組處理 實驗大鼠飼養在山東省藥學科學院新藥評價中心,溫度為22±2 ℃,晝、夜明暗交替時間為12 h/12 h。動物實行分籠飼養,每籠5只,自由飲水、進食。適應性喂養5 d后分組,每組10只動物,劑量設計見表1。
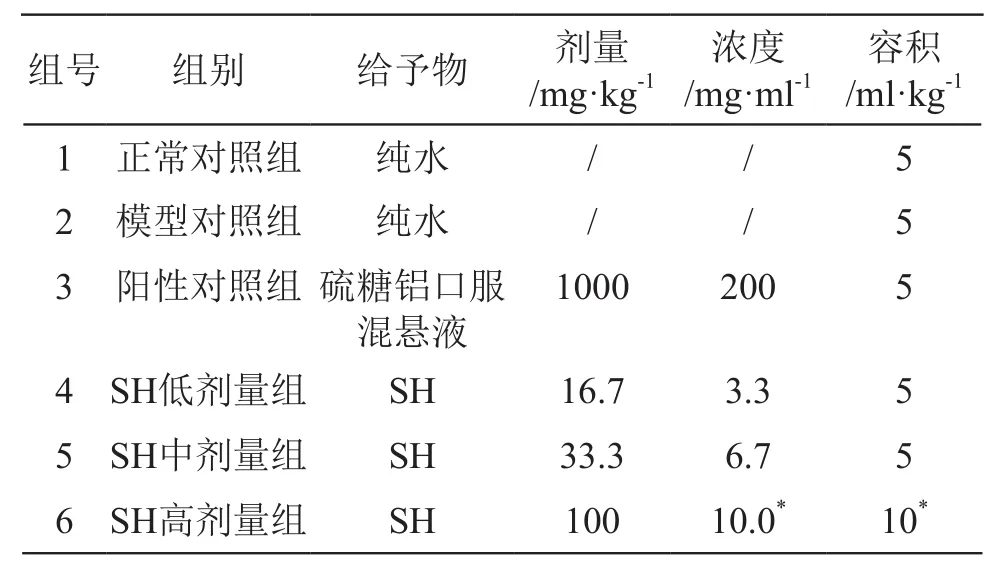
表1 劑量設計表
根據國家衛健委2020年第9號公告要求,SH正式納入新食品原料目錄,公告中SH推薦食用量≤200 mg/d(約合3.33 mg/kg),根據《對胃黏膜損傷有輔助保護功能檢驗方法》規定,受試物應有一個人體推薦劑量的5倍劑量組,故設SH低、中、高劑量組為16.7,33.3,100 mg/kg,分別是人體推薦劑量的5倍、10倍和30倍。陽性對照組采取硫糖鋁口服混懸液,硫糖鋁口服混懸液臨床使用最大日劑量為8 g/d,折算大鼠等效劑量約為833 mg/kg。考慮操作的可行性,將大鼠灌胃劑量設為1000 mg/kg。
1.2.2 胃黏膜損傷模型建立
1.2.2.1 酒精性急性大鼠胃黏膜損傷模型:各劑量組動物給予受試物30 d后,全部動物嚴格禁食24 h(不禁水),此期間禁止給予受試物。除正常對照組外,所有實驗組動物給予無水乙醇1.0 ml/只,1 h后麻醉處死全部動物。剖開腹部,暴露完整胃,結扎幽門,灌注適量10 %甲醛溶液,固定20 min,然后沿胃大彎剪開,洗凈胃內容物,展開胃黏膜,肉眼下用游標卡尺測量出血點或出血帶的長度和寬度,并對胃黏膜損傷進行評分。大體檢查完畢,將每只動物胃黏膜損傷最嚴重的部位切下,固定于10 %甲醛溶液,進行組織病理學檢查[6]。
1.2.2.2 消炎痛致大鼠胃黏膜損傷模型:各劑量組動物給予受試物30 d后,全部動物嚴格禁食24 h(不禁水),此期間禁止給予受試物。除正常對照組外,所有實驗組動物一次性腹腔注射消炎痛40 mg/kg(吲哚美辛腸溶片),5 h后麻醉處死全部動物。剖開腹部,暴露完整胃,結扎幽門,灌注10 %甲醛溶液5 ml/只,固定20 min,然后沿胃大彎剪開,洗凈胃內容物,展開胃黏膜,肉眼下用游標卡尺測量出血點或出血帶的長度和寬度,并對胃黏膜損傷進行評分。大體檢查完畢,將每只動物胃黏膜損傷最嚴重的部位切下,固定于10 %甲醛溶液,進行組織病理學檢查[7]。
1.2.2.3 冰醋酸致大鼠慢性胃黏膜損傷模型:動物禁食不禁水24 h后,麻醉后消毒腹部,于劍突下切開腹腔,將胃輕拉出腹腔外,用微量注射器于胃幽門處漿膜下注射30 μl 30 %冰醋酸,縫合切口,術后正常喂食和水。第二天選取術后狀態良好的50只動物根據體重按普通拉丁方法分為模型對照組、陽性對照組、SH低劑量組、SH中劑量組和SH高劑量組,另隨機選取10只未造模的動物為正常對照組。每組10只動物。各組別動物連續14 d灌胃給予相應受試物后,全部動物禁食24 h后處死,取出整個胃浸泡于10 %的甲醛內,浸泡20 min后沿胃大彎剪開,洗凈內容物,取腺胃區展開平鋪于玻璃板上,用紙吸干潰瘍內的水分,測量其面積和體積[8]。
1.3 測量指標和方法
1.3.1 胃黏膜損傷觀察和評分 將胃組織沿胃大灣剪開,洗凈內容物,展開胃黏膜,用游標卡尺測量出血點或出血帶的長度和寬度,并對胃黏膜損傷進行評分,急性胃黏膜損傷乙醇及消炎痛模型評分標準見表2、表3[9-10]。

表2 急性胃黏膜損傷乙醇模型評分標準

表3 急性胃黏膜損傷消炎痛模型評分標準
按表2、表3所述內容進行如下指標的計算:
(1)損傷發生率(%)=該組出現出血或潰瘍的大鼠數量/該組大鼠數量×100 %
(2)損傷積分=出血點分值+長度分值+(寬度分值×2)
(3)損傷積分指數 = 組損傷評分總和/組動物數量
(4)損傷抑制率(%)=(A-B)/ A×100 %
式中:A:模型對照組的損傷積分指數;B:其他實驗組的損傷積分指數
1.3.2 動物組織病理學檢查 將10 %甲醛溶液固定的組織,常規制片,蘇木精-伊紅染色法(HE)染色,選擇胃黏膜正橫切面,包括黏膜全層的區域觀察。評分方法以充血、出血、黏膜細胞變性壞死在整個黏膜上皮層的累計程度分為5級[11]。充血權重為1,出血權重為2,上皮細胞變性壞死權重為3,評分標準及病變總積分公式見表4。

表4 急性胃黏膜損傷鏡下評分標準
通過表4計算病變總積分:
病變總積分=充血積分+出血積分×2+上皮細胞變性壞死積分×3
1.3.3 潰瘍面積和體積測量方法 于帶標尺的解剖顯微鏡下計數潰瘍所占的方格數,換算成面積,然后用微量注射器將有色墨水注入潰瘍內,將潰瘍填滿與周邊平齊,讀取微量注射器上刻度即為潰瘍的體積。
1.4 數據統計與分析
實驗數據用平均值±標準差表示,采用SPSS Statistics 18軟件對數據進行分析,對數據Levene’s檢驗檢測方差齊性,如果方差齊(P>0.05),則進行單因素方差分析(ANOVA):有統計學差異時(P<0.05),采用Dunnett t檢驗進行組間差異比較;如果方差不齊(P<0.05),則進行Kruskal-Wallis 檢驗:差異有統計學意義時(P<0.05),采用Mann-Whitney U 秩和檢驗(M-W法)比較組間差異。組間差異比較在各劑量組與對照組之間進行,所有檢驗均為雙側檢驗,α=0.05。
2 結果與分析
2.1 乙醇致大鼠急性胃黏膜損傷模型試驗結果
2.1.1 SH對大鼠體質量的影響 在30 d的實驗周期內,各實驗組大鼠外觀體征和行為活動未見異常,無中毒體征及死亡。各受試物灌胃干預30 d后,各組間動物質量未見明顯差異(見圖1)。
圖1 SH對乙醇致大鼠胃黏膜損傷實驗初始質量及終末質量的影響
2.1.2 SH對乙醇致大鼠胃黏膜損傷模型評分的影響各組胃黏膜損傷積分指數及抑制率見表5。
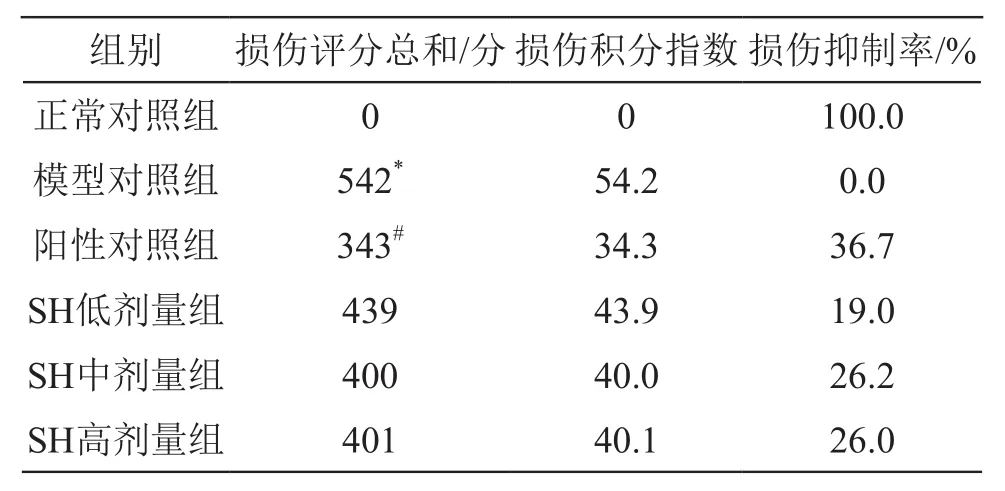
表5 乙醇致大鼠急性胃黏膜損傷積分指數及損傷抑制率(n=10)
由表5可見,模型對照組大鼠胃黏膜損傷最嚴重;與模型對照相比,其余各組胃黏膜損傷情況減輕。SH低、中、高劑量組對乙醇致大鼠急性胃黏膜損傷抑制率雖不如陽性對照組高,但與模型對照組相比,對乙醇引起的胃黏膜損傷仍有較強的保護作用。
2.1.3 組織病理學 各組動物病變總積分見表6,組織病理學檢查見圖2。
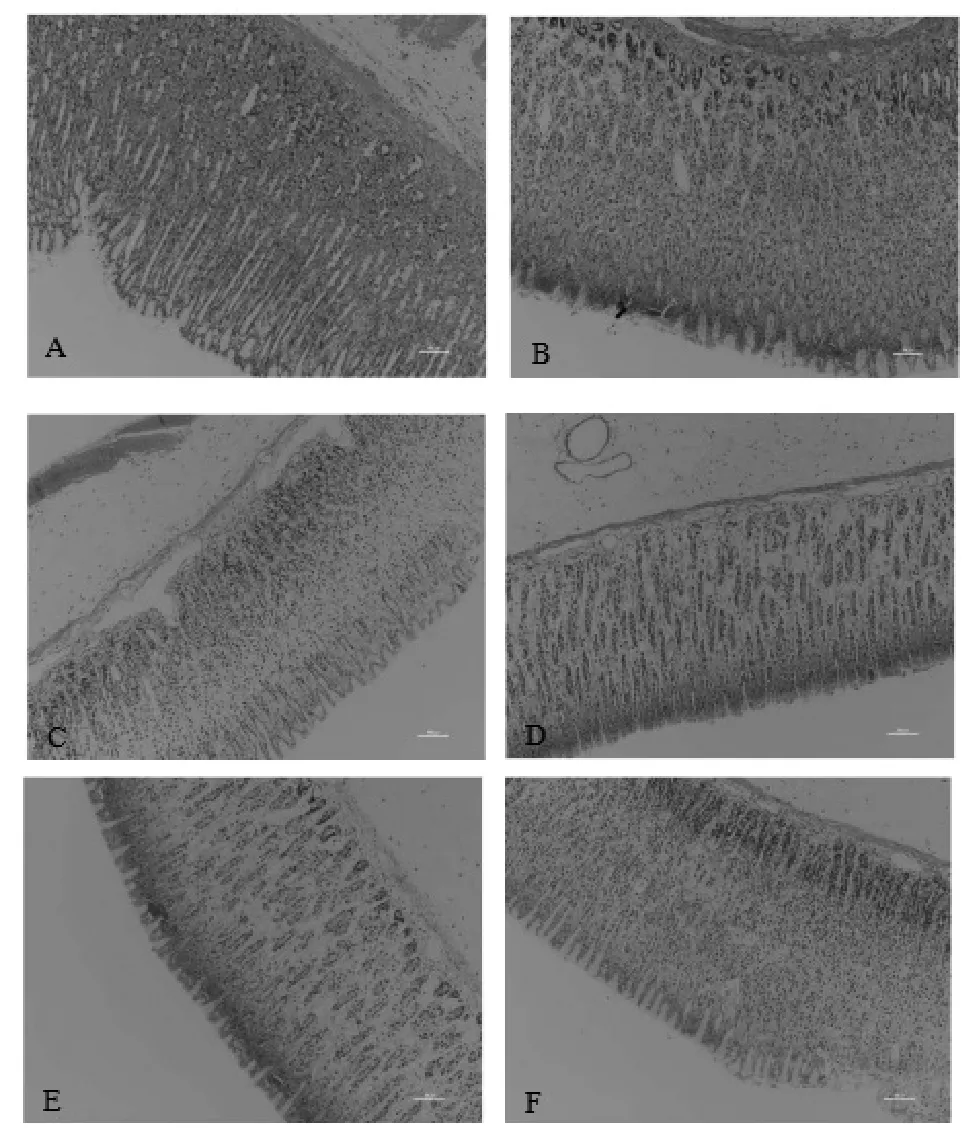
圖2 乙醇致大鼠胃黏膜損傷組織病理照片
由表6可見,除正常對照組外,其余組別SD大鼠胃黏膜病變總積分均顯著升高,與之相比,SH低、中、高劑量組SD大鼠胃黏膜病變總積分平均值為109,明顯降低,與陽性對照組基本持平。
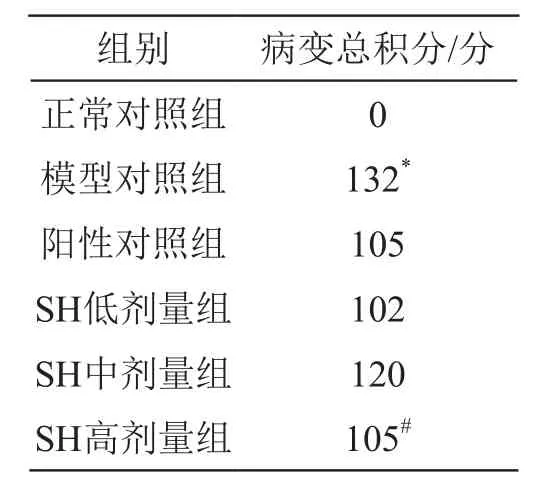
表6 乙醇致大鼠胃黏膜損傷病理學檢查病變總積分
由圖2可見,正常對照組:動物胃黏膜色澤正常,表面光滑,無出血點和出血帶;模型對照組、陽性對照組、SH低、中、高劑量組:動物胃黏膜整體色澤正常,腺區可見出血點及條索狀出血帶,且隨著劑量的增加,腺區出血點及出血帶有明顯減輕,尤其是SH高劑量組。
2.2 消炎痛致大鼠急性胃黏膜損傷模型保護試驗
2.2.1 SH對大鼠體質量的影響 在30 d的實驗周期內,各實驗組大鼠外觀體征和行為活動未見異常,無中毒體征及死亡。各受試物灌胃干預30 d后,各組間動物質量未見明顯差異,各組別動物試驗期間體重正常增長未見明顯異常(見圖3)。

圖3 SH對消炎痛致大鼠胃黏膜損傷實驗初始質量及終末質量的影響
2.2.2 SH對消炎痛致大鼠胃黏膜損傷模型評分的影響 消炎痛致大鼠胃黏膜損傷組損傷積分指數及抑制率見表7。
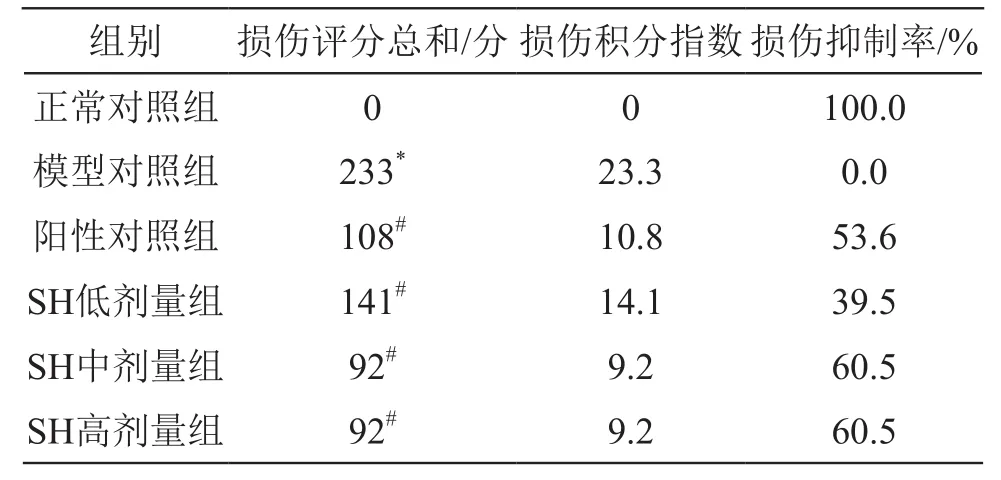
表7 消炎痛致大鼠急性胃黏膜損傷積分指數及損傷抑制率(n=10)
由表7可見,模型對照組損傷積分指數明顯高于SH各劑量組;SH低、中、高劑量組損傷抑制率均較高,尤其是中、高劑量組損傷抑制率高達60.5 %,結果均優于陽性對照組。SH對消炎痛致大鼠急性胃黏膜損傷有保護作用,且隨著SH濃度的提高,保護作用增強。
2.2.3 組織病理學 各組動物病變總積分見表8,組織病理學檢查病變見圖4。
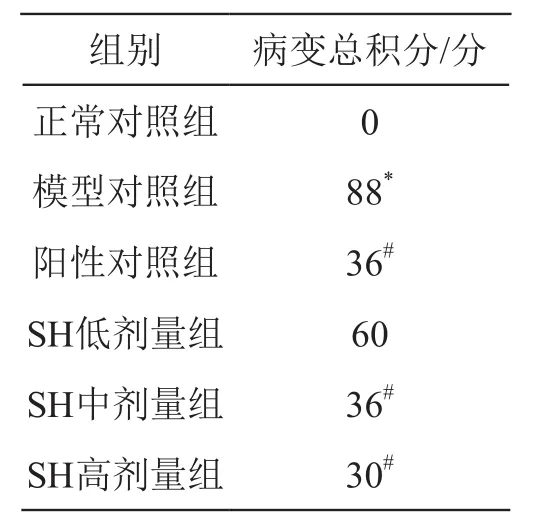
表8 消炎痛致大鼠胃黏膜損傷病理學檢查病變總積分
由表8可見,除正常對照組外,其余組別SD大鼠胃黏膜病變總積分均顯著升高,模型對照組病變總積分88分,與之相比,SH低、中、高劑量組SD大鼠胃黏膜病變總積分均較低,且隨著劑量的增加,病變總積分呈現不斷下降的趨勢;其中SH高劑量組的結果優于陽性對照組。
由圖4可見,正常對照組胃黏膜色澤正常,表面光滑,無出血點及出血帶;其他組動物胃黏膜整體色澤正常,腺區可見出血點或條索狀出血帶,各組胃黏膜損傷發生率均為100 %;且隨著劑量的增加,出血點及出血帶減少,表明SH對消炎痛致大鼠胃黏膜損傷的治療有一定的潛力。
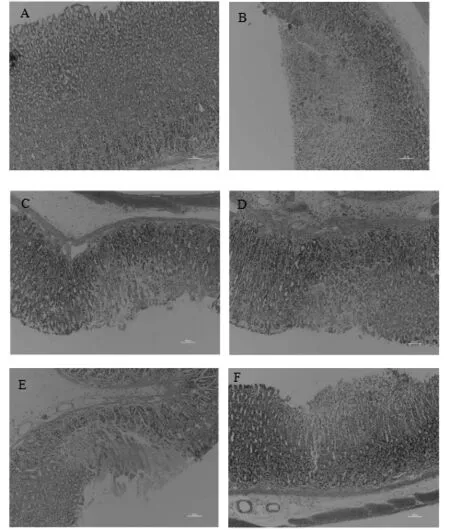
圖4 消炎痛致大鼠胃黏膜組織病理圖片
2.3 冰醋酸致大鼠慢性胃黏膜損傷模型保護試驗結果
2.3.1 冰醋酸對各組動物體質量的影響 各組別動物試驗期間體重正常增長未見明顯異常(P>0.05)(見圖5)。
圖5 冰醋酸致大鼠慢性胃黏膜損傷實驗初始質量及終末質量的影響
2.3.2 動物損傷面積和體積 冰醋酸致大鼠慢性胃黏膜損傷面積和體積見表9 。
表9 冰醋酸致大鼠慢性胃黏膜損傷面積和體積(n=10,±s)
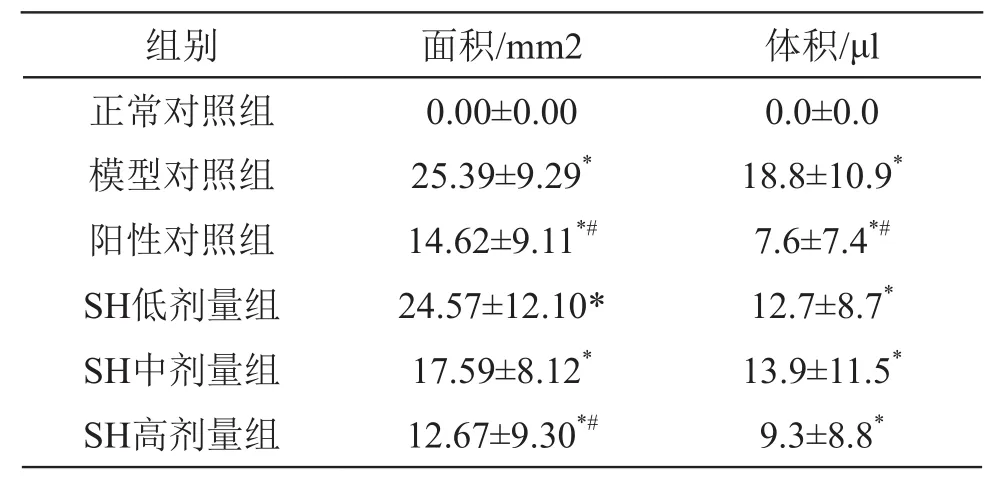
表9 冰醋酸致大鼠慢性胃黏膜損傷面積和體積(n=10,±s)
注:*P<0.05 vs 正常對照組,#P<0.05 vs 模型對照組
組別 面積/mm2 體積/μl正常對照組 0.00±0.00 0.0±0.0模型對照組 25.39±9.29* 18.8±10.9*陽性對照組 14.62±9.11*# 7.6±7.4*#SH低劑量組 24.57±12.10* 12.7±8.7*SH中劑量組 17.59±8.12* 13.9±11.5*SH高劑量組 12.67±9.30*# 9.3±8.8*
由表9可見,模型對照組大鼠慢性胃黏膜損傷面積和體積均是最大值,SH低、中、高劑量組與之相比損傷面積和體積下降趨勢明顯,其中高劑量組的損傷面積比陽性對照組的損傷面積低。SH各劑量組均有減輕冰醋酸所導致胃黏膜損傷的趨勢,且隨劑量增加,對胃黏膜的保護作用越明顯。尤其是SH 100 mg/kg劑量下可顯著(P<0.05)縮小冰醋酸所導致的潰瘍面積,并有縮小潰瘍體積的趨勢。
3 討論
胃黏膜有潤滑、機械保護、抗酸逆流和防止自體消化的作用[12]。胃黏膜易受到環境、飲食、藥物、酗酒等因素的影響,一旦胃黏膜受損,很難恢復如初。目前,胃黏膜損傷模型的建立方法主要有冰醋酸法、無水乙醇灌胃法、熱灼法、應激法等[13]。本實驗采用無水乙醇及消炎痛灌胃法建立急性胃黏膜損傷模型:乙醇可溶解、破壞消化道上皮細胞細胞膜的完整性,從而增加細胞膜通透性,也可刺激黏膜的微循環血管,引起微循環血管收縮、黏膜缺血劑炎癥介質和細胞因子產生;消炎痛引起胃黏膜損傷則主要與中性粒細胞浸潤,脂質過氧化和引起消化道上皮細胞凋亡等有關[14-15]。采用冰醋酸胃壁注射法建立慢性胃潰瘍模型,微量冰醋酸腐蝕胃黏膜,得到很好的胃潰瘍模型,同時又不會危及大鼠的生命[16]。
HA主要分布在關節腔、皮膚、眼玻璃體、軟骨、臍帶和公雞冠等組織中,且研究發現,對不同來源的HA進行結構測定表明,其結構均一致,未發現種屬間差異,只有分子量的差異[11]。研究發現,口服HA可起到美容保健、改善關節功能和骨質疏松、修復胃黏膜損傷、以及促進創傷愈合、改善心血管系統、改善軟骨病癥狀、提高人體免疫力、促血管生成等功效[17-20]。HA正式獲批為新食品原料,產品使用范圍從原來保健食品原料,擴大到新食品原料,為推廣HA的廣泛應用奠定了基礎。在本研究中,SH對無水乙醇、消炎痛誘發的大鼠急性胃黏膜損傷和冰醋酸誘發的大鼠慢性胃黏膜損傷有一定的保護作用,可改善胃黏膜損傷大鼠胃黏膜組織病理變化,逆轉胃黏膜損傷面積和體積,且具有一定的量效關系。研究報道,HA在口腔黏膜、膀胱黏膜、鼻黏膜、皮膚黏膜和角膜損傷中均具有較好的改善效果[21-23],其主要體現在HA可降低損傷黏膜的炎性細胞浸潤,增加熱休克蛋白70的表達等有關[24-25]。綜上,HA對胃黏膜損傷有較明顯的保護作用,為HA開發具有胃黏膜損傷保護作用的功能食品、保健食品和藥品等提供科學參考價值。

