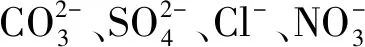二氧化鈦紫外光(UV/TiO2)降解2,4,6-三氯酚的多因素影響
王希誠,高乃云
(1.同濟大學污染控制與資源化研究國家重點實驗室,上海 200092;2.水發規劃設計有限公司,山東濟南 250100)
氯酚類物質是一類化學穩定的有機化合物,被大量應用于印刷、造紙、印染、皮革、制藥等行業,在水體表面、底泥沉積物和土壤中廣泛存在,并有可能通過生物體富集作用進入人體[1]。氯酚類物質毒害性較高,是公認的有毒有害污染物。其中,2,4,6-三氯酚(2,4,6-TCP)作為一種典型的氯酚類物質,在地下水、廢水以及土壤中都可以檢測到[2-3]。目前,中、美、德等國等將其列入控制污染物,世衛組織規定三TCP在飲用水中的允許含量不超過200 μg/L[3-4]。
氯酚類污染物的降解和去除可以采用生物法[5-6]、物理化學法[2,7]、化學還原法[8]、高級氧化法[9]、電極吸附[10]及離子交換[11]等技術,其中高級氧化法由于氧化能力強、處理效果好等優點,是目前研究的熱點。UV/TiO2作為一種常見的高級氧化工藝,具有無毒、節能、高效等優點,目前在有機污染物、無機污染物去除方面的研究已經取得了較大的進展[12-16],被認為是一種極具前途的深度凈化技術。
本試驗基于UV/TiO2高級氧化技術,以納米TiO2為光催化劑,對配制于水溶液中的2,4,6-TCP進行降解,研究催化劑(TiO2)投加量、2,4,6-TCP初始質量濃度、pH等因素以及不同陰離子對其降解情況的影響,初步探討2,4,6-TCP的水處理動力學模型。
1 試驗
1.1 試驗示意圖
圖1為試驗示意圖,反應器上部的紫外燈管置于密閉的黑色套筒中,燈管激發紫外線對下方的反應皿照射,同時,在反應皿中加入已知濃度的TiO2和所需濃度的2,4,6-TCP溶液,通過轉子與磁力攪拌器將兩者混合均勻,從而實現UV/TiO2對目標反應物2,4,6-TCP的高級氧化。
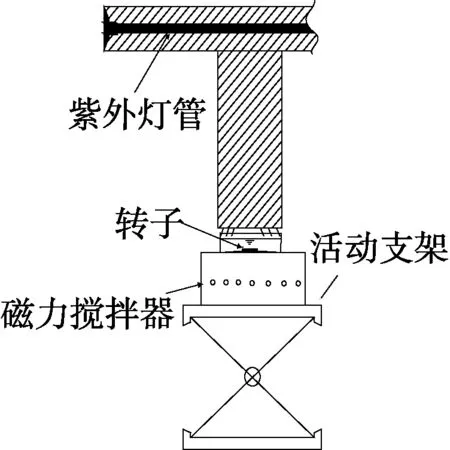
圖1 試驗示意圖Fig.1 Schematic Diagram of Experiment
1.2 試驗藥劑
使用超純水將2,4,6-TCP粉末(Sigma公司,純度>98%)配置為質量濃度為100 mg/L的儲備液,根據需要稀釋后使用。TiO2(納米級);流動相甲醇、冰醋酸(Sigma公司,HPLC級);H2SO4、NaOH溶液(分析純)調節pH;Na2SO4、NaCl、NaHCO3、Na2CO3、NaNO3溶液(分析純,摩爾濃度均為10 mmol/L)調節陰離子濃度。
1.3 儀器參數及分析方法
紫外燈管(功率為75 W,主波長為253.7 nm,強度為154 μW/cm2);降解反應在室溫下[(20±2)℃]進行;飛鴿牌(TGL-16C型)離心機(上海安亭科學儀器廠)。2,4,6-TCP的濃度測定儀器為島津LC-2010 AHT的高效液相色譜儀;檢測波長n=289 nm;色譜柱為Shim-pack VODS(250.0 mm×4.6 mm);流動相V(甲醇)∶V[水(含質量分數為1%的乙酸)]=80∶20;流動相流速為1.0 mL/min;柱溫T=40 ℃;分析時間t=10 min。
1.4 試驗方法
稱取一定量納米級TiO2于燒杯中,配制成20.0 g/L的懸濁液,使用磁力攪拌器及轉子連續攪拌,混合1 h以上,使其充分混合均勻。按照光催化劑(TiO2)所需用量,使用移液槍將配制好的TiO2懸濁液加入反應皿中,使其與2,4,6-TCP反應液避光混合均勻,30 min后置于紫外燈下進行反應。分別選取反應時間為5、10、15、20、30、40、50、60、75、90、120 min的水樣離心分離,將不同反應時間取出的水樣滴加過量亞硫酸鈉(10%)終止反應后,使用臺式高速離心機進行離心分離9 min,取上層清液[17-18]進行HPLC檢測。
2 結果與討論
2.1 UV/TiO2與2,4,6-TCP反應動力學分析
TiO2光催化主要反應的歷程如下:TiO2的能帶是不連續的,由低能的價帶[電子(e-)氧化還原電位為-0.5 eV]和高能的導帶[空穴(h+)氧化還原電位為2.7 eV]構成,兩者之間帶隙能為3.2 eV,以λ≤387.5 nm的光波照射TiO2表面,當光子能量≥TiO2的帶隙能時,處于價帶的e-被激發到導帶生成h+,h+與吸附于TiO2表面的OH-或H2O反應,生成羥基自由基(·OH),如式(1)~式(3)[13]。
2TiO2+hv→TiO2(e-)+TiO2(h+)
(1)
TiO2(h+)+OH-→TiO2+·OH
(2)
TiO2(h+)+H2O→TiO2+H++·OH
(3)
此外,還存在UV直接輻射水中的OH-,而在水溶液中激發生成·OH,如式(4)~式(5)。
H2O→H++OH-
(4)
OH-+hv→·OH
(5)
生成的·OH可以在催化劑表面及水體中使有機物礦化為CO2、H2O等小分子無機物,如式(6)。
2,4,6-TCP+·OH→降解產物+H2O
(6)
由于反應過程中生成的·OH在水中壽命極短,小于1 μs,無法進行直接定量計算。目前,常用的做法是采用擬一級動力學方程進行表征。因此,在以下各節各試驗影響參數的討論中,采用式(7)具體闡述TiO2投加量、2,4,6-TCP初始質量濃度、紫外光照強度、pH、陰離子對降解過程的影響作用。
-dC/dt=kOHC0COH
(7)
其中:C——2,4,6-TCP的摩爾濃度,mol/L;
t——反應時間,min;
kOH——·OH氧化2,4,6-TCP的速率常數,L/(mol·min);
C0——2,4,6-TCP的初始摩爾濃度,mol/L;
COH——·OH的摩爾濃度,mol/L。
對于均質反應器,如式(8)。
(8)
本試驗光照強度為常量,使用磁力攪拌器可以將催化劑TiO2快速均勻地分布于水中,可以認為此反應裝置為均質反應器,·OH在水體表面均勻存在。UV光照強度及TiO2濃度穩定,所以·OH也一直穩定存在于反應體系中。因此,式(7)中COH為一常數,可認為UV/TiO2光催化降解2,4,6-TCP的反應符合一級動力學,其中k為準一級動力學反應常數,式(8)可以簡化為式(9)。
(9)
2.2 反應條件對光催化降解2,4,6-TCP的影響
2.2.1 TiO2投加量的影響
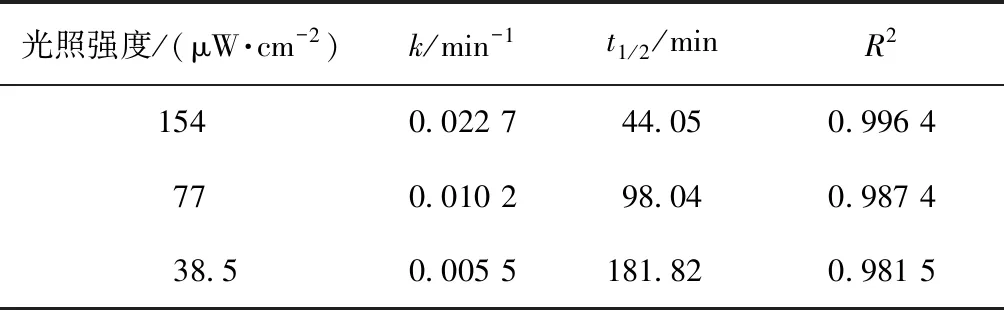
取200 mL初始質量濃度為5 mg/L的2,4,6-TCP溶液,在pH值=5.02的條件下反應90 min,考察TiO2投加量對光催化降解2,4,6-TCP的降解率影響,結果如圖2所示。將試驗數據進行積分處理,擬合In(C/Co)與t的變換規律,查看不同TiO2投加量對光催化降解2,4,6-TCP的反應動力學擬合,結果如圖3所示。其k(速率常數)、t1/2(半衰期)和R2(相關系數)如表1所示。
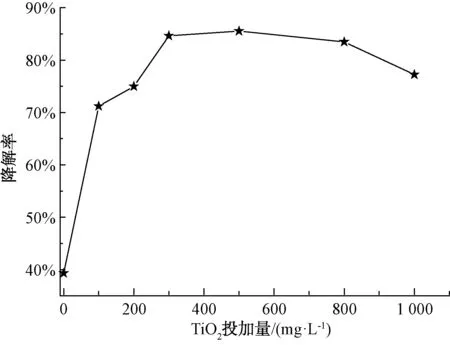
圖2 TiO2投加量對光催化降解2,4,6-TCP的影響Fig.2 Effect of TiO2 Dosage on Photocatalytic Degradation of 2,4,6-TCP
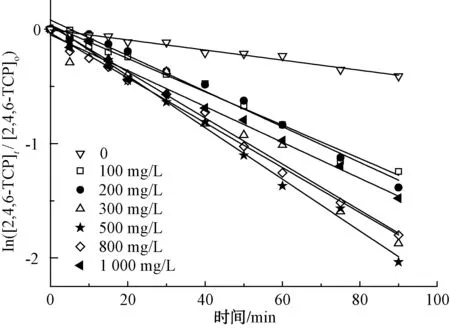
圖3 TiO2投加量對光催化降解2,4,6-TCP的影響Fig.3 Effect of Dosages of TiO2 on Photocatalytic Degradation of 2,4,6-TCP
由圖2可知,2,4,6-TCP的降解在300~800 mg/L時催化降解效果較好,且當TiO2投加量為500 mg/L時,90 min后2,4,6-TCP的降解率最高,為85.5%。同時,由圖3和表1可知,當TiO2投加量為500 mg/L時,2,4,6-TCP的光催化降解速率較其他投加量時都較快。這是由于當催化劑用量較少時,光源產生的光子不能在催化劑表面被完全轉化為化學能,光子能量利用率較低,適量增加催化劑用量就可以產生更多·OH,提高光催化降解的效率;但是當催化劑用量超過一定程度時,過多的粒子會使光散射,減弱有效光強度,從而降低光的吸收[17-18]。本次試驗最佳TiO2投加量為500 mg/L。
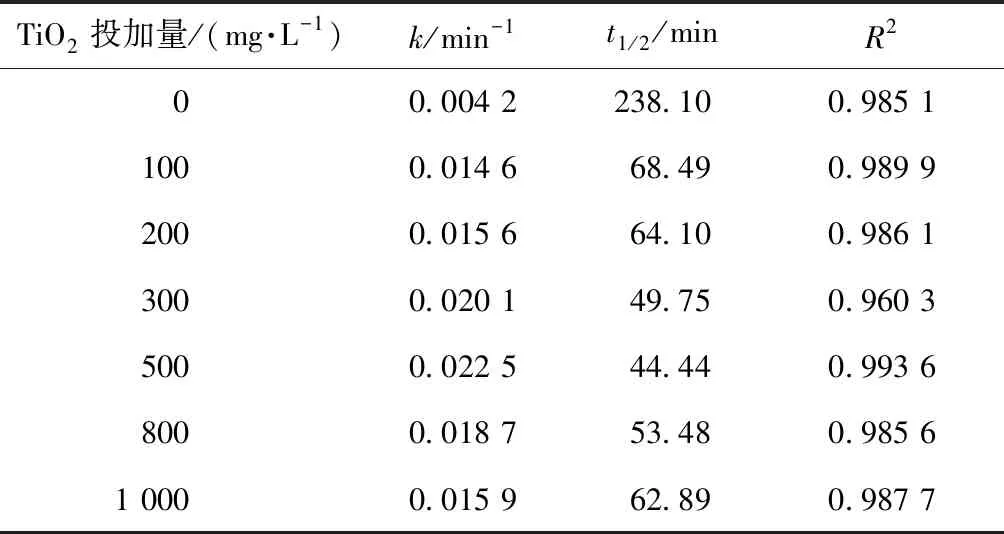
表1 不同TiO2投加量下光催化降解2,4,6-TCP的準一級動力學模型的擬合參數Tab.1 Fitting Parameters of Kinetics Models of Quasi-First-Order Dynamic Model on Photocatalytic Degradation of 2,4,6-TCP under Different Dosages of TiO2
2.2.2 2,4,6-TCP初始質量濃度的影響
固定TiO2的投加量為500 mg/L,取200 mL不同初始質量濃度的2,4,6-TCP溶液,在pH值=5.0的條件下反應120 min,考察不同2,4,6-TCP初始質量濃度對光催化降解的影響,將試驗數據擬合In(C/Co)與t的變換規律,查看不同2,4,6-TCP初始質量濃度對光催化降解的反應動力學影響,結果如圖4所示。其k、t1/2和R2如表2所示。
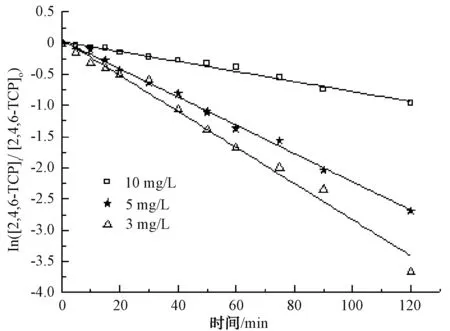
圖4 初始質量濃度對光催化降解2,4,6-TCP的影響Fig.4 Effect of Initial Concerntrations on Photocatalytic Degradation of 2,4,6-TCP
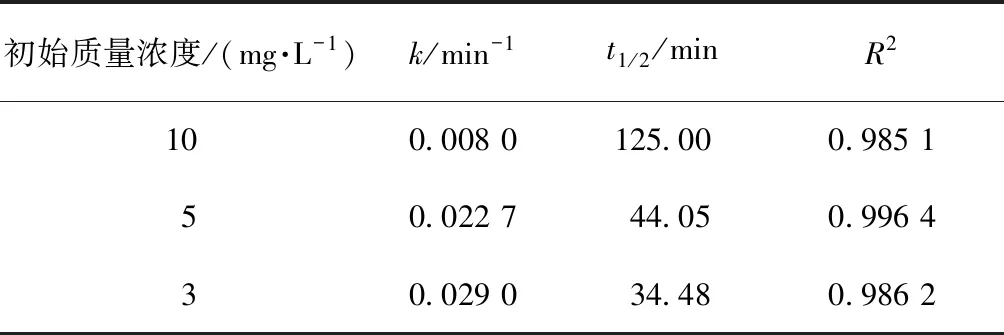
表2 不同初始質量濃度下光催化降解2,4,6-TCP的準一級動力學模型的擬合參數Tab.2 Fitting Parameters of Kinetics Models of Quasi-First-Order Dynamic Model on Photocatalytic Degradation of 2,4,6-TCP under Different Initial Concentrations
結果表明,隨著2,4,6-TCP初始質量濃度的增加,其降解速率明顯降低。這是因為在紫外光強以及TiO2量不變的情況下,單位時間內紫外光在TiO2表面所激發出的·OH不變,反應物的初始質量濃度增加,一定時間內單位反應物所獲得·OH的概率降低,一定時間內反應物的去除率將明顯降低。當2,4,6-TCP的初始質量濃度由3 mg/L增加到10 mg/L時,UV/TiO2對2,4,6-TCP的降解速率也由0.029 0 min-1降低到0.008 0 min-1,降低了將近4倍。
2.2.3 不同pH條件對2,4,6-TCP降解的影響
固定TiO2的投加量為500 mg/L,取200 mL初始質量濃度為5 mg/L的2,4,6-TCP溶液,調節反應液的pH后放置紫外線下反應120 min。本試驗各個工況的pH實測值分別為2.62、5.05、6.82、8.96、10.80,考察不同pH對光催化降解的影響,將試驗數據擬合In(C/Co)與t的變換規律,查看不同pH條件下對光催化降解的反應動力學影響,結果如圖5所示。其k、t1/2和R2如表3所示。
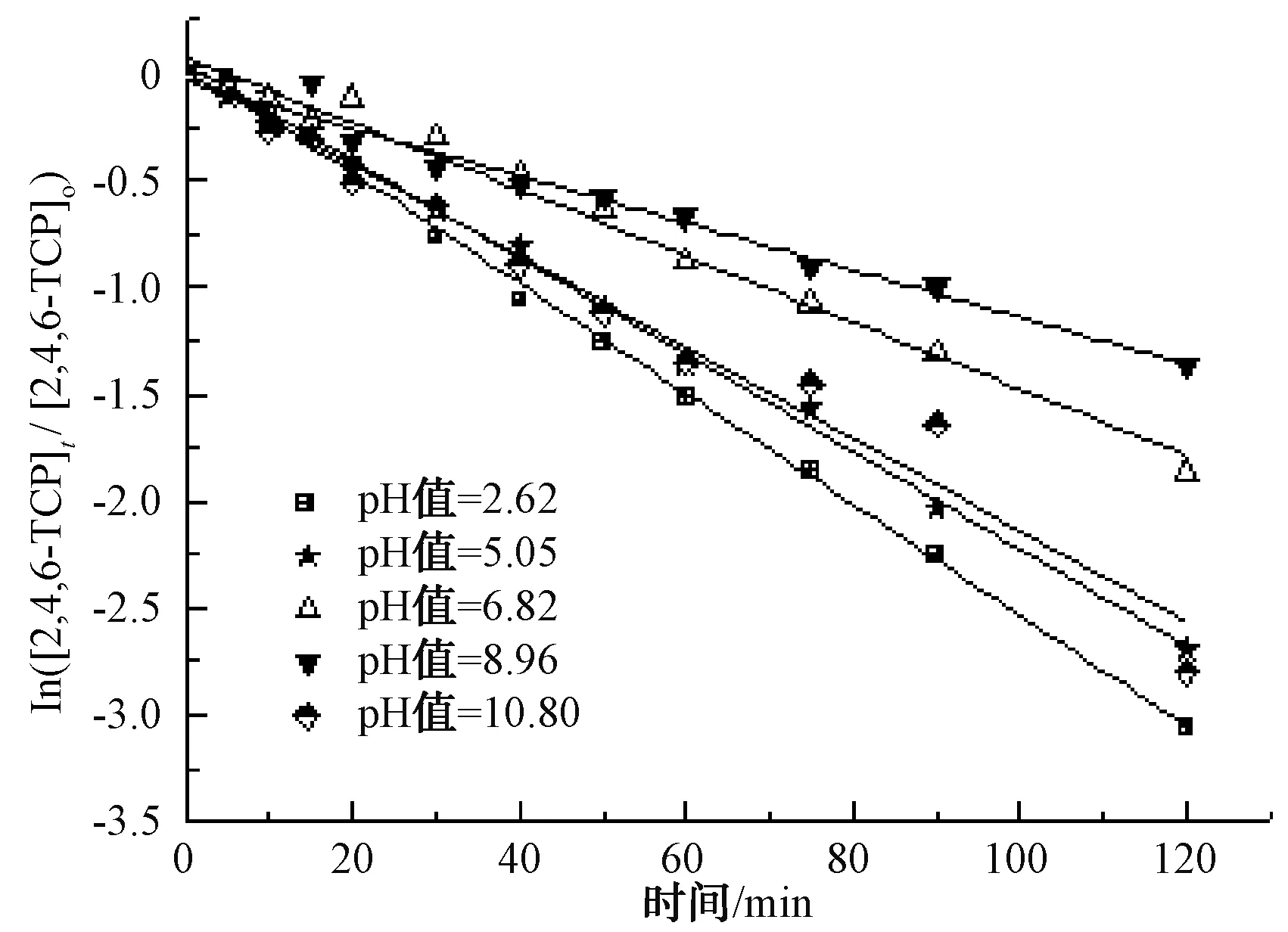
圖5 pH對光催化降解2,4,6-TCP的影響Fig.5 Effect of pH Value on Photocatalytic Degradation of 2,4,6-TCP

表3 不同pH條件下光催化降解2,4,6-TCP的準一級動力學模型的擬合參數Tab.3 Fitting Parameters of Kinetics Models of Quasi-First-Order Dynamic Model on Photocatalytic Degradation of 2,4,6-TCP under Different pH Value
根據Tajik等[19]的研究,光催化活性受到pH的影響,是因為光催化劑的表面電荷或者目標污染物的表面電荷可以發生變化,從而改變兩者之間的吸附力。2,4,6-TCP是一種弱酸,電離平衡常數為6.1[20-21],當溶液pH值≤6.1時,溶液中的2,4,6-TCP主要以分子形式存在,當溶液pH值>6.1時,溶液中的2,4,6-TCP主要以離子態存在,且pH越高,其離子態的含量越高。另外,根據Muneer[22]等的研究,催化劑TiO2作為兩性氧化物,等電點≈6.6,因此,當pH值≤6.6時,催化劑TiO2表面帶正電荷,反之當pH值>6.6時,催化劑TiO2表面帶負電荷。
根據UV/TiO2處理2,4,6-TCP的基本原理分析,產生·OH主要有兩種途徑:①通過紫外激發吸附于TiO2表面的OH-或H2O生成;②通過紫外直接激發存在水溶液中的OH-生成。UV/TiO2在酸性(pH值≤6.82)條件下,pH越低,2,4,6-TCP的降解速率越高,且pH的變化對降解速率的影響程度很大。pH值由2.62升至6.82,2,4,6-TCP的降解速率k由0.025 9降到0.015 5,pH值=2.62時的降解速率是pH值=6.82的近2倍。這可能是在此pH下TiO2的表面帶正電荷,更易吸收分子態和負離子態的2,4,6-TCP,因此,途徑①是主要的降解方式。表現為在酸性及中性條件下,pH越低,吸附于TiO2表面的分子態2,4,6-TCP越多,從而更有利于TiO2表面產生的·OH與其反應。
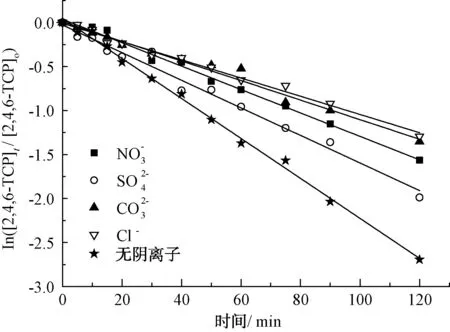
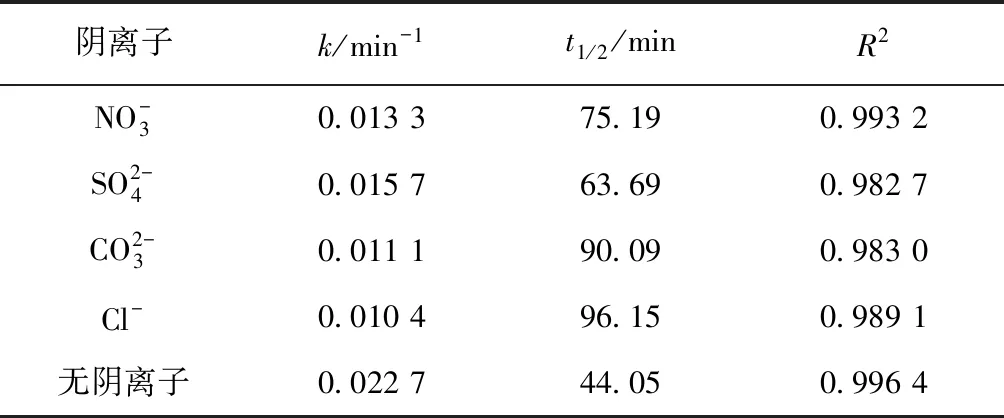
在中性及弱堿性條件下,即pH值為6.82~8.92時,2,4,6-TCP的降解速率k由0.015 5降至0.010 7,pH升高不利于降解反應的進行;而在強堿性條件下,即pH值為8.96~10.80時,降解速率k由0.010 7升至0.021 4,pH值=10.80時的降解速率是pH值=8.96的2倍,pH的升高有利于降解反應的進行。根據馬艷等[21]的研究,單獨UV方式處理2,4,6-TCP時,溶液的pH越高,越易被降解。這是由于在中性或堿性(pH值>6.82)條件下,隨著pH的升高,催化劑TiO2表面帶負電荷的粒子逐漸增多,且溶液中的2,4,6-TCP逐漸開始以負離子態存在,被吸附于TiO2表面被去除的可能性越低,表現為途徑①作為主方式的逐漸降低,途徑②開始逐漸增強。在中性及弱堿性(6.82 2.2.4 不同光強條件對2,4,6-TCP降解的影響 固定TiO2的投加量為500 mg/L,取200 mL初始質量濃度為5 mg/L的2,4,6-TCP溶液,在pH值=5.0但光強不同的條件下反應,120 min后考察不同的光強條件對2,4,6-TCP降解的影響,將試驗數據擬合In(C/Co)與t的變換規律,查看不同光強對光催化降解的反應動力學影響,結果如圖6所示。其k、t1/2和R2如表4所示。 圖6 紫外光照強度對光催化降解2,4,6-TCP的影響Fig.6 Effect of UV Intensity on Photocatalytic Degradation of 2,4,6-TCP 結果表明,隨著紫外光照強度的降低,2,4,6-TCP的降解速率明顯降低。這是因為紫外光是UV/TiO2產生·OH的主要來源,紫外光照強度的降低,必然引起·OH產量的降低,單位反應物所獲得·OH的概率降低,反應物的去除率降低。當紫外光照強度由154 μW/cm2降低至38.5 μW/cm2時,UV/TiO2對2,4,6-TCP的降解速率也由0.022 7 min-1降低至0.005 5 min-1。這是由于在UV/TiO2體系中,紫外光照強度是激發體系降解活性的重要參數。增加光照強度可以大大提高單位時間、單位反應體積內的活化物質分子數,從而提高反應速率。馬艷等[21]采用UV輻照降解水中的有機物,也得到了和本試驗類似的結論。 表4 不同紫外光照強度下光催化降解2,4,6-TCP的準一級動力學模型的擬合參數Tab.4 Fitting Parameters of Kinetics Models of Quasi-First-Order Dynamic Model on Photocatalytic Degradation of 2,4,6-TCP under Different UV Intensity 2.2.5 不同陰離子對2,4,6-TCP降解的影響 圖7 陰離子對光催化降解2,4,6-TCP的影響 摩爾濃度均為5 mmol/L)Fig.7 Effect of Anions on Photocatalytic Degradation of 2,4,6-TCP (Concentrations of Cl-, and are all 5 mmol/L) 表5 不同陰離子條件下光催化臭氧降解2,4,6-TCP的準一級動力學模型的擬合參數Tab.5 Fitting Parameters of Kinetics Models of Quasi-First-Order Dynamic Model on Phtocatalytic Degradation of 2,4,6-TCP under Different Anions (10) Cl-對反應的影響較復雜[21,25],在紫外的照射下會產生一定量的·OH,產生量與Cl-濃度有關,對反應具有促進作用;但是同時也會消耗一部分·OH,對反應起抑制作用,反應如式(11)~式(12)。 (11) (12) (1)采用UV/TiO2高級氧化技術對2,4,6-TCP進行降解試驗,結果表明,UV/TiO2高級氧化工藝能有效降解2,4,6-TCP,且符合準一級動力學模型,相關系數均在0.96以上。 (2)催化劑(TiO2)投加量對UV/TiO2高級氧化降解有機物的效果影響很大。當TiO2投加量為0~1 000 mg/L時,反應90 min后通過2,4,6-TCP去除率和降解速率可知,TiO2的最佳投加量為500 mg/L。
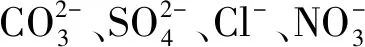
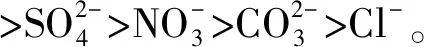
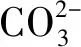



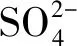
3 結論