青蘿卜游離小孢子培養體系優化
張勝雪 范偉強 王超楠 張紅 黃志銀 李梅 劉曉暉 尹婧 張斌







摘? ? 要:以12份不同基因型青蘿卜品種為供試材料,采用游離小孢子培養技術,研究基因型、培養基類型、激素濃度配比、4 ℃冷處理時間及32.5 ℃熱激處理時間對青蘿卜小孢子胚誘導的影響,為青蘿卜高頻胚誘導提供參考依據,從而完善青蘿卜游離小孢子培養技術體系。結果顯示,在相同培養條件下,只有SX1、SX8與SX11三份材料獲得了胚狀體,其余材料未獲得胚狀體,且不同供試材料間小孢子胚誘導率差異顯著,表明基因型是決定青蘿卜小孢子胚誘導成功的關鍵因素之一;利用1/2NLN-13型培養基配套指定激素配比(0.2 mg·L-1? 6-BA+1 mg·L-1? NAA)培養時,材料SX1、SX8與SX11小孢子出胚率最高,基本確定了青蘿卜小孢子培養的最適培養基類型及最佳激素濃度組合;此外,4 ℃冷處理1 d和32.5 ℃熱激處理2 d,材料SX1與SX11小孢子出胚率最高,確定了小孢子胚誘導最佳冷處理和熱激處理條件。
關鍵詞:青蘿卜;小孢子培養;胚狀體;優化
中圖分類號:S631.1 文獻標志碼:A 文章編號:1673-2871(2022)02-034-05
Optimization of isolated microspore culture system in green radish
ZHANG Shengxue1, FAN Weiqiang2, WANG Chaonan3, ZHANG Hong2, HUANG Zhiyin2, LI Mei3, LIU Xiaohui3, YIN Jing1, ZHANG Bin3
(1. College of Life Sciences, Tianjin Normal University, Tianjin 300387, China; 2. State Key Laboratory of Vegetable Germplasm Innovation/Tianjin Key Laboratory of Vegetable Genetics and Breeding Enterprises/Tianjin Kerun Vegetable Research Institute, Tianjin 300381, China; 3. Vegetable Research Institute, Tianjin Academy of Agricultural Sciences, Tianjin 300381, China)
Abstract: Twelve genotypes of Green Radish were tested for isolating microspore culture technology. The effects of genotype, medium type, growth regulator, 4 ℃ cold treatment and 32.5 ℃ heat shock treatment on the embryo induction from microspores were studied to improve isolated microspore culture technology system for green radish. The results showed that under the same culture conditions, only three materials SX1, SX8 and SX11 produced embryos, and the embryos induction rate from microspores was different among materials tested. Genotype is one of the key factors determining the success of embryo induction from green radish microspores; When 1/2 NLN-13 medium supplemented with 0.2 mg·L-1 6-BA+1 mg·L-1 NAA genotypes SX1, SX8 and SX11 produced highest number of embryos. In addition, of 4 ℃ cold treatment for 1 d and 32.5 ℃ heat shock treatment for 2 d SX1 and SX11 had the highest embryo rate from microspores. Our research generated an optimized protocol of generating embryos from isolated microspores of green radish.
Key words: Green radish; Microspore culture; Embryoid; Optimization
蘿卜(Raphanus sativus L.)為十字花科蘿卜屬二年或一生作物,在我國蔬菜作物中占據重要地位。2017年,我國蘿卜播種面積達到130萬hm2,占蔬菜總播種面積的5.6%,總產量達4.501×1010 kg,位居十字花科蔬菜種植面積的第二位[1]。青蘿卜為蘿卜中的綠皮蘿卜類型,其皮薄肉細、色澤翠綠、口感脆嫩,深受大眾喜愛。
蘿卜的雜種優勢非常明顯,市面蘿卜品種多以雜交種為主[2]。利用常規育種手段選育純合、穩定的優質親本需要進行5~7年的多代自交,費時費力,而且材料的多代自交也可能導致優良性狀的衰退。游離小孢子培養是快速獲得純合材料的有效手段之一[3-4],利用小孢子培養可以快速獲得單倍體,加倍后就可以獲得純合且遺傳穩定的雙單倍體(DH)植株,從而縮短育種年限,提高育種效率[5]。自從1982年Lichter[6]首次通過甘藍型油菜(Brassica napus)培育出胚狀體并建立再生植株體系以來,游離小孢子培養技術已廣泛應用于白菜、甘藍、菜心、油菜等多種十字花科蔬菜作物單倍體育種研究中[7-9]。在十字花科作物中,蘿卜是最難成功培養出小孢子的作物之一[10]。Takahata等[11]對僅獲得的58個蘿卜胚狀體進行再生植株培養,僅成活6株;張麗[12]對20份基因型不同的蘿卜品種進行游離小孢子培養,僅1份品種形成胚狀體。近年來,多位學者在蘿卜小孢子培養方面做了大量的工作[13-14],但出胚率和植株再生率仍舊很低。
目前,還未有針對青蘿卜小孢子培養的系統研究報道,筆者以12份基因型不同的青蘿卜品種為供試材料,對青蘿卜小孢子培養過程中的培養基類型、激素濃度配比、4 ℃冷處理時間及32.5 ℃熱激時間進行研究,為青蘿卜高頻胚誘導提供參考依據,以期進一步完善青蘿卜游離小孢子培養技術體系。
1 材料與方法
1.1 材料
筆者在本研究中選取12份市場主流并具備優良性狀的青蘿卜品種(材料)作為試材,其具體品種編號、名稱與來源如下(表1)。供試材料于2020年12月上旬播種于天津科潤農業科技股份有限公司蔬菜研究所武清試驗基地,常規田間管理,2021年3月底至6月初取花蕾進行游離小孢子培養。
1.2 方法
1.2.1? ? 游離小孢子培養? ? 小孢子培養方法參考張麗等[13]的方法,進行改良。摘取無裂蕾的花序,4 ℃冷處理0、1、2、3 d;75%酒精處理35 s、10%次氯酸鈉處理12 min、無菌水處理4 min 3次;B5培養基(含13%蔗糖);32.5℃熱激處理0、1、2、3 d;轉綠的胚狀體接種至B5固體培養基內培養(16 h光/8 h暗、溫度25 ℃、光照度2000 lx)。
1.2.2? ? 單因素試驗設計? ? 以基因型、激素類型及濃度配比、4℃冷處理時間和32.5℃熱激處理時間5個因素,利用單因素控制變量法設計單因素試驗,試驗設計情況如表2。
1.3 數據處理及分析
利用Excel 2019軟件對試驗數據進行統計分析,利用SPSS 22.0軟件進行單因素ANOVA方差分析,利用鄧肯氏新復極差法進行差異性顯著分析。
2 結果與分析
2.1 基因型對青蘿卜小孢子胚誘導的影響
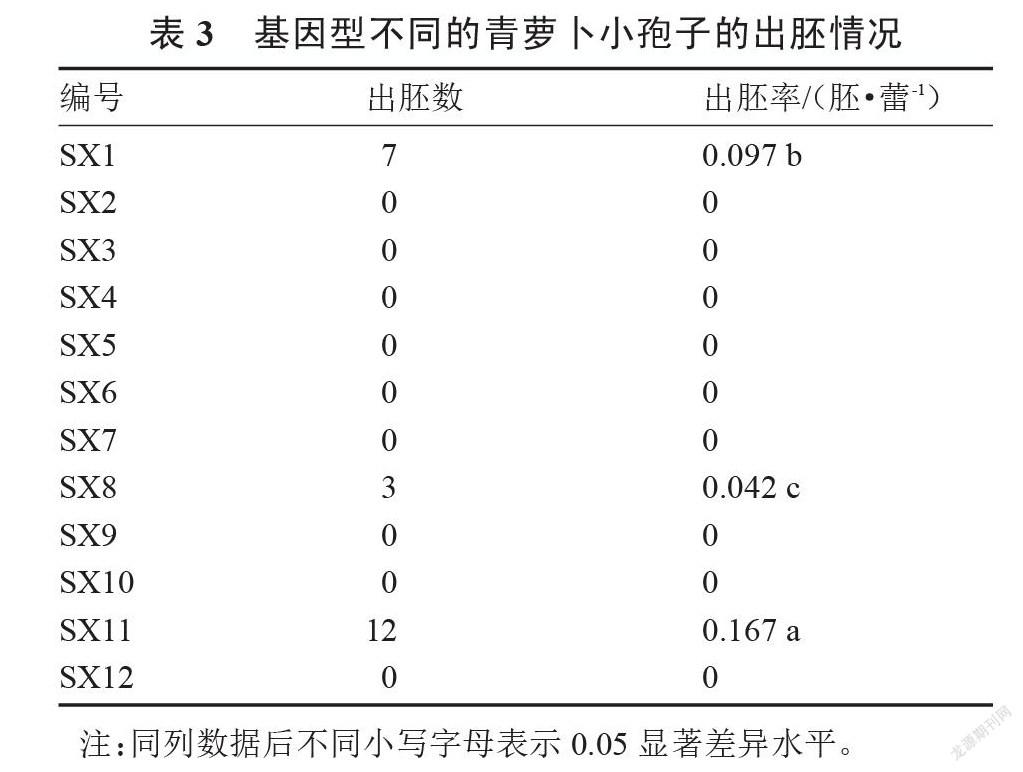
選取的青蘿卜品種代表12種不同基因型,以1/2 NLN-13培養基培養,供試材料出胚情況如表3。
由表3可以看出,用相同的培養條件對12份不同基因型的青蘿卜小孢子進行培養,其中只有SX1、SX8與SX11三份材料獲得了胚狀體,SX2、SX3、SX4、SX5、SX6、SX7、SX9、SX10與SX12未獲得胚狀體,其中SX11獲得胚狀體最多,出胚率最高,可達0.167胚·蕾-1;而SX8獲得胚狀體最少,出胚率僅為0.042胚·蕾-1。因此可見,不同基因型的青蘿卜材料間小孢子胚誘導率差異較大,且在完全相同的培養條件下,不同材料的小孢子胚誘導發生能力受基因型影響較大。
2.2 培養基類型及激素濃度配比對青蘿卜小孢子胚誘導的影響
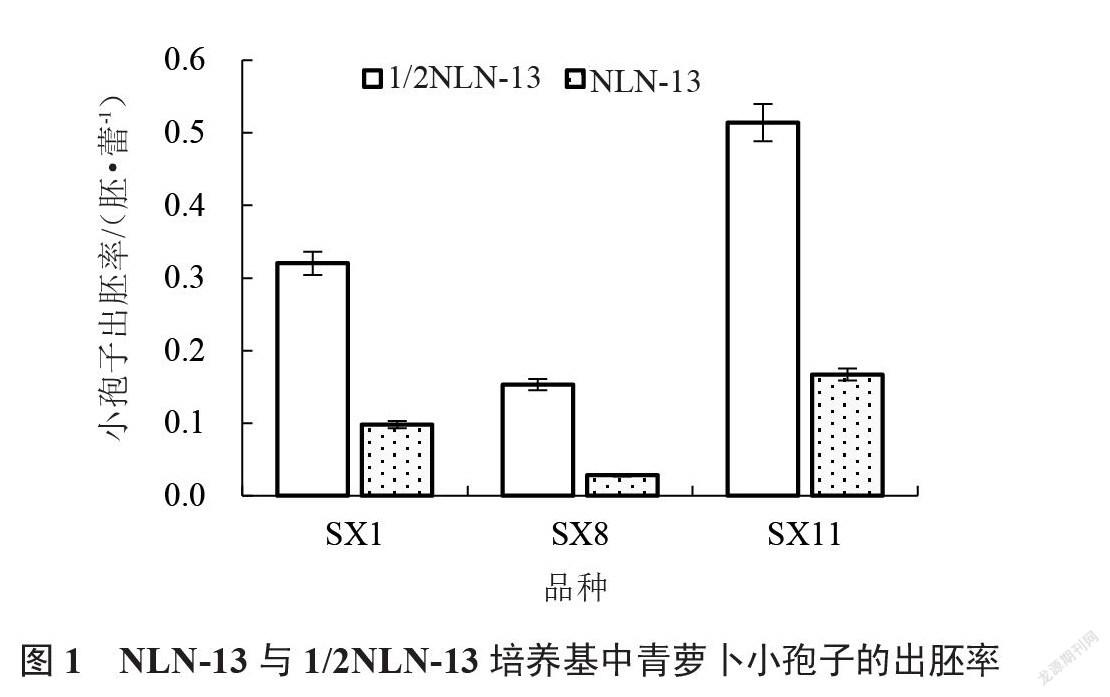
由圖1可以看出,激素濃度配比相同時,以1/2 NLN-13培養基培養時,SX1、SX8與SX11三份材料小孢子的出胚率較高,說明1/2 NLN-13培養基為供試青蘿卜小孢子培養的最適培養基類型。由表4~5可以看出,與對照組1相比,加入適量的6-BA和NAA有利于青蘿卜小孢子胚誘導的發生,且6-BA和NAA的濃度不同對小孢子胚誘導發生能力的影響不同。其中配比7條件下SX1、SX8與SX11三份材料小孢子的出胚率最高,在1/2 NLN-13培養基中分別為0.181、0.083、0.222胚·蕾-1;在NLN-13培養基中分別為0.056、0.014、0.069胚·蕾-1。因此說明,0.2 mg·L-1 6-BA+1.0 mg·L-1 NAA為供試青蘿卜小孢子培養的最適激素質量濃度組合。
2.3 冷處理時間對青蘿卜小孢子胚誘導的影響
由圖2可以看出,4 ℃冷處理后材料SX1與SX11小孢子出胚率均有明顯的提高,且冷處理1 d時,兩份青蘿卜材料的小孢子出胚率最高,分別為0.306胚.蕾-1和0.347胚.蕾-1;隨著冷處理時間的增加,材料SX1與SX11小孢子出胚率逐漸下降,尤其冷處理3 d時,小孢子出胚率已經接近0 d。因此,4 ℃冷處理對供試青蘿卜小孢子胚誘導的發生有顯著影響,且不同冷處理間小孢子出胚率差異顯著,其中最佳冷處理時間為1 d。
2.4 熱激處理時間對青蘿卜小孢子胚誘導的影響
由圖3可以看出,32.5 ℃熱激處理后,材料SX1與SX11小孢子出胚率均有明顯的提高,且熱激處理2 d時,兩份青蘿卜材料的小孢子出胚率最高,分別為0.278胚·蕾-1和0.347胚·蕾-1;熱激處理3 d時,小孢子出胚率明顯下降,說明熱激時間延長不利于小孢子出胚。因此可見,32.5 ℃熱激處理對供試青蘿卜小孢子胚誘導的發生有顯著影響,且不同熱激處理間小孢子出胚率差異顯著,其中最佳熱激處理時間為2 d。
2.5 青蘿卜小孢子胚狀體培養及植株再生的過程
小孢子經過離體培養發育成胚狀體(圖4-A)一般需要15~26 d。胚狀體接種到分化培養基(B5固體培養基+2%蔗糖+0.8%瓊脂+0.2 mg·L-1 6-BA)上,置于光照培養室(16 h光/8 h暗、溫度25 ℃、光照度2000 lx)培養。其中子葉胚(圖4-B)1周后逐漸轉綠(圖4-C),經過3~5周繼代培養后分化成苗(圖4-D);球形胚接種后不會轉綠,逐漸發生褐化死亡(圖4-E)。獲得的苗接種至生根培養基(MS固體培養基+2 %蔗糖+0.1 g·L-1活性炭+0.8 %瓊脂+0.2 mg·L-1 NAA)培養1~2周后逐漸生根(圖4-F)。
3 討論與結論
蘿卜成功獲得小孢子培養非常困難,基因型是制約其成胚的關鍵。筆者在本試驗中以相同的培養條件對12份基因型不同的青蘿卜小孢子進行培養,只有3份成功誘導出胚,且不同基因型的青蘿卜材料間小孢子胚誘導率差異較大,表明基因型是決定青蘿卜品種小孢子胚誘導成功的關鍵因素之一,這一結果與王春麗等[15]研究結果相一致,在白菜[16]、菜心[17]等十字花科作物中也有此結論。張鳳蘭等[18]研究表明,在甘藍型油菜小孢子培養中,高胚發生能力受顯性核基因控制,與胞質無關。因此可以利用雜交手段,將胚發生能力高的品種與胚發生能力低的品種進行雜交,擴大后代基因型范圍,提高胚發生能力低的品種的胚誘導率[19]。
NLN和1/2NLN培養基是十字花科作物小孢子培養常用的培養基類型。陳文輝等[20]研究了培養基類型對蘿卜小孢子出胚率的影響,結果發現僅1/2 NLN培養基可以誘導蘿卜小孢子產生胚狀體;趙艷玲[21]研究發現NLN與1/2 NLN培養基均可誘導蘿卜小孢子產生胚狀體。本試驗中,在培養基內物質含量完全相同下,1/2 NLN培養基培養時,SX1、SX8與SX11小孢子出胚率較高,說明1/2 NLN培養基更有利于提高蘿卜胚狀體的誘導率,這個結果與王超楠等[22]研究結果相一致。
目前,激素對不同作物小孢子胚誘導的影響尚未得到一致結果。王康[23]認為培養基內加入0.05 mg·L-1 6-BA對蘿卜小孢子胚誘導有促進作用;李丹[2]對蘿卜小孢子胚誘導體系進行優化,培養基內最佳激素組合是0.1 mg·L-1 6-BA+1.0 mg·L-1 NAA;施柳等[24]認為培養基內加入0.3 mg·L-1 6-BA有利于白菜小孢子胚誘導的發生。本試驗中,在培養基內添加0.2 mg·L-1 6-BA和1.0 mg·L-1 NAA可以顯著提高SX1、SX8與SX11小孢子的出胚率。
冷處理和熱激處理可以改變小孢子的分裂方式和發育途徑,使第2次有絲分裂進行對稱分裂,從而促進小孢子由配子體途徑向孢子體途徑發展,利于產生胚狀體[25]。付傳翠等[26]認為4 ℃冷處理3 d,蘿卜小孢子出胚率最高,延長冷處理時間,出胚率逐漸下降;唐兵等[27]認為4 ℃低溫預處理l d、33 ℃高溫熱激2 d有利于白菜小孢子胚的形成。本試驗結果表明,4 ℃冷處理1 d和32.5 ℃熱激處理2 d可以提高青蘿卜小孢子胚誘導的發生能力,但其出胚率與材料基因型及處理時間密切相關,這與李丹[2]的研究結果一致。
綜上所述,筆者通過對青蘿卜游離小孢子培養體系的優化,發現除了基因型是決定青蘿卜小孢子培養的關鍵因素外,培養基類型、培養基成分以及溫度脅迫處理等同樣是影響青蘿卜小孢子培養的重要因素,本研究的結果可以進一步為青蘿卜小孢子培養提供可靠的參考依據和試驗基礎。
參考文獻
[1] 崔志超,楊雅婷,劉先才,等.我國蘿卜機械化生產現狀及發展建議[J].中國蔬菜,2020(8):1-8.
[2] 陳寶剛,魯建斌,梁玉芹.蘿卜育種研究進展[J].河北農業科學,2012,16(1):65-68.
[3] 李丹.蘿卜游離小孢子培養技術研究[D].北京:中國農業科學院,2008.
[4] 李曉梅,冉茂林,楊峰.蘿卜游離小孢子成胚誘導影響因素研究進展[J].長江蔬菜,2016(14):41-44.
[5] 龐強強,周曼,蔡興來,等.菜心小孢子胚再生體系優化及植株倍性鑒定[J].分子植物育種,2021,19(14):4745-4751.
[6] LICHER R.Efficient yield of embryoids by culture of isolated microspores of different Brassicaceae species[J].Plant Breeding, 1989,103:119-123.
[7] CORRAL-MARTíNEZ P,CAMACHO-FERNáNDEZ C,SEGUí-SIMARRO J M.Isolated microspore culture in Brassica napus[M]. New York:Humana,Methods in Molecular Biology ,2020:269-282.
[8] DONG Y Q,GAO Y H,ZHAO T,et al.Influencing factors and physiochemical changes of embryogenesis through in vitro isolated microspore culture in Brassica species[J].Biologia,2021,76(9):2629-2654.
[9] DARIA S,DMITRY K,ELENA D,et al.Effects of genotype and culture conditions on microspore embryogenesis and plant regeneration in Brassica rapa ssp.rapa L.[J].Plants,2020,9(2):278.
[10] 張麗,王慶彪,鄭鵬婧,等.蘿卜小孢子培養再生植株及其性狀表現[J].西北農業學報,2016,25(9):1386-1391.
[11] TAKAHATA Y,KOMATSU H,KAIZUMA N.Microspore culture of radish (Raphanus sativus L.): influence of genotype and culture conditions on embryogenesis[J].Plant Cell Reports,1996,16(3/4):163-166.
[12] 張麗.蘿卜游離小孢子培養技術初探[J].園藝學報,2004,31(5):676-678.
[13] 張麗,王慶彪,王艷萍.利用離體小孢子培養技術培育心里美蘿卜新品系[J].中國蔬菜,2020(8):53-56.
[14] KOZAR E,DOMBLIDES E.Protocol of european radish(Raphanus sativus L.)microspore culture for doubled haploid plant production[M]// SEGUI-SIMARRO J M. Doubled haploid technology. New York:Humana Press,2021:217-232.
[15] 王春麗,姚延興,彭玲.蘿卜游離小孢子培養及胚再生植株研究[J].安徽農業科學,2013,41(27):10919-10922.
[16] 陳麗瀟,王躍華,劉鑫,等.抗根腫病大白菜小孢子培養及分子鑒定[J].江蘇農業科學,2019,47(10):141-143.
[17] 趙艷艷,牛劉靜,原玉香,等.菜心小孢子培養體系優化[J].中國瓜菜,2020,33(7):34-38.
[18] 張鳳蘭,高田義人.甘藍型油菜小孢子培養胚發生能力的遺傳分析[J].華北農學報,2001,6(1):27-32.
[19] 魏云曉,李菲,張淑江,等.菜薹(菜心)-芥藍雜交親和性分析及后代性狀表現[J].中國蔬菜,2017(11):21-27.
[20] 陳文輝,方淑桂,曾小玲,等.蘿卜游離小孢子培養研究初報[J].福建農業學報,2006,21(4):338-341.
[21] 趙艷玲.蘿卜小孢子培養與核型分析[D].南京:南京農業大學,2008.
[22] 王超楠,馮輝,姜鳳英,等.小白菜小孢子胚狀體誘導影響因素研究[J].華北農學報,2007,22(S1):204-206.
[23] 王康.蘿卜游離小孢子培養與同源四倍體創制研究[D].南京:南京農業大學,2011.
[24] 施柳,王雅瓊,李云龍,等.不同基因型大白菜小孢子胚狀體誘導及植株再生[J].北方園藝,2014(6):101-104.
[25] ZORINIANTS S,TASHPULATOV A S,HEBERLE-BORS E,et al.The role of stress in the induction of haploid microspore embryogenesis[M]//PALMER C E,KELLER W A,KASHA K J, eds.Biotechnology in agriculture and foresry 56 in haploids in crop improvement Ⅱ. Springer, 2005:35-52.
[26] 付傳翠,張麗,宮國義,等.不同預處理方式對蘿卜小孢子活力的影響 [J].華北農學報,2006,21(6):45-48.
[27] 唐兵,陶蓮,盧松,等.白菜游離小孢子培養高頻胚誘導技術體系優化[J].熱帶作物學報,2017,38(10):1913-1920.

