遏藍菜硒蛋白的純化、結構表征及抗氧化活性研究
向安妮,許 爽,鞠紅梅,趙詩宇,岳田利,2,袁亞宏
(1.西北農林科技大學 食品科學與工程學院,陜西楊凌 712100;2.西北大學 食品科學與工程學院,西安 710069)
硒是維持人體健康必需的微量營養素,在自然界中以無機硒和有機硒兩種形態存在。無機硒主要包括硒化物、硒酸鹽和亞硒酸鹽,有機硒主要包括硒多糖、硒代氨基酸、硒多肽和硒蛋白等[1]。硒的功能與其賦存形態相關,有機硒比無機硒能更好地被人體吸收且毒性更低[2]。硒蛋白被認為是硒生理活性發揮的主要存在形式[3],具有抗氧化、提高免疫力和抗腫瘤等多種功效[4]。其中,硒蛋白的抗氧化功效被廣泛研究,已有關于茶葉硒蛋白[5]、平菇硒蛋白[6]和大米硒蛋白[7]等抗氧化活性的報道。在自然界中,無機硒可通過植物轉化為安全性好和生物利用度高的有機硒,因此,研究植物中的硒蛋白具有重要意義。
從植物中提取硒蛋白的常見技術包括浸提、酶水解和超聲提取等。酶法提取蛋白反應條件溫和,能夠避免酸堿提取蛋白帶來的負面影響,且能更多地保留蛋白質的營養價值[8];超聲波則能加速提取的進程[9]。提取的蛋白常含許多小分子雜質,為了使蛋白在分析應用中具有較高的純度,有必要使用色譜技術對蛋白進行分離純化。常用的色譜技術為陰離子交換色譜法。樣品中的雜質在流經交換柱時被吸附,所需成分被洗脫下來從而達到純化的目的。DEAE-Sepharose FF是一種將瓊脂糖凝膠與二乙胺基乙基鍵合形成的一種弱陰離子交換介質,因其流動性優異,被廣泛用于蛋白的分離[10-11]。光譜技術包括熒光光譜、核磁共振光譜(NMR)、圓二色譜、紅外光譜(FT-IR)和紫外可見光譜(UV-vis)等,通常用來表征蛋白結構。它們可以深入解析蛋白質的三維結構,探索蛋白質分子之間形成的互補結構,以及蛋白與其他物質結合的構象變化[12]。此外,透射電子顯微鏡 (TEM)、掃描電子顯微鏡(SEM)、原子力顯微鏡 (AFM)和超分辨率顯微鏡 (SRM)等常被用來探測蛋白的微觀形貌[13]。
遏藍菜(ThlaspiarvenseL.)又名菥蓂、敗醬草等,在中國南方大部分地區多見,常生長于路旁、山坡和田邊等處。古時人們常食用遏藍菜度荒充饑。目前,關于遏藍菜的研究多集中在研究其栽培技術[14-17]、種子油理化性質[18]和累積重金屬的機理[19-21]。邵樹勛等[22]在湖北漁塘壩硒礦區的調查中,發現遏藍菜是一種硒超富集植物。然而,目前對遏藍菜有效成分的結構和生理活性的研究鮮有報道,限制了其資源的開發和利用。為改變這一狀況,本研究以遏藍菜為原料,通過超聲波輔助酶法提取硒蛋白,將其純化后對其結構及抗氧化活性進行研究,旨在為遏藍菜資源的綜合利用提供試驗依據和理論參考。
1 材料與方法
1.1 試驗材料
遏藍菜樣品(50 kg)于2019年夏季從中國湖北省恩施市新塘鎮雙河魚塘壩的人工種植基地采收。DEAE-Sepharose FF購自上海源葉生物科技有限公司;透析袋購自北京索萊寶科技有限公司;考馬斯亮藍G-250、鹽酸、氫氧化鈉和氯化鈉等均為分析純,購自國藥集團化學試劑有限公司。
1.2 試驗方法
1.2.1 材料預處理 遏藍菜用水洗凈,將其根、莖和葉放置在50 ℃烘箱中干燥48 h,粉碎后過80目篩得遏藍菜根、莖和葉等不同部位的干粉。將不同部位干粉用石油醚(料液比1∶10)脫色脫脂30 min,靜置澄清,傾出上層石油醚,重復此過程3~5次。后置于烘箱中烘干,儲存于干燥器中備用。
1.2.2 遏藍菜各部位蛋白含量和硒含量的測定 取遏藍菜不同部位的干粉各5 g,加入100 mL蒸餾水,50 ℃水浴振蕩提取4 h;4 500 r/min離心15 min,取上清液;采用考馬斯亮藍G250法測定各部位干粉上清液中的蛋白含量,并用原子熒光光譜法(AFS)對各部位干粉上清液中的硒含量進行測定[23]。
1.2.3 4種含硒蛋白的提取 選取遏藍菜蛋白得率及含硒量均較高部位的干粉,進行蛋白的分級提取,并分析不同蛋白組分的蛋白含量及硒含量[24]。
遏藍菜水溶性含硒蛋白的提取:首先,按 1∶20(W/V)的比例將樣品與蒸餾水混合,50 ℃水浴震蕩提取4 h,將提取液以4 500 r/min離心15 min,取上清液并收集殘渣1;往上清液中加入w=80%的硫酸銨溶液沉淀蛋白,4 ℃下過夜,離心(4 500 r/min,15 min)取沉淀。沉淀用去離子水透析(截留分子質量3.5 ku)72 h以除去雜質,凍干后得水溶性含硒蛋白。
遏藍菜鹽溶性含硒蛋白的提取:將殘渣1按1∶20(W/V)的比例與0.5 mol/L的NaCl溶液混合,后續實驗操作與水溶性含硒蛋白的提取一致,最后得到殘渣2和鹽溶性含硒蛋白。
遏藍菜醇溶性含硒蛋白的提取:將殘渣2用蒸餾水洗滌2~3次后,按1∶20(W/V)的比例與75%乙醇混合,后續實驗操作參照水溶性含硒蛋白的提取,沉淀蛋白前,先通過40 ℃減壓蒸餾以除去上清液中的乙醇,最后得到殘渣3和醇溶性含硒蛋白。
遏藍菜堿溶性含硒蛋白的提取:將殘渣3用蒸餾水洗滌2~3次后,按1∶20(W/V)的比例與0.1 mol/L的NaOH溶液混合,后續實驗操作與水溶性含硒蛋白的提取一致,最后得到堿溶性含硒蛋白。
1.2.4 超聲輔助酶法提取硒蛋白 采用超聲輔助酶法提取遏藍菜中蛋白純度和硒含量均較高的粗硒蛋白。取遏藍菜干粉5 g,加入酶(1%酶添加量,纖維素酶∶果膠酶=6∶4)及超純水100 mL,50 ℃超聲(300 W)輔助提取60 min。離心(6 000 r/min,10 min)得上清液,后續試驗操作與沉淀水溶性含硒蛋白的方法一致,沉淀經透析、凍干后得粗硒蛋白。
1.2.5 硒蛋白的純化 使用蛋白純化儀[25](AKTA Purifier 100,General Electric,瑞典)和DEAE-Sepharose FF層析柱對粗硒蛋白進行純化。將粗硒蛋白20 mg溶于10 mL去離子水中,加入1% H2O2溶液于40 ℃下反應1 h以脫色,結束后將樣品溶液冷卻至室溫過0.22 μm水性濾膜。將濾液加樣于DEAE-Sepharose FF層析柱,以含0、0.2、0.4、0.6和0.8 mol/L NaCl的Tris-HCl緩沖鹽(pH 8.0,25 mmol/L)作為洗脫液,控制洗脫速度為1 mL/min,每5 min收集一管。以對應梯度的緩沖鹽為空白,于280 nm處檢測洗脫液的紫外吸收值并繪制洗脫曲線。收集單一峰位洗脫組分,去離子水透析(截留分子質量3.5 ku)72 h,濃縮、凍干以備用。
1.2.6 硒蛋白的光譜分析 將純化后的蛋白組分溶于去離子水中,配制成0.5 mg/mL的溶液,采用紫外分光光度計(UV-2550,Shimadzu,日本)測定樣品在190~800 nm的紫外吸收光譜。并用壓片法制備紅外光譜儀(FT-IR)測量所用的樣品,即將樣品(1 mg)與KBr粉末(100 mg)混合后壓片,采用FT-IR(Vetex70,Bruker,德國)在 400~4 000 cm-1下進行分析。
1.2.7 氨基酸組成分析 硒蛋白水解氨基酸含量的測定參照GB 5009.124-2016食品安全國家標準進行,即將氨基酸標準品及樣品溶于濃鹽酸溶液(6 mol/L)中水解,采用全自動氨基酸分析儀(L-8900,Hitachi,中國)進行分析。
1.2.8 掃描電鏡分析 根據尹仁文等[26]的方法,取適量的樣品放置于導電膠上,固定后噴金,采用場發射掃描電子顯微鏡(Nano SEM-450,FEI,美國)對樣品形貌進行觀察和拍照。
1.2.9 抗氧化活性測定 DPPH自由基清除活性:采用Teng等[27]的方法,測定硒蛋白清除DPPH自由基的活性。將各蛋白組分配制成不同濃度(2、4、6、8和10 mg/mL)的溶液。取0.5 mL樣品溶液和150 μL 0.1 mmol/L DPPH無水乙醇溶液混合,避光孵育30 min。以維生素C溶液作陽性對照,于517 nm處測量吸光度。計算硒蛋白清除DPPH自由基的能力:
式中,A0為150 μL DPPH-乙醇溶液和0.5 mL水的吸光度;A1為150 μL乙醇和0.5 mL樣品溶液的吸光度;A2為150 μL DPPH-乙醇溶液和0.5 mL樣品溶液的吸光度。
羥基自由基清除活性:采用水楊酸法[28]測定硒蛋白清除羥基自由基的活性。將不同濃度(2、4、6、8和10 mg/mL)的樣品溶液、硫酸亞鐵溶液(20 μL,9 mmol/L)、水楊酸(20 μL,9 mmol/L)溶液和過氧化氫溶液(20 μL,20 mmol/L)混合,于37 °C下孵育30 min。以維生素C溶液作陽性對照,于510 nm處測量吸光度。計算硒蛋白清除羥基自由基的能力:
式中,A2為無水乙醇代替水楊酸乙醇測得的反應體系的吸光度;Ac為去離子水代替樣品溶液測得的反應體系的吸光度;A1為樣品溶液的吸光度。
超氧自由基清除活性:在96孔板中,將150 μL 50 mmol/L Tris-HCl緩沖液、10 μL 3 mmol/L鄰苯三酚溶液和40 μL樣品溶液(2、4、6、8和10 mg/mL)混合。以維生素C作陽性對照,5 min內每隔30 s在325 nm處測量反應體系的吸光度。計算硒蛋白的超氧自由基清除率:
式中,K0為空白管(蒸餾水代替樣品)的吸光度變化的斜率;K1為樣品管吸光度變化的斜率;K10為背景管(鹽酸代替鄰苯三酚)吸光度變化的斜率。
總還原力測定:采用鐵氰化鉀比色法[29]測定硒蛋白的總還原力。取樣品溶液(2、4、6、8和10 mg/mL)4 mL與1 mL磷酸鹽緩沖液(0.1 mol/L,pH 6.6)及1 mL 1%鐵氰化鉀溶液混合,置 50 ℃水浴加熱20 min,冷卻后加入1 mL 10%三氯乙酸溶液混合并振蕩。4 000 r/min離心5 min得上清液,取2 mL上清液和2 mL蒸餾水及0.4 mL三氯化鐵溶液混合,于50 ℃水浴加熱10 min。以維生素C作陽性對照在700 nm處測定吸光度,吸光度越高表示硒蛋白的還原能力越強。
2 結果與分析
2.1 硒蛋白的提取
遏藍菜不同部位干粉中蛋白含量和硒含量:遏藍菜各部位干粉的蛋白含量和硒含量如表1所示,可見各部位蛋白含量為葉>莖>根,硒含量為葉>根>莖,表明硒和蛋白均在葉部位累積。這可能是由于植物根部通過硫酸鹽轉運蛋白從土壤中吸收無機硒后,無機硒從根部迅速轉移到葉片中,在葉綠體中轉化為有機態硒[30],使得植物葉部位的硒蛋白含量最多。
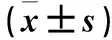
表1 遏藍菜不同部位中的蛋白含量和硒含量Table 1 Protein content and selenium content in different positions of Thlaspi arvense L.
粗硒蛋白制品的蛋白含量和硒含量:取硒含量和蛋白含量均較高的葉部位為原料進行蛋白的分級提取,采用考馬斯亮藍G250法測定蛋白含量,AFS法測定硒含量。如表2所示,4種蛋白粗制品的蛋白含量和硒含量的次序均為:堿溶性含硒蛋白>水溶性含硒蛋白>鹽溶性含硒蛋白>醇溶性含硒蛋白。但是由于堿法提取的硒蛋白品質較差[31],所以在后續試驗中采用水溶性含硒蛋白提取法進行提取。為了提高硒蛋白的得率,在水提法的基礎上設計超聲輔助酶提法,發現超聲輔助酶法提取的蛋白得率為3.75%,比熱水浸提法(得率僅為0.33%)提高3.42%,表明超聲輔助酶法能顯著提高蛋白得率。綜上,本研究采用超聲輔助酶法提取遏藍菜葉中的水溶性含硒蛋白,具有較高的含硒蛋白得率,所得硒蛋白品質較好,在后續的純化和表征試驗中均以此法提取遏藍菜含硒蛋白。
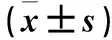
表2 4種粗硒蛋白制品的蛋白含量和硒含量Table 2 Protein content and selenium content in four crude selenoproteins
2.2 硒蛋白的純化
硒蛋白洗脫曲線如圖1所示,蛋白粗品經DEAE-Sepharose FF層析柱洗脫后得到5個級分(PSP-1、PSP-2、PSP-3、PSP-4、PSP-5)。其中,PSP-2和PSP-3的吸光值比較高,提示它們的蛋白含量比較高。因此,選取這兩個級分進行后續AFS硒含量檢測,檢測結果表明PSP-2和PSP-3級分的含硒量分別為2.456 μg/g和2.569 μg/g。
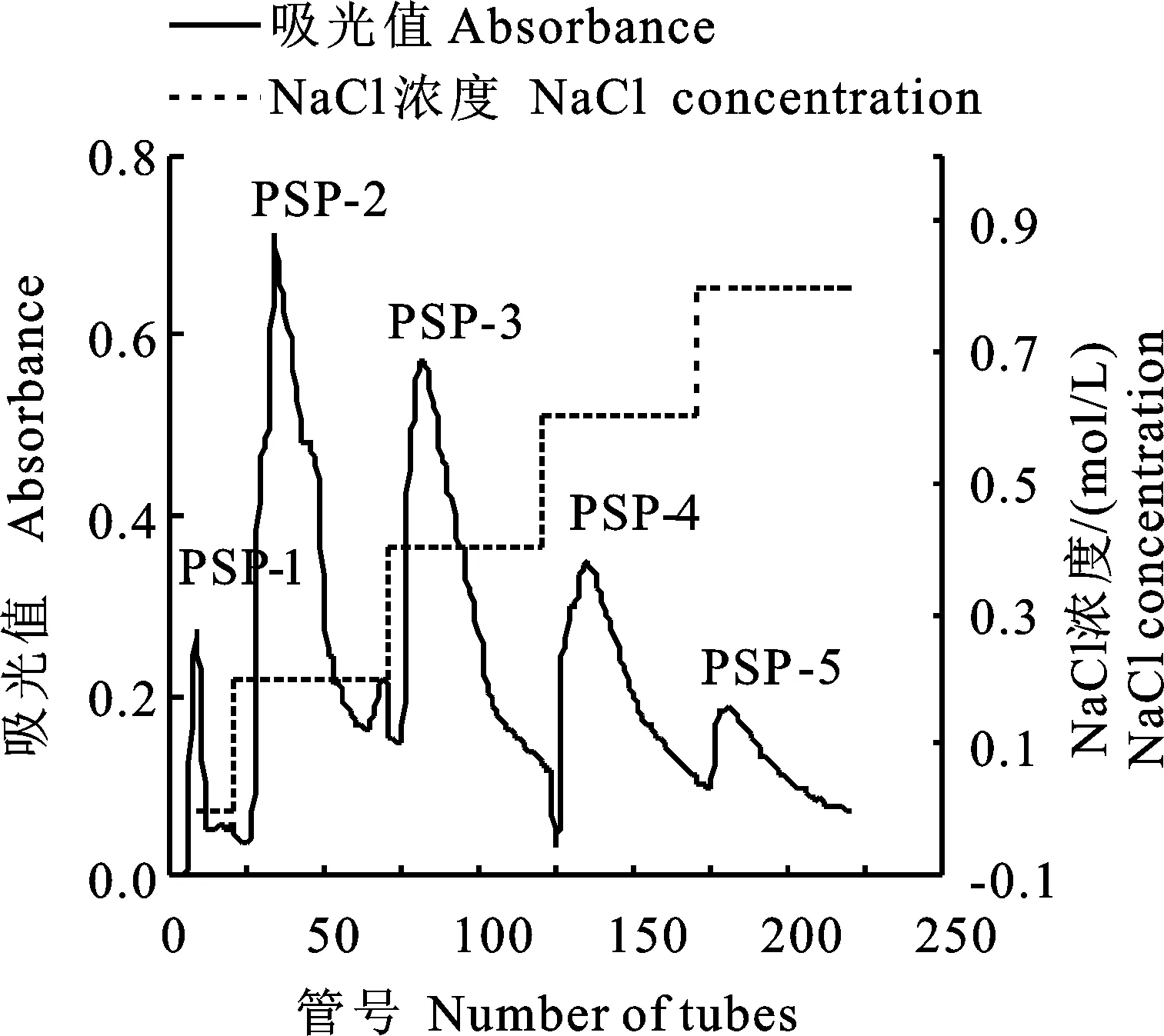
圖1 PSP在DEAE-Sepharose FF陰離子交換柱上的色譜圖Fig.1 Anion-exchange chromatogram of PSP on DEAE-Sepharose FF
2.3 氨基酸組成分析
由表3可知,PSP-2和PSP-3級分分別由15種不同的氨基酸組成,包含6種必需氨基酸,且必需氨基酸含量占比高,說明PSP-2和PSP-3氨基酸種類齊全、組成合理。其中亮氨酸、苯丙氨酸、賴氨酸和異亮氨酸合并的含量較高,這4種氨基酸合并量分別占PSP-2和PSP-3氨基酸總量的42%和34%。這4種氨基酸可參與機體對蛋白質代謝的調控,與人體肝臟功能密切相關[32]。因此,遏藍菜硒蛋白具有作為保肝產品原料的潛力。

表3 PSP-2和PSP-3的氨基酸組成與含量Table 3 Composition and content of amino acids of PSP-2 and PSP-3
PSP-2和PSP-3氨基酸成分的評分:為了進一步分析遏藍菜硒蛋白的營養價值,依照關海寧等[33]的方法,將PSP-2及PSP-3的必需氨基酸含量與聯合國糧農組織/世界衛生組織(FAO/WHO)提出的理想蛋白質中對應氨基酸參考值[34]作比較,得到表4所示結果。可知,PSP-2的含硫氨基酸(蛋氨酸+胱氨酸)的氨基酸評分最高,PSP-3的纈氨酸與酪氨酸的氨基酸評分最高。另外,根據FAO/WHO推薦的模式,E/T比應不少于0.40,E/N比值應不少于0.60,PSP-2及PSP-3的E/T和E/N比值均高于上述標準 (表3)。說明遏藍菜硒蛋白的必需氨基酸模式接近FAO/WHO的推薦模式,具有較好的營養 價值。

表4 PSP-2和PSP-3的氨基酸評分Table 4 Hydrolyzed amino acid score in PSP-2 and PSP-3
2.4 紫外光譜分析
PSP-2和PSP-3的紫外掃描圖譜如圖2所示。PSP-2在240 nm附近的吸收峰和PSP-3在260 nm附近的吸收峰來源于兩種蛋白中所含的肽鍵[35],兩個峰的強度均較高,提示兩種樣品均含有較多的肽鍵,且PSP-2中的肽鍵更多。280 nm附近的吸收峰對應PSP-2和PSP-3中芳香族氨基酸(酪氨酸和苯丙氨酸)中存在的共軛雙鍵吸收區[36]。以上兩處的吸收峰證明了純化后的樣品主要成分為蛋白質。另外,PSP-2和PSP-3在350 nm附近有一較弱肩峰,源于蛋白中二硫鍵的吸收。二硫鍵具有穩定蛋白分子肽鏈空間結構的能力,從圖2可以看出此肩峰強度較小,說明PSP-2和PSP-3中二硫鍵數目少[37],結構不穩定。

圖2 PSP-2和PSP-3的紫外掃描光譜Fig.2 UV scanning spectra of PSP-2 and PSP-3
2.5 紅外光譜分析
PSP-2和PSP-3的紅外圖譜如圖3所示。兩組分在酰胺Ⅰ、Ⅱ、Ⅲ帶均有明顯的特征峰,說明遏藍菜硒蛋白具有典型的蛋白紅外光譜特征。其中,3 400~3 440 cm-1的吸收峰對應蛋白酰胺A帶的特征峰,PSP-2和PSP-3的酰胺A帶在 3 408 cm-1及3 412 cm-1處,由N-H的伸縮振動引起。

圖3 PSP-2、PSP-3和Na2SeO3的紅外光譜圖Fig.3 FT-IR spectra of PSP-2,PSP-3 and Na2SeO3
1 690~1 630 cm-1對應于蛋白酰胺Ⅰ帶的吸收峰,由C=O的伸縮振動引起,PSP-2和PSP-3的酰胺Ⅰ帶在1 622 cm-1及1 628 cm-1處,吸收峰發生藍移,可能是由于硒與蛋白結合所致。 1 650~1 590 cm-1對應于蛋白酰胺Ⅱ帶的吸收峰,主要由-COO-的伸縮振動導致,PSP-2和PSP-3的酰胺Ⅱ帶在1 468 cm-1處,吸收峰發生藍移,證明PSP-2和PSP-3的肽鏈中存在氫鍵[38]。 1 335~1 200 cm-1對應于蛋白酰胺Ⅲ帶的吸收峰, PSP-2和PSP-3的酰胺Ⅲ帶在1 298 cm-1與 1 294 cm-1處,由C-N伸縮振動引起。此外,3 018 cm-1附近對應PSP-2和PSP-3酰胺B帶的C-H的特征峰,1 067 cm-1及1 063 cm-1處的峰對應于PSP-2和PSP-3中氨基的特征峰。
在Na2SeO3紅外光譜中(圖3),746 cm-1處的吸收峰為Se=O特征峰。而在PSP-2和PSP-3紅外光譜中, 775 cm-1與773 cm-1處的峰分別對應于Se=O特征峰,推測這可能是蛋白中其他官能團影響的結果。另外,PSP-21067cm-1處的峰和PSP-3 1 063 cm-1處的峰分別對應于O-Se-O鍵[39]。這些結果進一步證實硒化蛋白存在于PSP-2和PSP-3中。
2.6 掃描電鏡分析
PSP-2和PSP-3在不同放大倍數下的SEM圖(圖4)顯示:在8 000倍的放大倍數下,硒蛋白呈現出碎片和大小不一聚集體的表面形態,聚集體表面有不規則的凸起結構;在 30 000倍的放大倍數下,硒蛋白具有球狀結構,球狀表面凹凸不平。以上觀察結果表明遏藍菜硒蛋白結構不穩定,易于通過氫鍵和疏水作用形成復雜的空間結構[40]。另外,SEM結果顯示有大量表面光滑的小碎片分布在PSP-2及PSP-3中,這些碎片的產生可能是超聲處理所致,因為超聲波產生的較高的剪切力和空化作用會引起蛋白質解折疊[41],導致蛋白質的顆粒尺寸減小[42]。SEM結果還顯示兩種蛋白組分的球狀結構中都存在孔洞,推測該孔洞為硒與蛋白結合的位點[43]。上述SEM觀察結果從微觀形貌方面證明了PSP-2及PSP-3中存在含硒蛋白。此外,PSP-2中小片段之間連接松散,而與PSP-2片段相比則PSP-3連接比較緊密,這種蛋白表面形貌的差異可能與它們具有不同的生物活性有關。

圖4 PSP-2(A:8 000×;B:30 000×)和PSP-3(C:8 000×;D:30 000×)的掃描電鏡圖Fig.4 Scanning electron micrographs of PSP-2(A:8 000×;B:30 000×) and PSP-3(C:8 000×;D:30 000×)
2.7 硒蛋白的抗氧化活性
PSP-2和PSP-3的抗氧化活性的檢測結果(圖5)顯示:隨著樣品濃度的不斷提高,PSP-2和PSP-3的抗氧化活性也隨之增加。在4個體外抗氧化試驗中,當樣品濃度均為10 mg/L時,PSP-2和PSP-3的DPPH自由基清除率分別為52.79%和51.09%,羥基自由基清除率分別為68.61%和86.52%,超氧自由基清除率分別為40.53%和42.84%,總還原力檢測在700 nm處的吸光度為0.33和0.18。表明PSP-2和PSP-3具有較強的自由基清除能力和總還原力。在測試范圍內的同一質量濃度下,PSP-2的DPPH自由基清除能力和總還原力略強于PSP-3,而羥基自由基清除能力和超氧自由基清除能力略弱于PSP-3。

A.PSP-2和PSP-3對DPPH自由基的清除能力; B.PSP-2和PSP-3對羥基自由基的清除能力; C.PSP-2和PSP-3對超氧陰離子自由基的清除能力; D.PSP-2和PSP-3的還原力作用曲線
對比兩種蛋白含硒量及抗氧化活性,可得出蛋白含硒量越高,其羥基自由基和超氧自由基清除能力越強的結論。胡振瀛等[44]研究發現靈芝硒蛋白的超氧自由基和羥基自由基清除能力隨蛋白硒含量的增加而增強,杜明等[45]研究發現富硒菜籽粕蛋白比普通菜籽粕蛋白具有更強的抗氧化活性,均與本研究結果基本一致。此外,有研究報道蛋白的抗氧化活性與其疏水性氨基酸的含量密切相關。由氨基酸分析可知,PSP-2的疏水性氨基酸含量多于PSP-3的疏水性氨基酸含量,這可能是PSP-2的DPPH自由基清除能力及總還原力強于PSP-3的原因。
3 結論與討論
深入研究和開發硒蛋白,具有重要意義。中國是缺硒大國,約有72%的地區缺硒[46],發現和研究富硒食品和其他補硒劑對于提高國民身體健康水平具有格外重要的作用。硒蛋白是有機硒的主要載體,膳食中的硒蛋白在十二指腸發生水解,被機體吸收。因此,深入研究硒蛋白的生物學特性,開發更多適合人體利用的硒蛋白產品,將有助于促進國民身體健康水平的提高。硒蛋白是微量元素硒發揮其生物活性的主要功能形態,具有多種功效。研究和開發具有優良生物學活性的硒蛋白,對相關疾病的防治將具有積極的作用。綜上,硒蛋白具有食補和藥用兩方面的價值,具有良好的市場潛力,對其進行深入研究十分重要。遏藍菜的元素富集功能,使得對其與硒補充和硒利用關聯的研究顯得更為重要。研究表明在遏藍菜中,硒主要以有機硒形式賦存,蛋白硒是主要的賦存狀態。但是,遏藍菜硒蛋白的性狀和特性如何,至今仍沒有相關報道,亟待深入研究。
本研究以遏藍菜為原料,獲得具有較高營養價值及優良抗氧化能力的硒蛋白。并證明遏藍菜硒蛋白既可以作為綠色植物硒補充劑,應用于食療保健領域,也具有作為抗氧化劑應用于相關疾病防治的潛力。總體而言,研究結果對遏藍菜資源的合理深加工和改良具有促進作用,也為進一步研究遏藍菜硒蛋白的構效關系以設計出具有強大抗氧化活性的定制富硒蛋白提供了基礎。

