DNA三角雙錐熒光分子探針的制備及初步生物學評價
段曉燕,都義日,翁兆平,王 濤,2,李劍波,2
1內蒙古醫科大學附屬醫院核醫學科,內蒙古 呼和浩特 010050;2內蒙古自治區分子影像學重點實驗室,內蒙古呼和浩特010050
分子影像技術的發展離不開兩個重要因素,即高親和性的分子探針和探測分子探針信號的成像設備,納米技術的發展加快了納米顆粒在生物醫學方面的應用[1-3]。納米顆粒具有信號強度高、載帶能力大、尺寸小和多功能潛力等特點,越來越多的研究者轉向開發新型納米顆粒。但一些納米顆粒由于生物相容性差而對活體動物的正常組織或器官產生潛在的毒性,如量子點[4]、非晶硅納米顆粒[5]、中空介孔硅球[6]等,導致這些納米顆粒很難向臨床轉化。故尋找一種生物相容性好,又能構建成納米顆粒的材料,成為研究人員的當務之急。
DNA作為一種生物體內儲存遺傳信息的生物大分子而被大家熟知,而近幾年作為一種納米材料又引起廣泛關注[7-8]。DNA能夠按照Watson-Crick堿基配對原則構建出各種不同形狀和尺寸的DNA納米結構,如DNA四面體[9-10]、DNA三角雙錐[11-12]、DNA立方體[13-14]等。這些結構均表現出結構可控性和高精度性,同時具有穩定性強、生物相容性好和載藥能力強等特點[15]。基于DNA納米結構的優勢,本研究將對DNA納米結構之一的DNA三角雙錐結構(DBN)進行熒光標記。因相關文獻報道少,本研究計劃采用課題組前期放射性核素锝-99m標記DBN的策略來研究熒光試劑DyLight 755標記DBN,并對所制備的熒光分子探針進行一系列的生物學評價,探索分子探針在實驗動物體內的生物分布和代謝途徑,期望制備的熒光分子探針能夠在分子影像和藥物載帶方面有更廣泛的應用。
1 材料與方法
DNA寡聚核苷酸單鏈(生工生物工程(上海)股份有限公司),GelRed凝膠DNA染色溶液(Biotium),Tris堿(純度≥99.9%)(上海阿拉丁公司)。裸鼠(雌性,18~20 g)(斯貝福(北京)生物技術有限公司)。除了在實驗技術中具體說明以外,其他試劑均購自國藥集團化學試劑有限公司(上海)。
實驗動物的活體熒光成像及離體組織的熒光成像利用小動物活體影像系統(Berthold LB983 NightOWL)進行。
1.1 DNA三角雙錐顆粒的制備
根據既往文獻[16],采用一步退火法制備DBN(圖1)。將6條DNA寡聚核苷酸單鏈(a或T20-a*、b、c、A、B 和C)等摩爾量混勻,加入TM緩沖液(10 mmol/L Tris-HCl,5 mmol/L MgCl2,pH 8.0)中,加熱至95 ℃維持10 min,然后冷卻至4 ℃靜置20 min以制備目標產物。
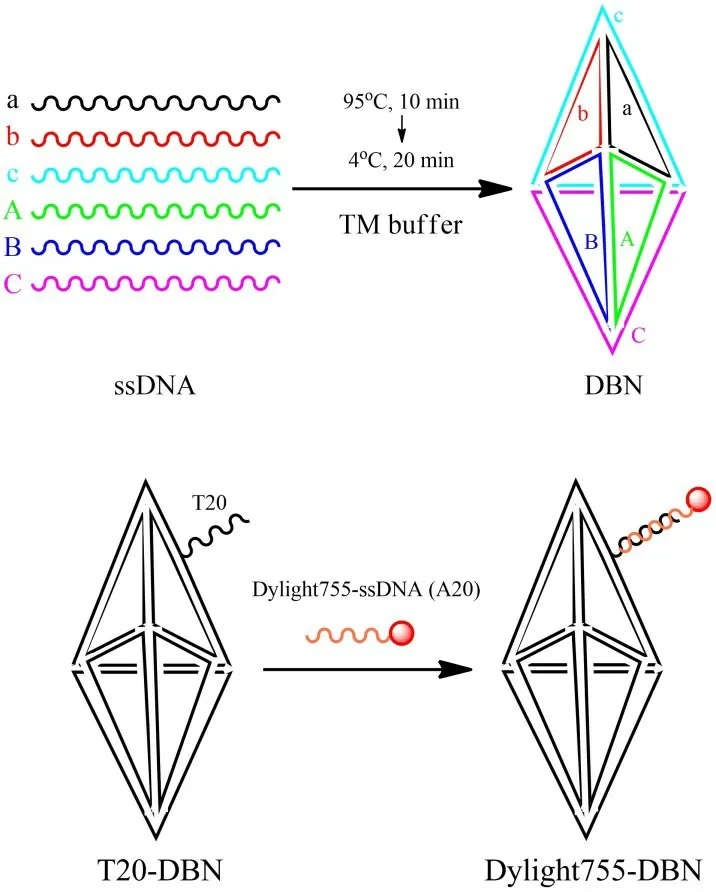
圖1 方案一:DBN及熒光分子探針Dylight755-DBN的制備Fig.1 Option 1:Preparation of DBN and fluorescent molecular probe Dylight755-DBN
通過將不同的DNA寡聚核苷酸單鏈(表1)混合,采用加熱退火自組裝法來制備攜帶或不攜帶側臂鏈的DBN。

表1 DNA寡聚核苷酸單鏈的序列信息Tab.1 Sequence information of DNA oligonucleotide single strand
1.2 DNA三角雙錐顆粒的表征
利用聚丙烯酰胺凝膠電泳(PAGE)技術,對目標產物攜帶側臂鏈DBN(T20-DBN)制備過程進行表征。電泳條件:8%PAGE膠,緩沖液為1×TAE緩沖液(12.5 mmol/L MgAc2),在4 ℃條件下電泳1.5~2 h;利用GelRed DNA凝膠染色溶液染色15 min;利用化學發光凝膠成像系統進行成像。
1.3 熒光分子探針的制備
將T20-DBN(由T20-a*、b、c、A、B 和C制備)與等摩爾量DyLight 755-ssDNA(A20)室溫下混合,渦旋溶液使其混合均勻,可制得熒光分子探針DyLight 755-DBN,通過紫外分光光度計(HITACHI U-3010,Hitachi,Ltd,Tokyo,Japan)測定濃度。
1.4 體內分布實驗
將200 μL DyLight 755-DBN(0.5 μmol/L)通過實驗鼠(n=3)尾靜脈注射體內,分別于5、15、30、60和120 min處死實驗鼠后解剖,取各主要臟器進行稱重并通過小動物活體影像系統測定各臟器的熒光計數,計算每克組織中的熒光計數。
本研究中的動物研究方案已獲內蒙古醫科大學醫學倫理委員會批準。動物實驗是按照“實驗動物護理和使用指南”(ISBN:0-309-58869-3)中的要求進行的。
1.5 小動物活體成像
將200 μL DyLight 755-DBN(0.5 μmol/L)通過實驗鼠尾靜脈注射體內,分別于注射后5、10、20、30、45及60 min將實驗鼠通過異氟烷麻醉后,仰臥位或者俯臥位置于小動物活體影像系統中進行顯像。
2 結果
2.1 DNA三角雙錐顆粒的制備與表征
將設計不同序列的DNA寡聚核苷酸單鏈(表1)混合,采用一步退火法來制備T20-DBN。T20-DBN由設計的6條DNA寡聚核苷酸單鏈(T20-a*、b、c、A、B 和C,表1)構成。將DNA 寡聚核苷酸單鏈T20-a*、b、c 或DNA 寡聚核苷酸單鏈A、B、C 這兩組組合以及組成T20-DBN的6條DNA寡聚核苷酸單鏈(T20-a*、b、c、A、B、C)分別混合后進行一步退火實驗,將所得DNA樣品進行PAGE電泳。結果顯示,T20-a*bc和ABC所形成的DNA結構相似,所以在凝膠甬道中的位置相近;而T20-DBN結構相比3條DNA寡聚核苷酸單鏈制備的DNA結構體積變大,故其在凝膠甬道中的移動速度就會減慢(圖2)。

圖2 利用聚丙烯酰胺凝膠電泳技術表征T20-DBNFig.2 Characterization of T20-DBN by Polyacrylamide Gel Electrophoresis
2.2 熒光分子探針的制備
將近紅外熒光試劑Dylight-755偶聯到DNA寡聚核苷酸單鏈A20的5’端(表1),構建T20-DBN側臂鏈的互補鏈DyLight 755-ssDNA(A20)。室溫下將T20-DBN與DyLight 755-ssDNA(A20)等摩爾量混合,即可制得熒光分子探針DyLight 755-DBN,通過紫外分光光度計定量濃度至1 μmol/L用于后續實驗研究。
2.3 體內分布
將DyLight 755-DBN注射進入實驗鼠體內后,于5、15、30、60和120 min將實驗鼠處死取主要臟器,稱重并通過小動物活體影像系統測定各臟器的熒光計數,計算每克組織中的熒光計數。體內分布結果顯示,DyLight 755-DBN進入體內后,熒光信號主要集中在腎臟、肝臟、脾臟、胃;注射熒光探針5~15 min,在實驗鼠的肺有一定的熒光信號,但15 min后,熒光信號幾乎沒有;在進行體內分布研究的各個時間點,在心臟和腦部沒有探測到熒光信號(圖3)。

圖3 DyLight 755-DBN在實驗鼠體內的分布情況Fig.3 Distribution of DyLight 755-DBN in experimental mice(n=3)
2.4 小動物活體成像
將DyLight 755-DBN通過實驗鼠尾靜脈注射入體內,于注射后的各個時間點將實驗鼠麻醉后俯臥位或仰臥位置于小動物活體影像系統中進行顯像。
通過實驗鼠仰臥位的顯像結果(圖4,下排)顯示,DyLight 755-DBN進入實驗鼠體內后分布迅速,注射5 min后,在實驗鼠的肝臟處出現熒光信號,注射30 min后,肝臟中的熒光信號一直比較強,直到注射45 min后,肝臟中的熒光信號開始下降;注射10 min后,膀胱處出現熒光信號,直到60 min,膀胱中維持較強的熒光信號。通過實驗鼠俯臥位的顯像結果(圖4,上排)顯示,注射DyLight 755-DBN 5 min后,在實驗鼠的胃部出現熒光信號,直到60 min,胃部一直維持較強的熒光信號。
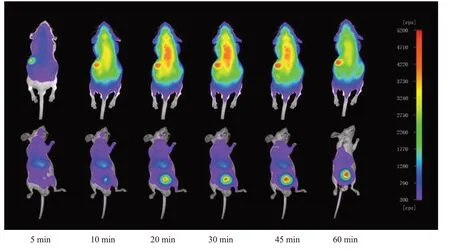
圖4 DyLight 755-DBN注射后不同時間點的實驗鼠活體顯像圖Fig.4 In vivo imaging of experimental mice at different time points after injection of DyLight 755-DBN
3 討論
本研究選擇DNADBN作為研究對象,其不但具有DNA納米結構的優勢和特點,并且制備簡單,通過將6條DNA寡聚核苷酸單鏈混勻,采用加熱退火自組裝方法來制備目標產物DBN。在課題組前期的研究中,為了實現DBN的放射性核素標記,我們將組成DBN的一條寡聚核苷酸單鏈5’端偶聯寡聚核苷酸單鏈T20,制備帶有側臂鏈的T20-DBN;同時利用氯化亞錫還原標記法,將锝-99m 標記寡聚核苷酸單鏈A20,得到99mTc-A20;利用DNA的Watson-Crick堿基配對原則,其中A與T相互配對,將T20-DBN與99mTc-A20混合雜交成功制備分子探針99mTc-DBN。基于放射性核素標記DBN的制備策略,本研究中將采用同樣的策略制備熒光分子探針。首先,從組成DNA三角雙錐納米結構的6條寡聚核苷酸單鏈中選取一條(a),將其5’端偶聯寡聚核苷酸單鏈T20,將各條寡聚核苷酸單鏈T20-a*、b、c、A、B和C混勻采用一步退火法制備T20-DBN;將熒光試劑DyLight 755偶聯于寡聚核苷酸單鏈A20的5’端,得到Dylight755-A20;將二者等摩爾量混勻,即可成功制備熒光分子探針DyLight 755-DBN。
通過將熒光分子探針DyLight 755-DBN注射入實驗鼠體內后,進行分子探針的系列體內研究。通過體內分布和小動物活體顯像研究顯示,DyLight 755-DBN在實驗鼠體內,主要分布于肝臟、腎臟、胃和脾臟,通過膀胱進行排泄。課題組前期的研究中制備的放射性分子影像探針99mTc-DBN,體內分布和小動物SPECT/CT顯像結果顯示,肝臟、腎臟和脾臟有明顯的放射性攝取,在注射分子探針15 min后,在腸道也有一定的放射性攝取,最后也是通過膀胱進行排泄[16]。兩種單模態的分子影像探針的體內研究顯示出相似的結果。兩種單模態顯像技術具有各自的優勢,而DNA納米結構的優勢之一就是易于化學修飾與藥物載帶。故在后期的研究中,我們期望構建一類基于DNA納米結構的雙模態分子探針,同時具備近紅外熒光成像和核醫學成像(正電子發射型計算機斷層顯像或單光子發射計算機斷層掃描)兩種顯像模式的優勢,能夠為藥物的體內代謝或藥物治療的機制研究提供更多信息。
綜上所述,本研究采用一步退火法制備DBN,并采用側臂鏈雜交策略成功制備熒光分子探針DyLight 755-DBN。通過系列生物學評價實驗,證明熒光分子探針DyLight 755-DBN是一種性質優良的分子影像探針。

