NR2C2介導的長鏈非編碼RNA LINC00675靶向miR-665調控肝癌細胞生物學行為的機制研究
汪建初,李曙波,陸禮柏,陳益晨,馬嘉盛,羅宗將,路遠,浦澗
【摘要】 目的 探討研究長鏈非編碼RNA LINC00675對肝癌細胞生物學行為的影響及其分子機制。
方法 通過qRT-PCR檢測LINC00675在肝癌組織以及細胞中表達量,并檢測LINC00675在肝癌細胞HepG3與Huh7細胞質及細胞核中的表達分布。通過在HepG3與Huh7中穩(wěn)定轉染慢病毒過表達LINC00675建立細胞模型。通過CCK-8與流式細胞學檢測LINC00675對肝癌細胞增殖、凋亡行為的影響,并通過檢測細胞模型中葡萄糖攝取量以及乳酸產量變化監(jiān)測細胞Warburg效應的變化,運用帶有AGO2抗體的RNA免疫沉淀技術評估LINC00675與mRNA的潛在結合能力。使用LncBase Predicted v.2 DIANA工具預測LINC00675下游mRNA靶基因。運用RNA pull-down技術檢測LINC00675與miR-665結合的可能性。運用熒光素酶實驗驗證LINC00675與miR-665的靶向結合,共轉染實驗驗證miR-665介導了LINC00675對肝癌生物學行為的影響。通過使用JASPAR數據庫預測LINC00675上游調控基因。通過構建NR2C2過表達以及敲低細胞模型,并使用qRT-PCR實驗檢測細胞模型中的LINC00675表達量的變化。運用熒光素酶實驗驗證LINC00675啟動子與NR2C2的靶向結合位點。
結果 LINC00675在肝癌細胞系中低表達,且主要表達于細胞質中。過表達LINC00675抑制肝癌細胞的增殖能力與Warburg效應,并促進肝癌細胞凋亡。NR2C2介導的LINC00675在肝癌細胞中靶向結合miR-665,負向調控miR-665的表達,并通過結合miR-665來調控肝癌細胞的生物學行為。
結論 NR2C2介導的LINC00675通過靶向結合miR-665調控肝癌細胞的增殖和凋亡的生物學行為。
【關鍵詞】 LINC00675;miR-665;NR2C2;肝癌;增殖;凋亡;Warburg效應
中圖分類號:R735.7 文獻標志碼:A DOI:10.3969/j.issn.1003-1383.2022.02.007
A study on mechanism of NR2C2 mediated long non-coding RNA LINC00675 targeting of miR-665 in regulating the biological behavior of HCC cells
[HJ1][HJ]
WANG Jianchu1, LI Shubo2, LU Libai1, CHEN Yichen1, MA Jiasheng1, LUO Zongjiang1, LU Yuan1, PU Jian1
(1. Department of Hepatobiliary Surgery, Affiliated Hospital of Youjiang Medical University for Nationalities, Baise 533000, Guangxi, China;2. Department of Biochemistry of Basic College, Youjiang Medical University for Nationalities, Baise 533000, Guangxi, China)
【Abstract】 Objective To investigate the effect of long non-coding RNA LINC00675 on the biological behavior of HCC cells and its molecular mechanism.
Methods The expression of LINC00675 in HCC tissues and cells was detected by qRT-PCR, and the expression and distribution of LINC00675 in the cytoplasm and nucleus of HCC cells HepG3 and Huh7 were detected.The cell model was established by stably transfecting lentivirus overexpression of LINC00675 in HepG3 and Huh7. The effects of LINC00675 on the proliferation and apoptosis of HCC cells were detected by CCK-8 and flow cytometry, and the changes of Warburg effect were monitored by detecting the changes of glucose uptake and lactic acid production in the cell model, and RNA immunoprecipitation with AGO2 antibody was used to evaluate the potential binding ability of LINC00675 and mRNA. LINC00675 downstream mRNA target genes were predicted by LncBase Predicted v.2 DIANA tool. The possibility of LINC00675 binding to miR-665 was examined by RNA pull-down technology. Luciferase assay was used to verify the targeted binding of LINC00675 to miR-665, and the co-transfection assay was used to verify that miR-665 mediated the effect of LINC00675 on the biological behavior of HCC. The LINC00675 upstream regulatory genes were predicted by using JASPAR database. The NR2C2 overexpression and knockdown cell model were constructed, and the changes of LINC00675 expression in the cell model were detected by qRT-PCR. In addition, the targeted binding site of the LINC00675 promoter to NR2C2 was verified by luciferase assay.
Results LINC00675 was low expressed in hepatoma cell lines and mainly expressed in cytoplasm. Overexpression of LINC00675 inhibited the proliferation and Warburg effect of hepatoma cells, and promoted the apoptosis of hepatoma cells. NR2C2 mediated LINC00675 binded miR-665 in hepatoma cells, negatively regulated the expression of miR-665, and regulated the biological behavior of hepatoma cells by binding miR-665.
Conclusion NR2C2 mediated LINC00675 regulates the biological behavior of proliferation and apoptosis of hepatoma cells by targeting the binding to miR-665.
【Key words】 LINC00675; miR-665; NR2C2; HCC; proliferation; apoptosis; Warburg effect
肝細胞癌是一種全世界范圍內高發(fā)的惡性腫瘤,在世界上癌癥致死的常見原因中位居第四[1]。 據2015年數據統(tǒng)計,肝癌在我國的患病率以及病死率均位居所有惡性腫瘤的前列[2]。由于肝癌具有進展快、轉移廣等特征,約有70%的病人在首次診斷時已失去手術治療的機會[3]。肝癌已嚴重威脅人民的生命健康,也為醫(yī)療系統(tǒng)帶來了巨大的負擔。目前迫切需要尋找到肝癌新的診斷和治療靶點。長鏈非編碼RNA作為非編碼RNA的一種,在過去幾十年已經被廣泛研究。功能上,長鏈非編碼RNA參與調節(jié)了多種細胞的生物學行為,包括增殖、遷移、侵襲、凋亡等[4~8]。機制上,長鏈非編碼RNA可通過靶向結合下游信使RNA,并在轉錄水平調控基因表達。此外,長鏈非編碼RNA還可通過與蛋白直接結合發(fā)揮作用[9~11]。長鏈非編碼RNA在各種疾病的發(fā)生發(fā)展中發(fā)揮了關鍵的作用。LINC00675已被發(fā)現參與了多種腫瘤的發(fā)生發(fā)展過程,包括卵巢癌[12]、胰腺癌[13]、胃癌[14]等。然而,LINC00675是否參與了肝細胞癌的發(fā)生發(fā)展尚不可知。本研究首先探究了LINC00675在肝癌細胞中的表達,然后通過慢病毒轉染過表達LINC00675在肝癌細胞中的表達量,檢測低表達LINC00675對肝癌細胞增殖和凋亡能力的研究,并探究了其中的分子機制。
1 材料與方法
1.1 材料
實驗中所使用的16例肝癌組織獲取于右江民族醫(yī)學院附屬醫(yī)院肝膽外科在2018至2019年所進行肝癌部分切除術的病人。實驗所使用肝癌細胞系293T工具細胞、人肝細胞LO2購于中國科學院上海細胞庫。DMEM培養(yǎng)液采購于美國HyClone公司;胎牛血清采購于美國Gibco公司;CCK-8與AnnexinⅤ-FITC/碘化丙啶(propidium iodide,PI)凋亡檢測試劑盒購于上海碧云天公司;過表達慢病毒、小干擾RNA與miRNA質粒購于上海吉凱公司; Lipofectamine 3000試劑盒購于美國Invitrogen 公司;實時定量PCR實驗所使用TRIzol試劑、PrimerScript RT Master以及SYBR?premix Ex Taq試劑盒購于日本Takara公司。
1.2 方法
1.2.1 臨床組織樣本
肝癌組織和相鄰的癌旁組織樣本(距離腫瘤組織>3 cm)取自2018至2019年在本院進行肝癌手術的16例病人。所有組織均經過病理學鑒定,樣本研究獲得患者同意并簽署知情同意書。樣本組織切除后即刻保存于液氮中以備后續(xù)研究。本研究中所涉及肝癌組織樣本實驗已通過右江民族醫(yī)學院附屬醫(yī)院倫理委員會批準。LINC00675在癌與癌旁組織中的表達量通過實時熒光定量PCR實驗檢測完成。
1.2.2 細胞培養(yǎng)與轉染
將肝癌細胞放置于含有10%胎牛血清的DMEM培養(yǎng)基中,在37℃、5% CO2的培養(yǎng)箱中培育、傳代。當培養(yǎng)皿中的細胞融合度達到60%左右時,對細胞進行LV-LINC00675,以及miRNA轉染,并將NC空載體作為陰性對照。通過使用lipofectamine 3000試劑盒完成細胞轉染,在轉染2天后,提取RNA進行檢測。慢病毒質粒、小干擾RNA以及miRNA質粒由上海吉凱公司構建提供。
1.2.3 PCR定量
使用TRIzol提取細胞中的RNA,使用PrimerScript RT Master(Takara)試劑完成RNA逆轉錄為cDNA過程,使用SYBR?premix Ex Taq(TaKaRa)完成PCR擴增,U6作為miRNA內參,GAPDH作為LINC00675內參,使用2-ΔΔCt計算相對表達量。實驗中所使用引物如下 (5’到3’),LINC00675:上游 GCCTACTGCTCTGGATCATCTGGTA,下游 TGGCGTACAGGTCTTTGCGG;miR-665:上游 GTCGTATCCAGTGCAGGGTCCG,下游 AGGTGCACTGGATACGACAGGGGC;NR2C2:上游 CCTCTGGCCCATTGAGTGTTT,下游 GTCCACTGCGGTGACTATCTG;U6:上游 GTCGTATCCAGTGCAGGGTCCGA,下游 GGTGCACTGGATACGACAAAATATGG;GAPDH:上游 GGACCTGACCTGCCGTCTAG,下游 GTAGCCCAGGATGCCCTTGA。
1.2.4 熒光原位雜交實驗(fluorescence in situ hybridization,FISH)
生物素標記的LINC00675探針由IDT(美國集成DNA技術公司)設計和合成。探針信號由Alexa FluorTM 594 Tyramide SuperBoostTM (Thermo Fisher Scientific)試劑盒依照說明書進行實驗檢測。
1.2.5 細胞增殖實驗
待肝癌細胞穩(wěn)定轉染后,將細胞接種于96孔板中 (每孔細胞量104,并設置三個副孔)。在37℃、5% CO2培養(yǎng)箱中培養(yǎng)24小時,之后加入10 μL CCK-8溶液,繼續(xù)培養(yǎng)2小時,在450 nm波長處,使用酶標儀檢測吸光度,并計算細胞的增殖/抑制率,實驗重復三次。
1.2.6 細胞凋亡實驗
將穩(wěn)定轉染肝癌細胞HepG3與Huh7及其陰性對照組細胞分別接種于6孔板中(每孔約105個細胞)培養(yǎng)24小時,用胰蛋白酶消化后使用PBS清洗三次。將細胞懸液調整至100 μL后根據說明書加入定量AnnexinⅤ-FITC和PI,室溫避光20分鐘,用流式細胞儀檢測細胞凋亡情況。
1.2.7 Warburg 效應檢測
根據制造商的說明,使用葡萄糖分析試劑盒(ab65333,英國劍橋Abcam)和乳酸分析試劑盒(ab65330,英國劍橋Abcam)對葡萄糖消耗和乳酸產生進行分析。使用微孔板讀取器檢測570 nm處的吸光度。
1.2.8 RNA免疫共沉淀
RNA免疫共沉淀根據Magna RIP RNA-binding protein immunoprecipitation kit (Millipore, Germany)說明書進行實驗,實驗中加入AGO2抗體以及IgG抗體,通過PCR檢測蛋白沉淀物中的目的RNA表達。
1.2.9 RNA pull-down實驗
將全長的LINC00675序列交予上海吉凱公司進行Biotinylate標簽化,轉染細胞后,取細胞裂解液與C-1磁珠 (Life Technologies, USA)共同孵育,形成磁珠-探針復合物,使用PCR技術探測復合物中目的RNA的表達量。
1.2.10 雙熒光素酶實驗
將野生型(WT)與突變型(Mut)LINC00675序列插入pGL4.74載體中,構建熒光素酶質粒,并與miR-665 mimic質粒或NR2C2過表達慢病毒共同分別轉染至細胞中,24小時后使用熒光素酶報道系統(tǒng)檢測細胞熒光素酶活性,并記錄結果,實驗重復三次。
1.3 統(tǒng)計學方法
本實驗采用SPSS 16.0統(tǒng)計軟件對實驗結果進行統(tǒng)計分析,使用student t-test對兩組結果之間的差異進行顯著性分析,使用One-way ANOVA方法對多組實驗結果之間的差異進行顯著性分析。實驗結果以(±s)表示,檢驗水準:α=0.05,雙側檢驗。
2 結 果
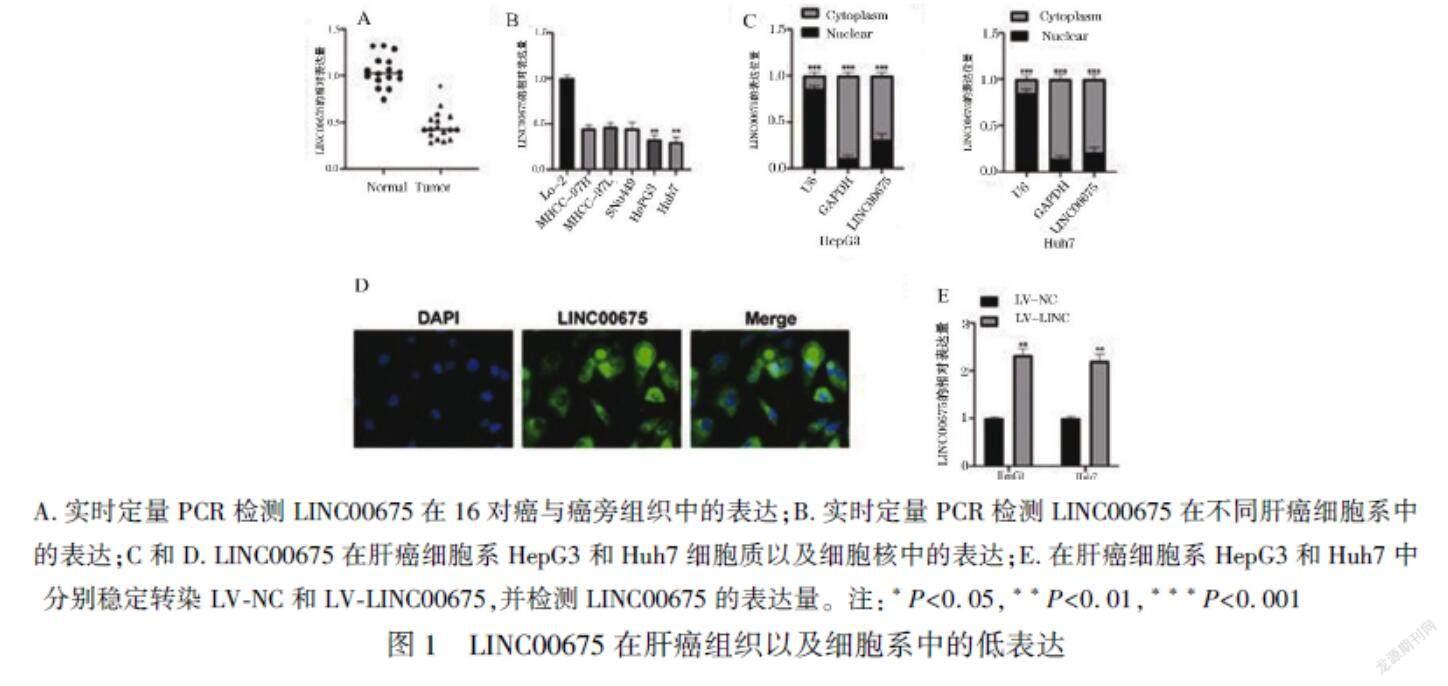
2.1 LINC00675在肝癌組織以及細胞系中的低表達
首先我們探究了LINC00675在肝癌組織以及細胞系中的表達情況,結果顯示,與癌旁組織相比較,LINC00675在癌組織中表達降低 (P<0.05),見圖1A。與正常肝細胞LO2相比較,LINC00675在肝癌細胞中普遍低表達,且在肝癌細胞HepG3和Huh7中表達最低(P<0.01),見圖1B。之后我們檢測了LINC00675在肝癌細胞HepG3和Huh7的細胞質以及細胞核中的表達量,結果顯示LINC00675在細胞質中高表達, 但在細胞核中低表達(P<0.001),見圖1C與D。為進一步研究LINC00675在肝癌細胞中的功能,我們通過將LV-LINC00675及其陰性對照組(LV-NC)轉染至HepG3和Huh7細胞中,結果顯示LV-LINC00675明顯提升了LINC00675在HepG3和Huh7中的表達(P<0.01),見圖1E。
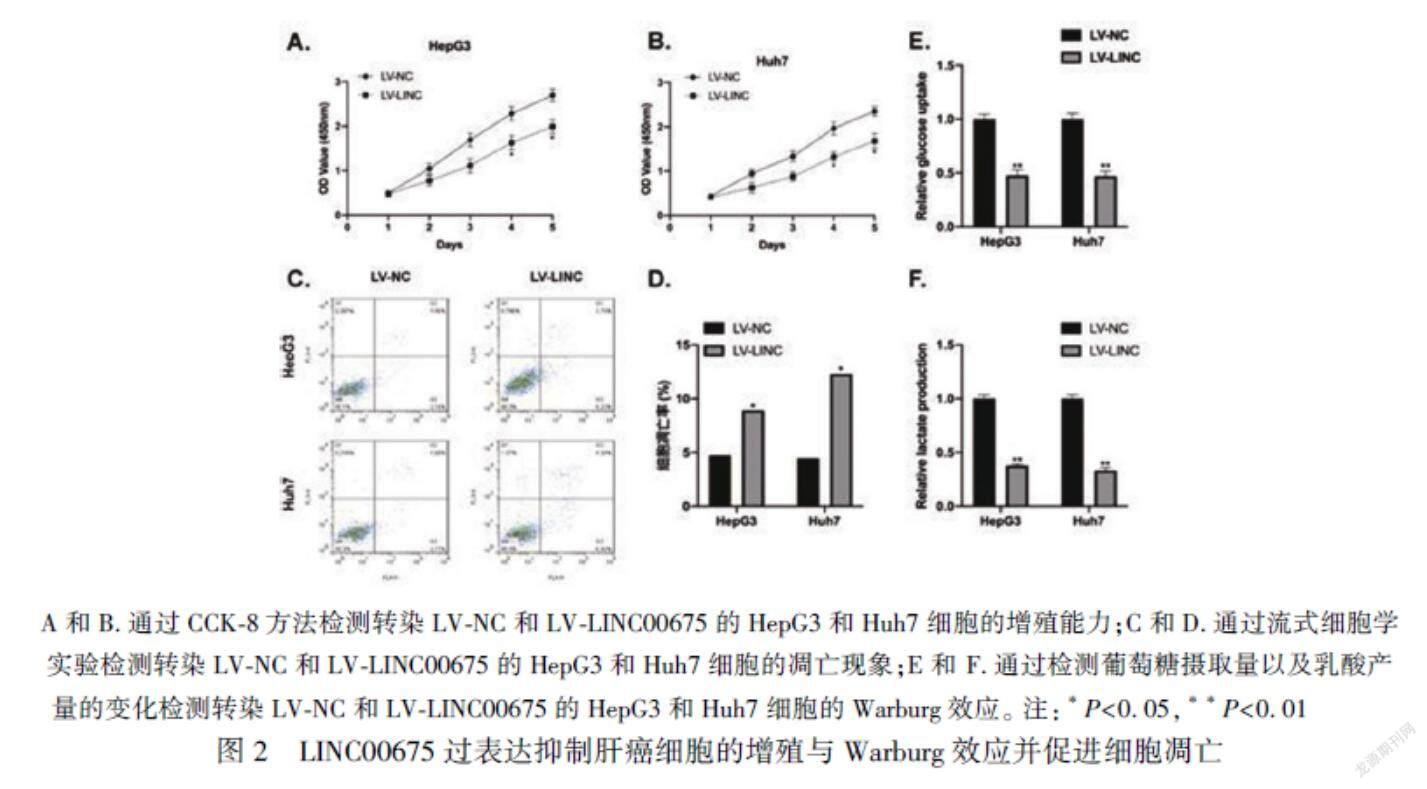
2.2 LINC00675過表達抑制肝癌細胞的增殖與Warburg效應并促進細胞凋亡
我們通過構建穩(wěn)定高表達的LINC00675細胞HepG3和Huh7進行功能學研究,CCK-8結果顯示,與陰性對照組(LV-NC)相比較,細胞HepG3和Huh7在過表達LINC00675后的細胞增殖能力明顯降低(P< 0.05),見圖2A和B。而與陰性對照組(LV-NC)相比較,HepG3和Huh7細胞的凋亡現象在LINC00675過表達之后顯著增高(P<0.05),見圖2C和D。此外,過表達LINC00675顯著抑制了肝癌細胞葡萄糖的攝取量以及乳酸的產量(P<0.01),見圖2E和F。
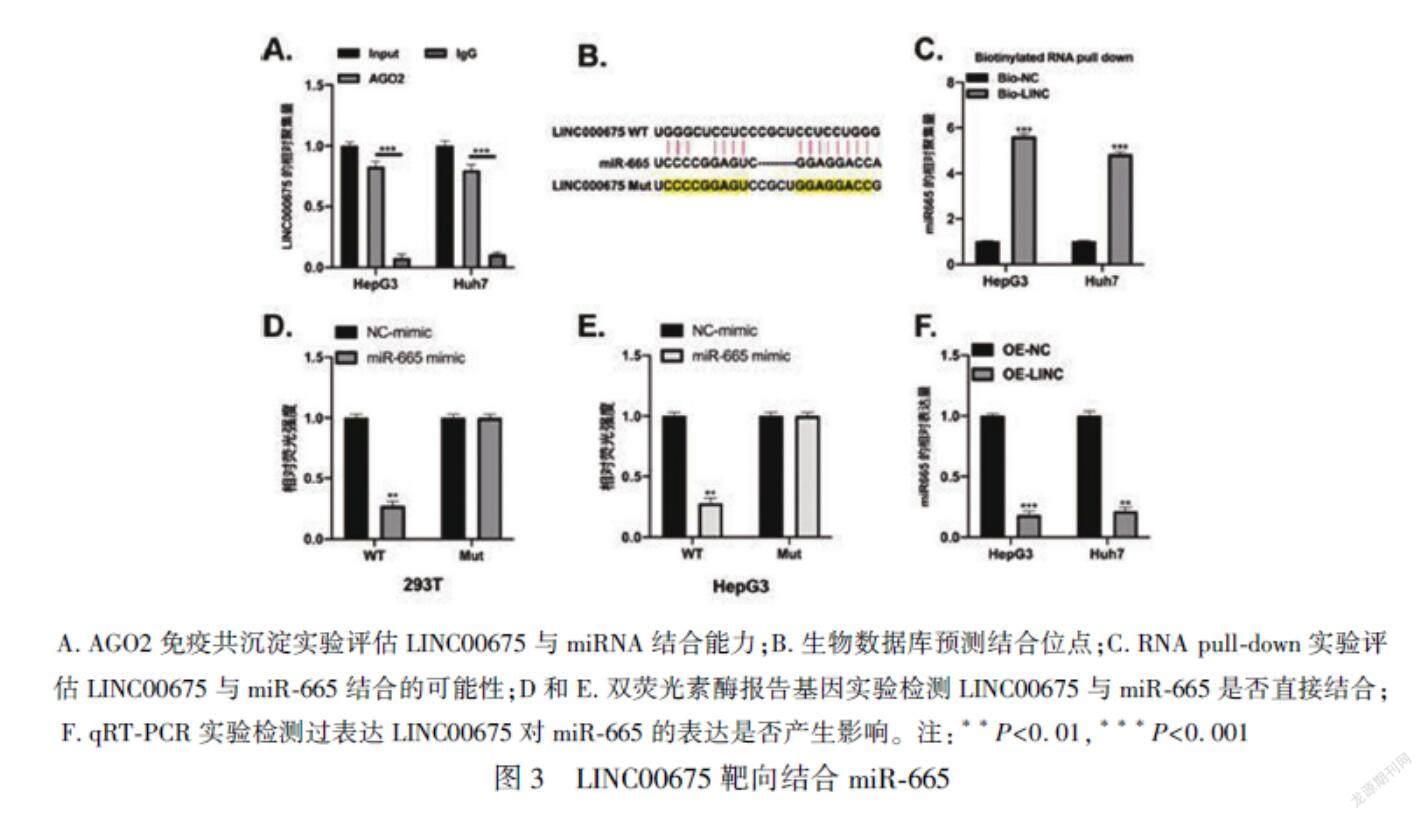
2.3 LINC00675靶向結合miR-665
為探究LINC00675調控肝癌細胞增殖和凋亡現象背后的分子機制,我們對LINC00675下游分子進行了探究。AGO2-免疫共沉淀實驗結果顯示,與對照組IgG抗體對比,LINC00675與AGO2抗體大量結合,表明LINC00675可能與miRNA結合(P<0.001),見圖3A。通過使用生物信息網站LncBase Predicted v.2 DIANA工具,我們發(fā)現mircoRNA miR-655是LINC00675的潛在靶基因,結合位點見圖3B。之后我們進行了RNA pull-down實驗,結果顯示相比于陰性對照組(Bio-NC探針),miR-655大量聚集于Bio-LINC00675探針(P<0.001),見圖3C。雙熒光素酶報告基因實驗結果顯示在293T工具細胞以及肝癌HepG3細胞中,WT組LINC00675能夠與miR-665結合(P<0.01),見圖3D和E。我們對LINC00675是否影響miR-665的表達進行了探究,在HepG3和Huh7細胞中過表達LINC00675(OE-LINC)顯著降低了miR-665的表達(P<0.001),見圖3F。
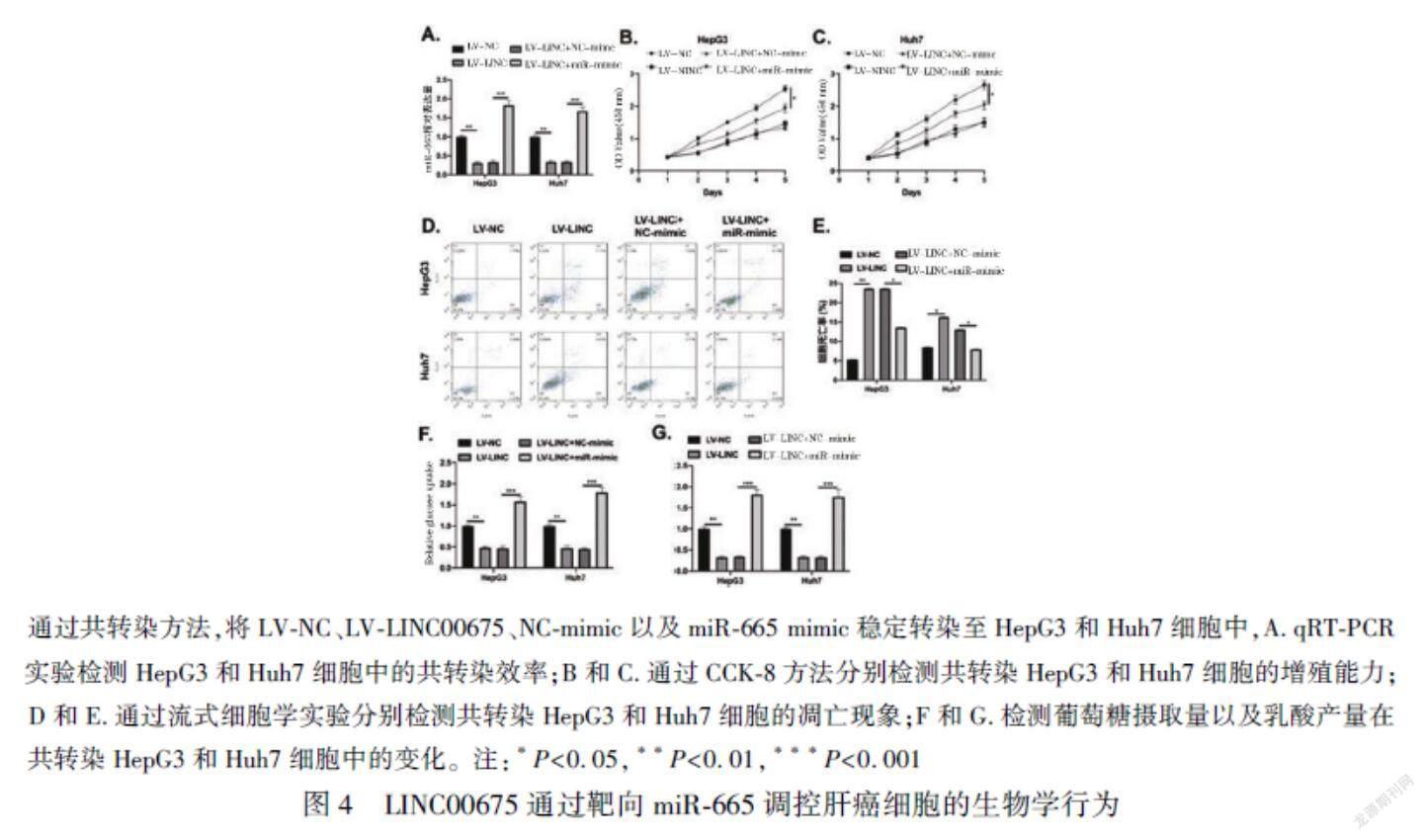
2.4 LINC00675通過靶向miR-665調控肝癌細胞的生物學行為
為了探究miR-665是否參與了LINC00675調控肝癌細胞增殖和凋亡的過程,我們進行了共轉染實驗,并對轉染效率進行了檢測,見圖4A。CCK-8實驗結果顯示,過表達miR-665減輕了LINC00675過表達對肝癌細胞HepG3和Huh7增殖能力的抑制作用(P<0.05),見圖4B和C;過表達miR-665后, LINC00675過表達的肝癌細胞HepG3和Huh7的凋亡現象也發(fā)生了減弱(P<0.05),見圖4D和E。此外,miR-665過表達反轉了LINC00675過表達對于肝癌細胞Warburg效應的抑制作用(P<0.01),見圖4F和G。
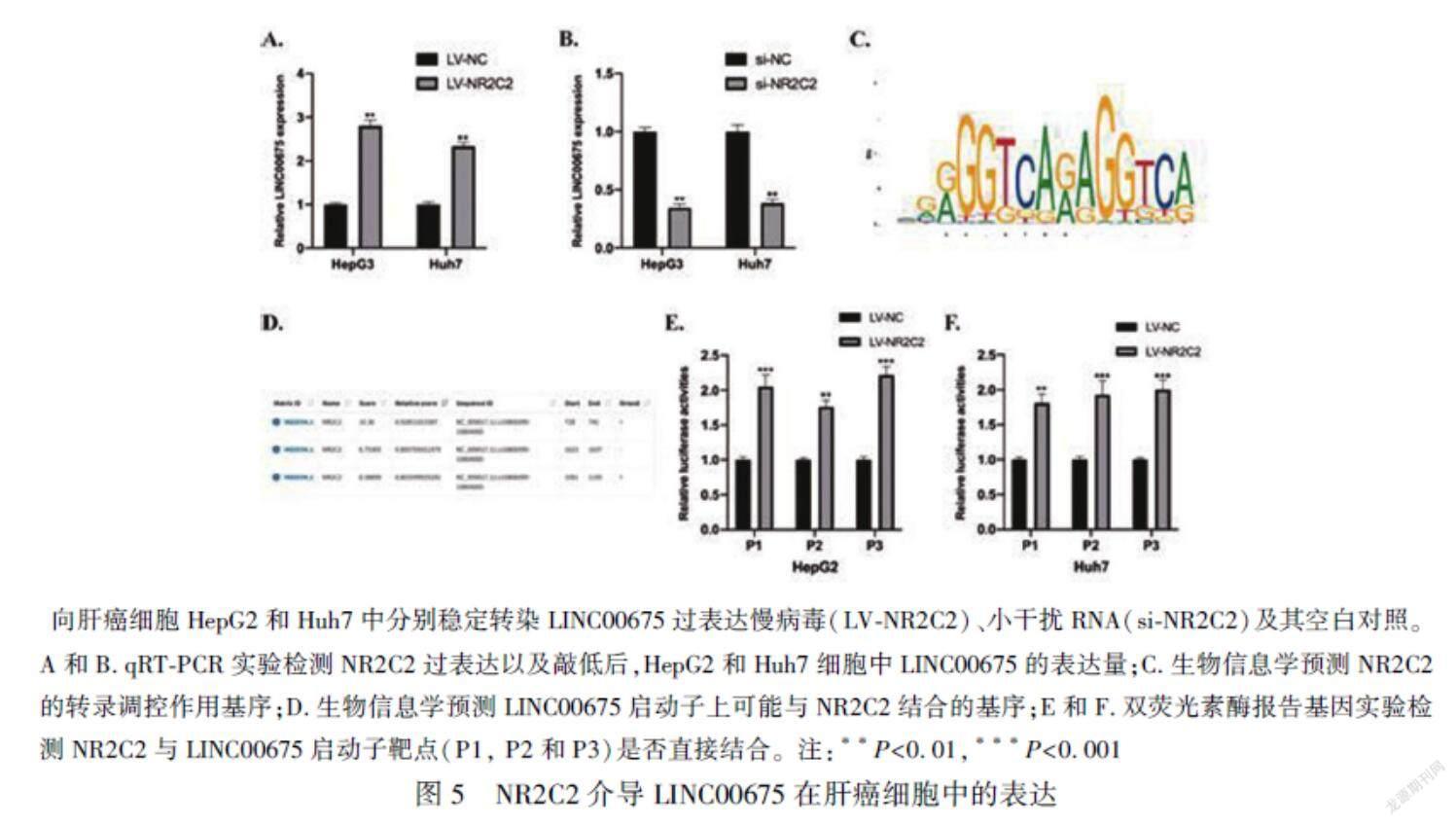
2.5 NR2C2介導LINC00675在肝癌細胞中的表達
通過以上實驗結果,我們探究了LINC00675在肝癌細胞中的生物學功能及其下游的分子機制。然而LINC00675的上游分子機制仍不清楚,我們通過使用JASPAR(http://jaspar.genereg.net/)數據庫預測LINC00675的上游轉錄因子,發(fā)現核受體亞家族2 C組成員2(Nuclear Receptor Subfamily 2 Group C Member 2,NR2C2)蛋白可能調控LINC00675啟動子轉錄。我們構建了NR2C2的穩(wěn)定過表達以及敲低細胞模型,qRT-PCR實驗結果顯示LINC00675在肝癌細胞中的表達被NR2C2正向調控(P<0.01),見圖5A和B。NR2C2在LINC00675啟動子上的靶基序列以及可能靶向的LINC00675啟動子序列在JASPAR數據庫上獲得,見圖5C和D。此外,雙熒光素酶報告基因實驗結果顯示數據庫所預測的LINC00675啟動子上的三個靶標(P1、P2和P3)都可以與NR2C2結合(P<0.01),見圖E和F。
3 討 論
本研究首先發(fā)現了LINC00675在肝癌組織以及多種肝癌細胞系中的低表達,且發(fā)現LINC00675主要表達于肝癌細胞的細胞質中,這些結果表明,LINC00675可能參與調控了肝癌細胞生物學行為。之后,我們通過使用肝癌細胞HepG3和Huh7構建LINC00675穩(wěn)定過表達的細胞模型,并進行了功能學檢測,發(fā)現HepG3和Huh7細胞在過表達LINC00675之后,其細胞增殖能力以及細胞中的Warburg效應明顯減弱,而細胞凋亡現象明顯增強。LINC00675在多種惡性腫瘤中也被發(fā)現表達失調,并參與調控了細胞的增殖、遷移、侵襲,以及腫瘤轉移的過程,且其在腫瘤組織內的表達量與病人預后密切相關[15~18]。本實驗結果顯示LINC00675參與調控了肝癌細胞的生物學功能,并首次發(fā)現LINC00675參與調控了肝癌細胞Warburg效應。
miR-665已被報道通過靶向PTPRB后降低Hippo信號通路的蛋白表達,從而促進肝癌細胞的增殖、遷移和侵襲[19]。外泌體miR-665在肝癌病人體內的表達水平被證實可以作為獨立的診斷和預后因素[20]。此外,miR-665作為環(huán)狀RNA circABCC2的下游靶分子,調控肝癌細胞的增殖、侵襲和凋亡[21]。以上研究顯示,miR-665分別通過自身表達量改變,外泌體形態(tài),以及作為環(huán)狀RNA的靶基因參與了肝癌細胞的生物學行為調控,表明miR-665在肝癌發(fā)生發(fā)展過程中的重要作用。本研究首先通過AGO2 免疫共沉淀實驗評估了LINC00675與miRNA的結合能力,之后運用生物信息數據庫預測LINC00675的miRNA靶基因,在RNA pull-down以及雙熒光素酶報告基因實驗證實LINC00675靶向結合miR-665。通過功能學實驗驗證,本研究發(fā)現LINC00675通過靶向結合miR-665,并負向調控miR-665的表達,調控了肝癌細胞的增殖和凋亡。此外,本研究結果表明LINC00675在肝癌細胞中的表達可被NR2C2轉錄調控。
本研究部分闡述了LINC00675在肝癌發(fā)生發(fā)展過程中的生物學功能以及上游及下游的直接分子機制。然而,LINC00675的臨床意義以及表達特征仍需足夠數量的肝癌樣本進行深入分析。此外下游的蛋白機制及分子通路仍待進一步探索研究,進而更加明確地闡述在肝癌發(fā)生發(fā)展過程中LINC00675發(fā)揮生物學功能背后的具體分子機制。
綜上所述,本研究發(fā)現LINC00675在肝癌細胞中普遍低表達,NR2C2誘導的LINC00675通過靶向結合miR-665調控了肝癌細胞的生物學行為,根據以上實驗結果推測LINC00675可能作為肝癌診斷以及治療研究的新靶點,并為肝癌的分子治療研究提供新的策略。
參 考 文 獻
[1] KANWAL F,SINGAL A G.Surveillance for hepatocellular carcinoma:current best practice and future direction[J].Gastroenterology,2019,157(1):54-64.
[2] CHEN W,ZHENG R,BAADE P D,et al.Cancer statistics in China,2015[J].CA Cancer J Clin,2016,66(2):115-132.
[3] 樊嘉,周儉,吳志全,等.原發(fā)性肝癌的外科治療:20年7566例的臨床經驗[J].中華消化外科雜志,2009,8(2): 99-102.
[4] RATCLIFFE L T,LUKEY P T,MEYERS O L,et al.Prostanoid modulation of synovial antigen-specific CD4+T-cell cytotoxic function in rheumatoid arthritis[J].Br J Rheumatol,1995,34(2):113-120.
[5] STATELLO L,GUO C J,CHEN L L,et al.Gene regulation by long non-coding RNAs and its biological functions[J].Nat Rev Mol Cell Biol,2021,22(2):96-118.
[6] LV E,SHENG J,YU C,et al.LncRNA influence sequential steps of hepatocellular carcinoma metastasis[J].Biomed Pharmacother,2021,136:111224.
[7] YANG Z,JIANG S,SHANG J,et al.LncRNA:shedding light on mechanisms and opportunities in fibrosis and aging[J].Ageing Res Rev,2019,52:17-31.
[8] TAN Y T,LIN J F,LI T,et al.LncRNA-mediated posttranslational modifications and reprogramming of energy metabolism in cancer[J].Cancer Commun:Lond,2021,41(2):109-120.
[9] QUINN J J,CHANG H Y.Unique features of long non-coding RNA biogenesis and function[J].Nat Rev Genet,2016,17(1):47-62.
[10] SHENG J,HE X,YU W,et al.p53-targeted lncRNA ST7-AS1 acts as a tumour suppressor by interacting with PTBP1 to suppress the Wnt/β-catenin signalling pathway in glioma[J].Cancer Lett,2021,503:54-68.
[11] ZHANG Y,HUANG Y X,WANG D L,et al.LncRNA DSCAM-AS1 interacts with YBX1 to promote cancer progression by forming a positive feedback loop that activates FOXA1 transcription network[J].Theranostics,2020,10(23):10823-10837.
[12] MA S Y,DENG X H,YANG Y,et al.The lncRNA LINC00675 regulates cell proliferation,migration,and invasion by affecting Wnt/β-catenin signaling in cervical cancer[J].Biomed Pharmacother,2018,108:1686-1693.
[13] GIULIETTI M,RIGHETTI A,PRINCIPATO G,et al.LncRNA co-expression network analysis reveals novel biomarkers for pancreatic cancer[J].Carcinogenesis,2018,39(8):1016-1025.
[14] ZENG S,XIE X,XIAO Y F,et al.Long noncoding RNA LINC00675 enhances phosphorylation of vimentin on Ser83 to suppress gastric cancer progression[J].Cancer Lett,2018,412:179-187.
[15] ZHU L,LIU X L,FU Z Q,et al.LINC00675 suppresses proliferative,migration and invasion of clear cell renal cell carcinoma via the Wnt/β-catenin pathway[J].Eur Rev Med Pharmacol Sci,2020,24(5):2313-2320
[16] LIU X,KE J,GU L,et al.Long non-coding RNA LINC00675 is associated with bladder cancer metastasis and patient survival[J].J Gene Med,2020,22(9):e3210.
[17] YAO M,SHI X,LI Y,et al.LINC00675 activates androgen receptor axis signaling pathway to promote castration-resistant prostate cancer progression[J].Cell Death Dis,2020,11(8):638.
[18] PAN Y,FANG Y,XIE M,et al.LINC00675 suppresses cell proliferation and migration via downregulating the H3K4me2 level at the SPRY4 promoter in gastric cancer[J].Mol Ther Nucleic Acids,2020,22:766-778.
[19] HU Y,YANG C,YANG S,et al.miR-665 promotes hepatocellular carcinoma cell migration,invasion,and proliferation by decreasing Hippo signaling through targeting PTPRB[J].Cell Death Dis,2018,9(10):954.
[20] QU Z,WU J,WU J,et al.Exosomal miR-665 as a novel minimally invasive biomarker for hepatocellular carcinoma diagnosis and prognosis[J].Oncotarget,2017,8(46):80666-80678.
[21] BAI N,PENG E,XIA F,et al.CircABCC2 regulates hepatocellular cancer progression by decoying MiR-665[J].J Cancer,2019,10(17):3893-3898.
(收稿日期:2021-08-27 修回日期:2021-11-03)
(編輯:潘明志)

