LncRNA ROR 和TGF-β1 在乳腺癌患者中的表達及臨床意義
張玉娟 葉惠榮 袁惠玲 王永霞
廣東省東莞市人民醫院乳腺科,廣東東莞 523000
不同分子標記的乳腺癌亞型對治療的反應和預后均存在較大差異,如何早期診斷和預測預后是乳腺癌研究的熱點問題[1-2]。長鏈非編碼RNA(long noncoding RNA,LncRNA)是長度大于200 個核苷酸的RNA 分子,具有結合靶基因啟動子區調控基因轉錄、介導染色質重構及結合mRNA 抑制翻譯過程等生物學作用[3-5]。LncRNA 參與包括癌變在內的多種疾病狀態,在肺癌、肝癌、胃癌、乳腺癌等惡性腫瘤中異常表達,與惡性腫瘤發生發展密切相關[6-8]。長鏈非編碼RNA ROR(long noncoding RNA ROR,LncRNA ROR)是新近發現的LncRNA 分子,具有調節多能干細胞自我更新和分化的功能,子宮內膜癌、肝癌等多種腫瘤中發現LncRNA ROR 表達異常[9]。基礎研究顯示,LncRNA ROR/轉化生長因子-β1(transforming growth factor-β1,TGF-β1)途徑激活促進裸鼠乳腺癌細胞增殖和侵襲[10]。研究顯示,膀胱癌等腫瘤LncRNA ROR和TGF-β1 水平與血清表達均呈明顯正相關,血清LncRNA ROR 和TGF-β1 的價值逐漸引起臨床醫師重視,但血清LncRNA ROR 和TGF-β1 水平與乳腺癌病理特征及預后因素的相關性鮮見報道[11]。本研究通過分析乳腺癌和健康女性血清LncRNA ROR與TGF-β1水平,分析兩種標志物與乳腺癌病理特征的關系。
1 資料與方法
1.1 一般資料
選擇2018 年1 月至2019 年6 月在廣東省東莞市人民醫院(以下簡稱“我院”)經病理學確診的73 例乳腺癌患者作為研究組(A 組),其中中高分化47 例,低分化26 例;Ⅰ期24 例,Ⅱ期23 例,Ⅲ期26 例;淋巴結轉移37 例,無淋巴結轉移36 例;表型:人表皮生長因子受體-2(human epidermal growth factor receptor-2,HER-2)陽性14 例,三陰性18 例,Luminal 41 例。納入標準:①經病理或組織學檢查確診為乳腺癌;②年齡≥20 歲,初次確診為乳腺癌,血清LncRNA ROR 和TGF-β1 檢查前未接受放療、化療、免疫治療等抗腫瘤治療;③患者對本研究知情并簽署知情同意書。排除標準:①合并嚴重心肝腎等功能不全;②合并其他部位原發性惡性腫瘤;③合并自身免疫性或急慢性傳染病;④妊娠或哺乳期婦女;⑤精神疾病或嚴重認知功能障礙。隨機抽取同期在我院就診的經病理證實的37 例乳腺良性病變(包括乳腺腺病21 例,乳腺纖維腺瘤8 例,乳腺導管內乳頭狀瘤8 例)為對照1 組(B 組),隨機抽取同期健康體檢的37 名健康受試者作為對照2 組(C 組)。A、B、C 組受試者一般資料比較,差異無統計學意義(P >0.05),具有可比性。見表1。

表1 三組一般資料比較
1.2 研究方法
受試者入組后抽取空腹靜脈血,采用實時熒光定量逆轉錄聚合酶鏈反應(real time fluorescence quantitative reverse transcription polymerase chain reaction,qRT-PCR)法檢測血清LncRNA ROR 水平,首先采用Triol 法(試劑盒購自Biosharp 公司,貨號:20180911)提取血漿中總RNA,鑒別濃度和純度后,以1 μg RNA為模板反轉錄為互補DNA(complementary deoxyribonu cleic acid,cDNA),嚴格按照TaKaRa 反轉錄試劑盒(購自紅榮微再上海生物工程技術有限公司,貨號:20180821)說明實施。qRT-PCR 反應體系為cDNA 0.2 μl,2×SYBR 5 μl,ROXⅡ0.2 μl,正反向引物各0.5 μl,RNA-free 水3.6 μl,總反應體系體積10 μl。反應條件為95℃預變性5 min、95℃變性30 s、62℃退火30 s、70℃延伸30 s,共40 個循環。以甘油醛-3-磷酸脫氫酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)為內參,采用2-ΔΔCt法對檢測結果進行定量分析。ROR 的正向引物序列:5’-CTCCAGCTATGCAGACCACTC-3’,反向引物:5’-GTGACGCCTGACCTGTTGAC-3’;GAPDH 的正向引物序列:5’-AATGGACAACTGGTCGTGGAC-3’,反向引物:5’-CCCTCCAGGGGATCTGTTTG-3’。采用酶聯免疫吸附試驗檢測血清TGF-β1 水平,采用電化學發光法測定受試者腫瘤標志物水平,腫瘤標志物包括糖類抗原153(carbohy drate antigen 153,CA153)和癌胚抗原(carcinoembry onic antigen,CEA),試劑盒購自武漢伊萊瑞特生物科技股份有限公司,貨號:20181016(TGF-β1)、20180721(CA153)和20181204(CEA),嚴格按照說明書操作,正常參考值范圍:CEA≤5 ng/L,CA153 ≤25 U/ml。
1.3 觀察指標
觀察三組受試者血清LncRNA ROR 和TGF-β1水平和LncRNA ROR與TGF-β1 診斷乳腺癌的臨床價值;觀察A 組年齡(≤50 歲、>50 歲)、病理學分級(中、高分化,低分化)、臨床分期(Ⅰ、Ⅱ、Ⅲ期)、淋巴結轉移(是、否)、表型(HER-2、三陰性、Luminal)等不同預后因素患者LncRNA ROR 和TGF-β1 水平的差別。
1.4 統計學方法
采用SPSS 23.0 軟件對所得數據進行統計學分析,計量資料采用均數±標準差()表示,比較采用t檢驗;多組間比較采用單因素方差分析,進一步兩兩比較采用LSD-t 法,計數資料采用例數或百分率表示,比較采用χ2檢驗。相關性分析采用Spearman 相關分析,采用受試者工作特征曲線(receiver operator characteristic curve,ROC 曲線)計算LncRNA-ROR 和TGF-β1 預測乳腺癌的價值,曲線下面積(area under the curve,AUC)比較采用Z 檢驗。以P <0.05 為差異有統計學意義。
2 結果
2.1 三組受試者LncRNA ROR 和TGF-β1 水平比較
A 組LncRNA ROR 和TGF-β1 水平高于B 組和C 組,差異有統計學意義(P <0.05);B 組和C 組LncRNA ROR 和TGF-β1 水平比較,差異無統計學意義(P >0.05)。見表2。
表2 三組受試者LncRNA ROR 和TGF-β1 水平比較()

表2 三組受試者LncRNA ROR 和TGF-β1 水平比較()
注與B 組比較,aP <0.05;與C 組比較,bP <0.05。LncRNA ROR:長鏈非編碼RNA ROR;TGF-β1:轉化生長因子-β1
2.2 LncRNA ROR與TGF-β1 的相關性
Spearman 相關性分析顯示,LncRNA ROR與TGFβ1 呈正相關(r=0.897,P <0.05)。
2.3 三組受試者腫瘤標志物水平比較
A 組CA153、CEA 水平高于B 組和C 組,差異有統計學意義(P <0.05);B 組CA153 和CEA 水平高于C 組,差異有統計學意義(P <0.05)。見表3。
表3 受試者腫瘤標志物水平比較()
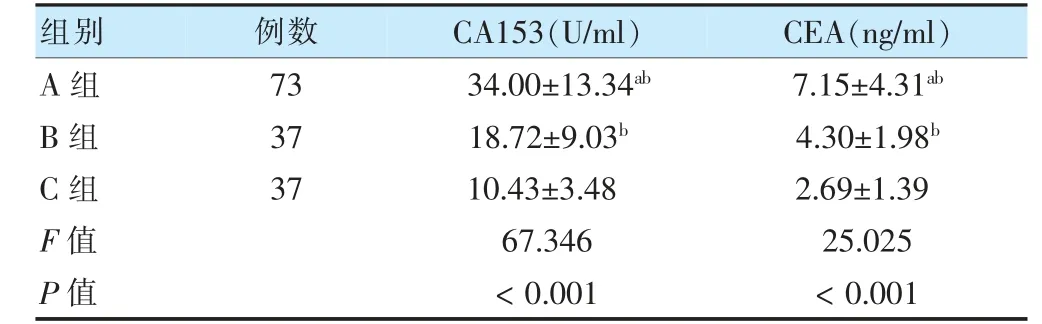
表3 受試者腫瘤標志物水平比較()
注與B 組比較,aP <0.05;與C 組比較,bP <0.05。CA153:糖類抗原153;CEA:癌胚抗原
2.4 不同指標預測乳腺癌的臨床價值比較
LncRNA ROR 和TGF-β1 預測乳腺癌的AUC 比較,差異無統計學意義(Z=0.536,P=0.592),LncRNA ROR 預測乳腺癌的AUC 高于CA153 和CEA,差異有統計學意義(Z=3.158、3.152,P=0.002、0.000);TGF-β1預測乳腺癌的AUC 高于CA153 和CEA,差異有統計學意義(Z=2.372、2.594,P=0.018、0.010)。見表4、圖1A。以表4 中截斷值作為判定陽性依據,LncRNA ROR:陽性>1.45,陰性:≤1.45;TGF-β1 陽性:>17.84 μg/ml,陰性:≤17.84 μg/ml。LncRNAROR 和TGF-β1 均陽性預測乳腺癌的特異性為98.65%,高于二者單一預測的特異性值;LncRNA ROR 陽性或TGF-β1 陽性預測乳腺癌的靈敏度為100%,高于二者單一預測的靈敏度值。見表4、圖1B。
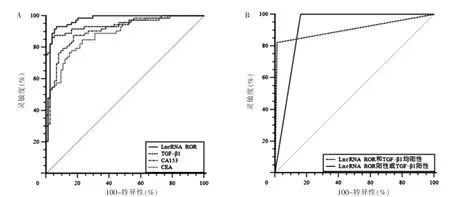
圖1 不同指標預測乳腺癌的ROC 曲線
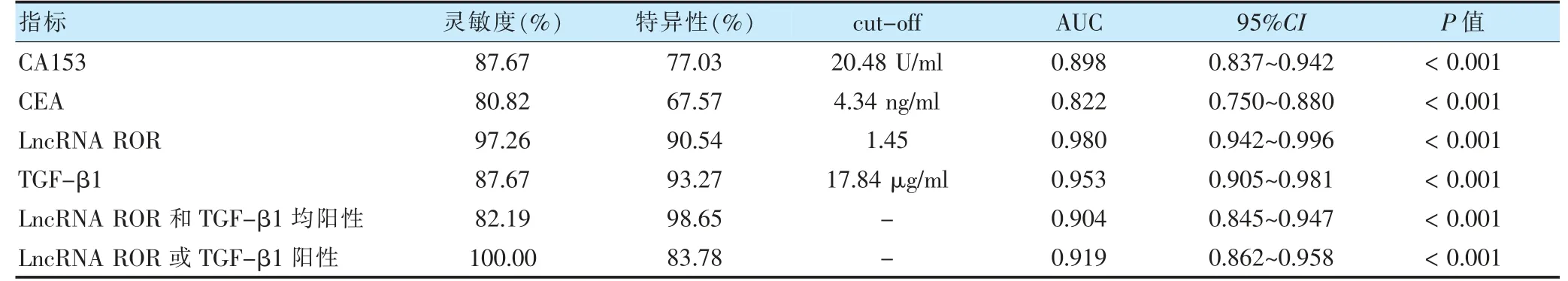
表4 不同指標預測乳腺癌的臨床價值比較
2.5 乳腺癌患者不同臨床特征LncRNA ROR 和TGFβ1 表達水平比較
不同年齡、分化程度、表型乳腺癌患者血清LncRNA ROR 和TGF-β1 水平比較,差異無統計學意義(P >0.05);不同臨床腫瘤分期乳腺癌患者LncRNA ROR 和TGF-β1 水平比較,差異有統計學意義(P <0.05);淋巴結轉移乳腺癌患者血清LncRNA ROR 和TGF-β1水平均高于無淋巴結轉移患者,差異有統計學意義(P <0.05)。見表5。
表5 乳腺癌患者不同臨床特征LncRNA ROR和TGF-β1 表達水平比較()

表5 乳腺癌患者不同臨床特征LncRNA ROR和TGF-β1 表達水平比較()
注 LncRNA ROR:長鏈非編碼RNA ROR;TGF-β1:轉化生長因子-β1;HER-2:人表皮生長因子受體-2
3 討論
多項研究[12-14]顯示,LncRNA 通過與轉錄因子、染色質修飾因子或核不均一核糖核蛋白結合調節基因表達,部分LncRNA 介導的功能破壞失調在腫瘤發生發展中發揮關鍵作用,LncRNA 在腫瘤患者診斷和預后評估方面具有潛在應用價值。LncRNA ROR 長2591 nts,又稱為LincRNA-ST8SIA3,位于18q21.31,是p53 對DNA 損傷反應的強負性調節因子,其過度表達可導致miRNA與相應基因之間的負調控,與上皮細胞-間充質轉化(epithelial-mesenchymal transition,EMT)、腫瘤生長、轉移、侵襲和化療耐藥相關[15]。
近年來的研究[16-21]顯示,LncRNA ROR與胃癌、膽囊癌、非小細胞肺癌、肝細胞癌、胰腺導管腺癌等多種癌癥發生相關,上述腫瘤組織和LncRNA ROR 表達高于正常組織,LncRNA ROR 表達升高的程度與腫瘤細胞侵襲、遷移和增殖呈正相關,但其影響腫瘤細胞生長、增殖、侵襲等生物學行為的機制尚未完全闡明。對乳腺癌來說,細胞侵襲和轉移是導致預后較差、病死率高的重要原因,而EMT 是這個過程的重要環節[22]。LncRNA ROR 是EMT 的重要陽性調節因子,體外研究顯示,LncRNA ROR 上調促進乳腺癌細胞的遷移和侵襲,體內研究則可促進免疫缺陷小鼠的腫瘤轉移[23]。TGF-β1 是誘導EMT 的重要誘導因子,可通過特異性識別下游細胞信使因子Smad2/3,使其磷酸化并與Smad4 形成寡聚體,并在細胞核內與基因啟動子結合,促使靶基因轉錄[24]。研究顯示,TGF-β1 可通過誘導EMT 促進包括乳腺癌在內的多種腫瘤轉移,在多種腫瘤組織中呈高表達[25]。Hou 等[26]研究顯示,LncRNA ROR 過度表達可通過影響TGF-β1 信號通路活性促進乳腺癌細胞增殖、侵襲及裸鼠腫瘤生長。本研究結果顯示,在乳腺癌患血清中表現為LncRNA ROR 和TGF-β1 異常高表達,與Hou 等[26]研究中LncRNA ROR 和TGF-β1 的研究結果一致。本研究結果顯示LncRNA ROR 和TGF-β1 預測乳腺癌的AUC 高于CA153 和CEA,提示LncRNA ROR 和TGF-β1 可能是乳腺癌潛在的生物標志物,鑒于本研究病例數有限,LncRNA ROR 和TGF-β1 和傳統腫瘤標志物CA153和CEA 預測乳腺癌的臨床價值差異尚需要進一步納入更多病例進行論證。二者聯合檢測的結果顯示,LncRNA ROR 和TGF-β1 均陽性作為預測因子,可提高特異性,有助于減少假陽性率,LncRNA ROR 和TGF-β1 之一陽性作為預測因子,可提高靈敏度,有助于減少假陰性率,結果提示,LncRNA ROR 和TGF-β1可能是乳腺癌潛在的生物標志物,二者不同聯合方式有助于乳腺癌的確診和排除。
臨床研究[27]顯示,TGF-β1與乳腺癌患者腫瘤分期相關,臨床分期Ⅲ期和淋巴結轉移的乳腺癌組織中TGF-β1 水平顯著升高。本研究結果同樣顯示,不同臨床腫瘤分期增加和是否淋巴結轉移的乳腺癌患者之間LncRNA ROR 和TGF-β1 比較,差異有統計學意義(P <0.05),這與既往研究[27]中TGF-β1 促進乳腺癌發展及淋巴結轉移的研究一致。本研究結果顯示,患者血清LncRNA ROR 和TGF-β1 表達與患者年齡、腫瘤分化程度等無關,與既往研究一致。HER2 是一種185 kD 的糖蛋白,20%~30%初診浸潤性乳腺癌顯示HER2 陽性[28-29]。Merry 等[30]曾用HER2陽性乳腺癌細胞體外培養研究LncRNA與HER2 陽性乳腺癌之間的關系,該研究發現僅三種LncRNA(linc-STARD6-2、linc-GJA1-2 和linc-SLC39A10-10)表達與HER2 表達相關,不包括LncRNA ROR。Luo 等[31]曾對乳腺癌不同表現LncRNA 功能多態性進行研究,結果顯示,LncRNA 功能多態性與雌激素受體、HER-2表達不存在相關性。本研究未觀察到LncRNA ROR 和TGF-β1與乳腺癌表現型的相關性,與既往研究一致。
綜上所述,本研究結果顯示,血清LncRNA ROR和TGF-β1 可能是乳腺癌潛在的生物標志物,患者血清LncRNA ROR 和TGF-β1 表達與臨床腫瘤分期和淋巴結轉移相關,對預后判定具有一定參考價值。

