光照強度對條斑紫菜貝殼絲狀體培養的影響
尚浩江, 周 偉, 胡傳明, 申 欣, 朱朋昌, 李 帥
光照強度對條斑紫菜貝殼絲狀體培養的影響
尚浩江1, 周 偉2, 胡傳明2, 申 欣1, 朱朋昌1, 李 帥3
(1. 江蘇海洋大學 江蘇省海洋生物技術重點實驗室, 江蘇 連云港 222000; 2. 江蘇省海洋水產研究所, 江蘇 南通, 226007; 3. 上海海洋大學, 上海 201306)
光照與溫度對條斑紫菜()貝殼絲狀體生長發育與殼孢子放散水平均具有重要影響。因溫度對光強的協同效應以及各培養階段對光強的需求不同, 本文僅改變培養光強, 研究了不同光照強度對條斑紫菜貝殼絲狀體著生、生長、發育及殼孢子放散的影響, 為育苗階段光照強度管理提供數據支撐。在16 ℃下采用1.3~25.0 μmol/(m2·s) 5個光照強度梯度, 接種條斑紫菜Y-9101絲狀體于文蛤殼并培養至殼孢子放散, 利用光學與電子顯微鏡、色差計與葉綠素熒光儀等, 測量絲狀體的著生效率、水平生長速率、縱向生長率、色度值、光合活性及殼孢子放散量。結果顯示, 貝殼絲狀體著生效率與水平生長速率均呈現先上升后下降趨勢, 其中18.8 μmol/(m2·s)下著生效率最高, 達到5.6%, 6.3 μmol/(m2·s)下水平生長速率最大, 達到86.6 μm/d, 縱向生長速率隨光強增加而增加。6.3~18.8 μmol/(m2·s)下貝殼絲狀體最終生長深度趨于一致、藻斑顏色均為黑色, 且殼孢子放散總量高于其他處理組。25.0 μmol/(m2·s)下貝殼絲狀體藻斑顏色偏淺黃, 且殼孢子放散量較低, 其最大光化學量子效率低于6.3~18.8 μmol/(m2·s)處理組, 呈現光能利用效率下降的趨勢。綜上所述, 6.3~18.8 μmol/(m2·s)為條斑紫菜貝殼絲狀體生長的適宜光照強度。
光照強度; 條斑紫菜(); 貝殼絲狀體; 光合活性; 生長速率
條斑紫菜()屬紅藻門(Rhodophyta), 紅藻綱(Rhodophyceae), 紅毛菜科(Bangiaceae),屬[1], 主要分布于中國浙江舟山群島以北的東海北部和黃、渤海沿岸、包括日本列島和朝鮮半島沿岸等, 是日本、韓國和中國長江以北紫菜人工栽培紫菜的主要種類[2]。2019—2020年條斑紫菜育苗面積102×104m2, 栽培面積達4.67× 108m2, 行業年總產量達2×1011元左右(江蘇省紫菜協會2020年數據)。在條斑紫菜貝殼絲狀體的人工培育過程中, 光照強度的調節對絲狀體的生長發育與殼孢子放散起到重要作用, 光照強度過低藻體生長緩慢, 過高則會抑制藻體的光合作用和生長速率[3]。條斑紫菜的配子體世代為葉狀體, 孢子體世代為絲狀體[4], 自然環境下條斑紫菜的孢子體生長在水下貝殼基質中, 所接受的光照強度較低; 而其配子體生長在潮間帶的巖石上, 當潮水退卻后就暴露在高光強的生境中。有研究表明, 紫菜配子體階段過多的激發能可以在PS II與PS I間協調分配, 而在孢子體階段, 這種協調關系不明顯[5], 這可能是紫菜孢子體耐受光強低于配子體的原因之一。
貝殼絲狀體的培養光源和培養方式各不相同, 報道的適宜光強也有較大差異。尾形英二等[6]研究表明2 000 Lx的自然光是貝殼絲狀體生長的合適光強;鄭寶福等[7]研究顯示貝殼絲狀體在1 500~6 000 Lx自然光范圍內均可較好地生長; 張學成等[8]報道在21 ℃~23 ℃, 14L︰10D光周期的熒光燈條件下, 10~ 200 μmol/m2/s是貝殼絲狀體生長的合適光強; 許璞[9]報道2 500~3 000 Lx自然光為適合貝殼絲狀體生長的光強; 呂峰等[10]研究表明在18 ℃, 14L︰10D光周期的熒光燈條件下, 10 μmol/(m2·s)是貝殼絲狀體生長的適宜光強; 朱建一等[4]報道, 3 000 Lx自然光是貝殼絲狀體的適宜光強。上述研究的差異易造成種苗生產中光照條件的管理混亂, 因此有必要針對條斑紫菜種苗不同階段的適宜光強開展進一步研究, 為條斑紫菜種苗生產中的光照控制理論提供依據, 對條斑紫菜育苗有著指導性意義。
1 材料與方法
1.1 實驗材料
供試條斑紫菜自由絲狀體取自國家級紫菜種質推廣品系Y-9101品系, 接種貝殼為文蛤殼。
1.2 實驗器材
丙林MGZ-120B-3光照培養箱、Nikon-E800生物顯微鏡、JSM-6510掃描電鏡、WALZ-UKEA0388葉綠素熒光儀PAM、遠方SFIM-300光譜閃爍照度計、攪拌機、柯尼卡CM-700D色差計等。
1.3 實驗方法
1.3.1 絲狀體接種與培養
將Y-9101條斑紫菜自由絲狀體打碎成40~60 μm小段, 接種于放置15枚規格一致的文蛤殼的培養盒內, 接種密度為150 個/cm2, 照度計放入培養盒內測量光照值, 設置1.3±1.0、6.3±1.0、12.5±1.0、18.8± 1.0和25±1.0 μmol/(m2·s)5個梯度的光照強度, 培養光源為擬全光譜熒光燈(圖1), 培養溫度16 ℃, 海水鹽度27‰, 光照周期12D︰12L, 另設一個自然環境對照組(光照強度在1.3~(12.5±1) μmol/(m2·s)之間, 溫度與光周期隨南通市環境變化而變化)。
圖1 培養光源相對光譜曲線
1.3.2 著生密度與效率的測量
接種后每周觀察絲狀體著生情況, 接種6周后肉眼觀察, 計數貝殼上的藻斑數量, 計算著生密度(著生密度=藻斑數/貝殼面積), 從而計算出著生效率(著生密度/接種密度, %)。
1.3.3 水平生長面積與縱向生長長度的測定
接種2周起測量貝殼絲狀體的藻斑直徑(藻斑近似圓形), 至藻斑生長交連到一起時停止測量。分別于第55 d與第100 d將貝殼壓碎后, 每組隨機選取30個藻斑縱切面采用掃描電鏡測量縱向生長長度。
1.3.4 光合活性及色度值測定
1.3.4.1 色度值測定
接種50 d后, 采用柯尼卡CM-700D色差計測量藻斑色度值。測量采用?3 mm的目標罩, 選擇10°角標準觀察者(CIE1964), 光源為D65標準光源, 采用SCI模式(包含鏡面反射光), 測得*、*、*值,*值表示明度, 范圍在0(黑)~100(白), 值越大, 色越亮;*值表示綠色值/紅色值, 正值為紅色;*值表示藍色/黃色值, 正值為黃色。
1.3.4.2 最大量子效率測定
樣品在測試前暗處理2 h, 將光纖探頭直接置于貝殼表面進行測定。先打開測量光(約0.3 μmol/ (m2·s)), 測得最小熒光值(Fo), 隨后提供0.88 s約4 000 μmol/(m2·s)飽和脈沖光, 測得最大熒光值(Fm), 最大量子效率(Fv/Fm)計算公式: Fv/Fm=(Fm–Fo)/ Fm, Fv為可變熒光。
1.3.5 貝殼絲狀體殼孢子放散測量
將接種120 d的貝殼每組取4枚清洗干凈, 放入裝有50 mL海水的燒杯中, 在(31.3±1) μmol/(m2·s)光強, 12L︰12D的光照培養箱內培養2周, 誘導殼孢子放散。培養2周后, 連續20 d每天下午14: 00測定各光強組殼孢子放散量[11]。放散期培養溫度為16 ℃, 光照條件為7: 00—12: 30光強(31.3±1) μmol/(m2·s), 12: 30—18: 30光強(6.3±1) μmol/(m2·s), 18: 30~次日7: 00黑暗條件。計數后清洗貝殼表面, 更換培養海水。
1.3.6 實驗數據處理
各組實驗數據采用GraphPad Prism 7(GraphPad Software Inc., 美國)進行處理。數據顯著性分析采用SPSS 22(IBM, 美國)進行單因素方差分析, 設置顯著水平<0.05。
2 結果
2.1 光強對條斑紫菜貝殼絲狀體著生的影響
通過掃描電鏡及光學顯微鏡觀察, 絲狀體藻段接種貝殼基質后, 先將一端粘附在基質表面, 然后從粘附的一端鉆入基質中, 鉆入方式由接觸基質的方式決定, 因此被絲狀體著生的貝殼表面出現圓形、橢圓形以及不規則的孔洞(圖2a)。貝殼絲狀體形態與自由絲狀體差異較大, 主分枝多于2條, 向四周輻射生長, 側枝多呈對生, 且多出現不定形隆起(圖2 b、2c), 縱向主要生長于珍珠層內, 有少量藻絲深入棱柱層(圖2d)。

圖2 貝殼絲狀體著生于貝殼表面與切面圖
a.絲狀體鉆入貝殼后貝殼表面電鏡照片, 標尺=10 μm; b. 貝殼絲狀體橫向顯微照片, 標尺=50 μm; c. 孢子囊枝階段貝殼的縱切面, 標尺=50 μm; d. 絲狀藻絲階段貝殼縱切面, 標尺=50 μm
a. SEM photograph of the shell surface after conchocelis drilling into the shell, scale bar=10 μm; b. Micrographic section of the conchocelis, scale bar=50 μm; c. SEM photograph of the longitudinal sections of the shell under the sporangial branchlets stage, scale bar=50 μm; d. SEM photograph of the longitudinal sections of the shell under the vegetative stage, scale bar=50 μm
不同實驗組均采用相同接種密度, 通過測量著生密度計算與分析不同光強下貝殼絲狀體的著生效率。結果顯示, 18.8 μmol/(m2·s)光照強度下絲狀體著生效率最大, 為(5.6±1)%, 著生密度達(8.4±1.55)個/cm2, 其次為12.5、6.3、25 μmol/(m2·s), 著生效率平均為6.1 個/cm2, 1.3 μmol/(m2·s)下著生效率最低, 為(1.1± 0.9)%(圖3)。
2.2 光強對貝殼絲狀體立體分布的影響
通過對貝殼絲狀體水平和縱向生長的連續觀測, 分析光強對貝殼絲狀體在貝殼中不同發育時期的分布情況。結果如表1所示。
根據第70天貝殼絲狀體水平生長面積計算各組生長速率: 對照>6.3>12.5>18.8>25.0>1.3 μmol/(m2·s) (<0.05), 即處理組中, 6.3 μmol/(m2·s)生長速度最快, 達到86.6±22.7 μm/d, 1.3 μmol/(m2·s)最慢, 為29.7± 12.5 μm/d。
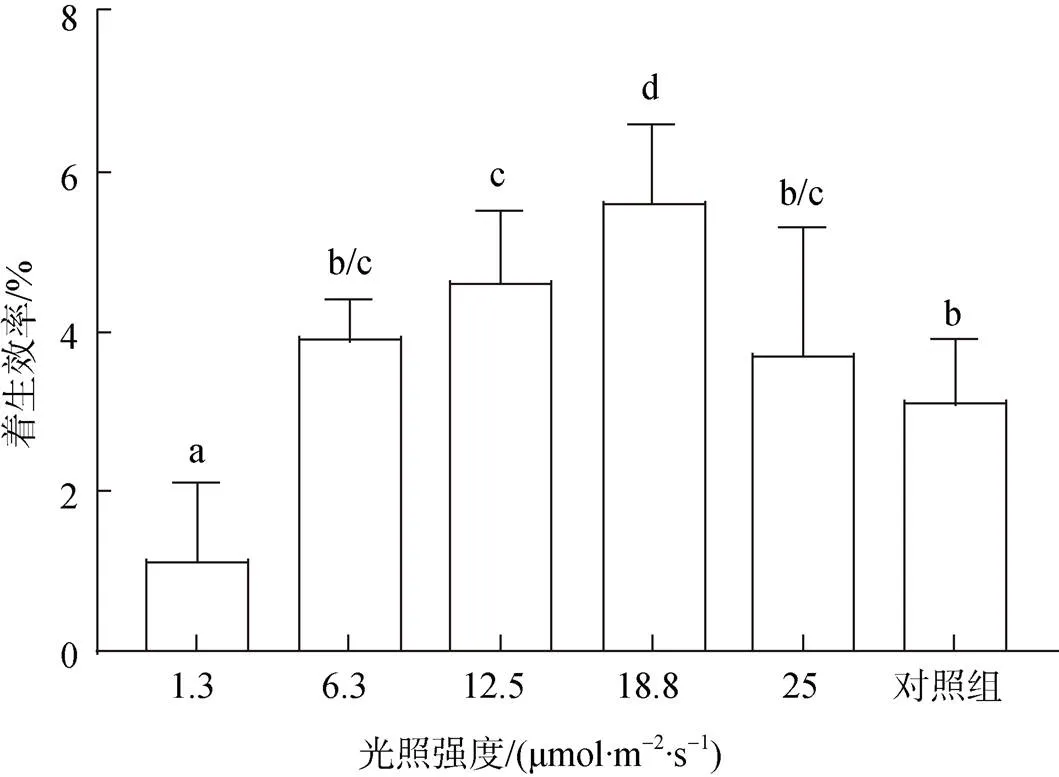
圖3 不同光照強度下條斑紫菜貝殼絲狀體著生效率
相同大寫字母表示不同組間未達顯著差異水平(>0.05), 下圖同
The same capital letters indicated that there was no significant difference between groups (>0.05), the same below
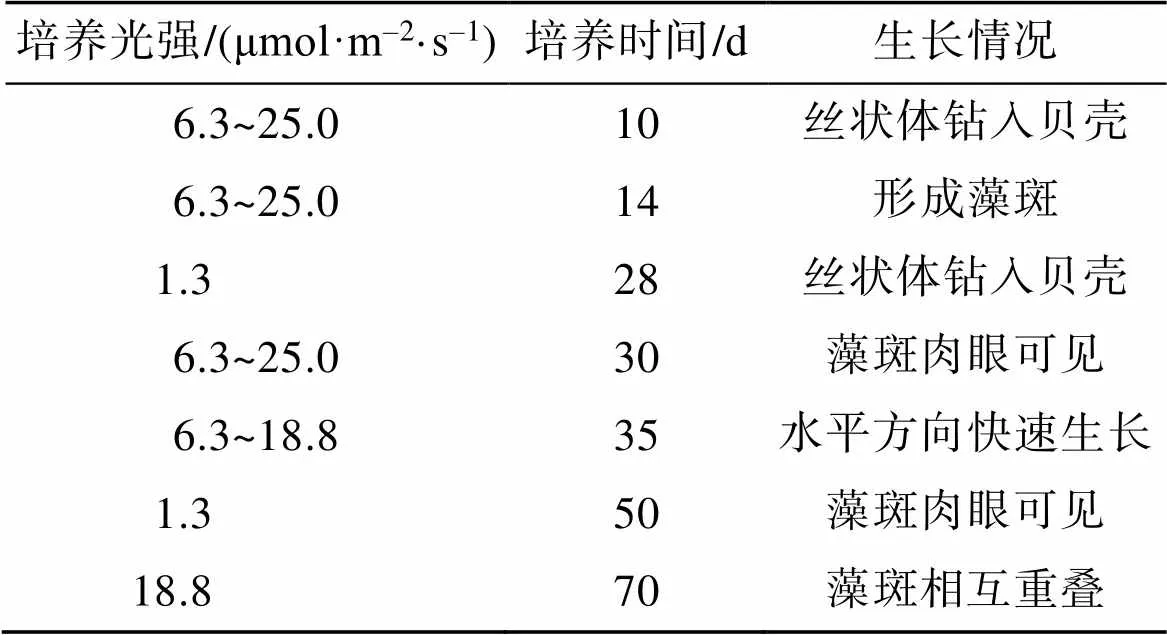
表1 不同培養條斑紫菜貝殼絲狀體生長情況
在接種后55 d, 貝殼絲狀體仍多處于營養藻絲階段, 光強越高, 鉆入深度越深, 貝殼絲狀體在25.0 μmol/(m2·s)光強下鉆入的深度最深, 達(68.6±28.9) μm, 1.3 μmol/(m2·s)光強下最淺, 達(14.2±6.6) μm(圖4)。

圖4 接種后55 d不同光強下條斑紫菜貝殼絲狀體營養藻絲縱向生長長度
接種100 d后貝殼絲狀體由營養藻絲大多發育為孢子囊枝, 在6.3~18.8 μmol/(m2·s)光強范圍內, 孢子囊枝的分布深度基本一致, 為(73±17.7) μm, 高于對照組的(55.4±16.5) μm, 25.0 μmol/(m2·s)光強下鉆入深度達到(88.6±36.1) μm(圖5)。
2.3 光強對貝殼絲狀體顏色的影響
為了研究光強對貝殼絲狀體顏色的影響, 采用色差計對培養8周的貝殼絲狀體藻斑進行色度值檢測。檢測結果顯示, 6.3~18.8 μmol/(m2·s)光強下絲狀體同對照組的*值無顯著性差異, 肉眼可見各組顏色趨于一致, 為黑色; 25.0 μmol/(m2·s)光強下的*值最大, 藻斑顏色呈淺黃色; 將25.0 μmol/(m2·s)光強下培養的貝殼絲狀體放入12.5 μmol/(m2·s)光強下培養2周后,*值降低, 絲狀體顏色變深(圖6)。
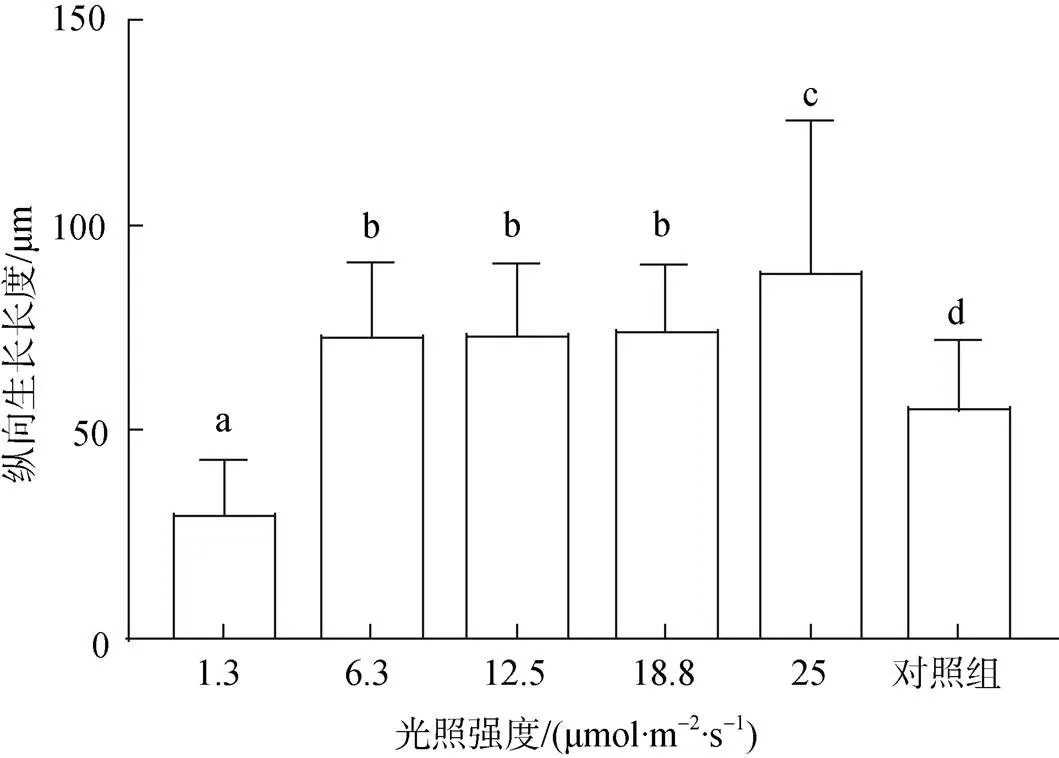
圖5 接種后100 d不同光強下條斑紫菜貝殼絲狀體孢子囊枝縱向生長長度

圖6 不同光強下條斑紫菜貝殼絲狀體色度值
2.4 光強對貝殼絲狀體葉綠素熒光參數的影響
應用WALZ-UKEA0388葉綠素熒光儀PAM分析不同光照強度對接種60 d后貝殼絲狀體光合活性的影響。結果顯示, 貝殼絲狀體的實際量子效率和最大光化學量子效率在1.3~18.8 μmol/(m2·s)呈上升趨勢, 隨光強的升高呈現先上升后下降的趨勢, 在18.8 μmol/(m2·s)光強條件下最高, 達到0.59±0.02。25.0 μmol/(m2·s)光強條件下培育貝殼絲狀體的Fv/Fm低于1.3 μmol/m2/s光強條件下培育的貝殼絲狀體, 為0.48±0.02。為了驗證貝殼絲狀體在18.8~25.0 μmol/ (m2·s)光強間的光合活性變化趨勢, 將18.8 μmol/(m2·s)處理條件下部分接種8周的貝殼放入22.5 μmol/(m2·s)光強下培養2周, 其Fv/Fm值下降為0.52±0.01, 貝殼絲狀體在18.8~25 μmol/(m2·s)光強范圍內的Fv/Fm值隨光強的升高而降低(圖7)。
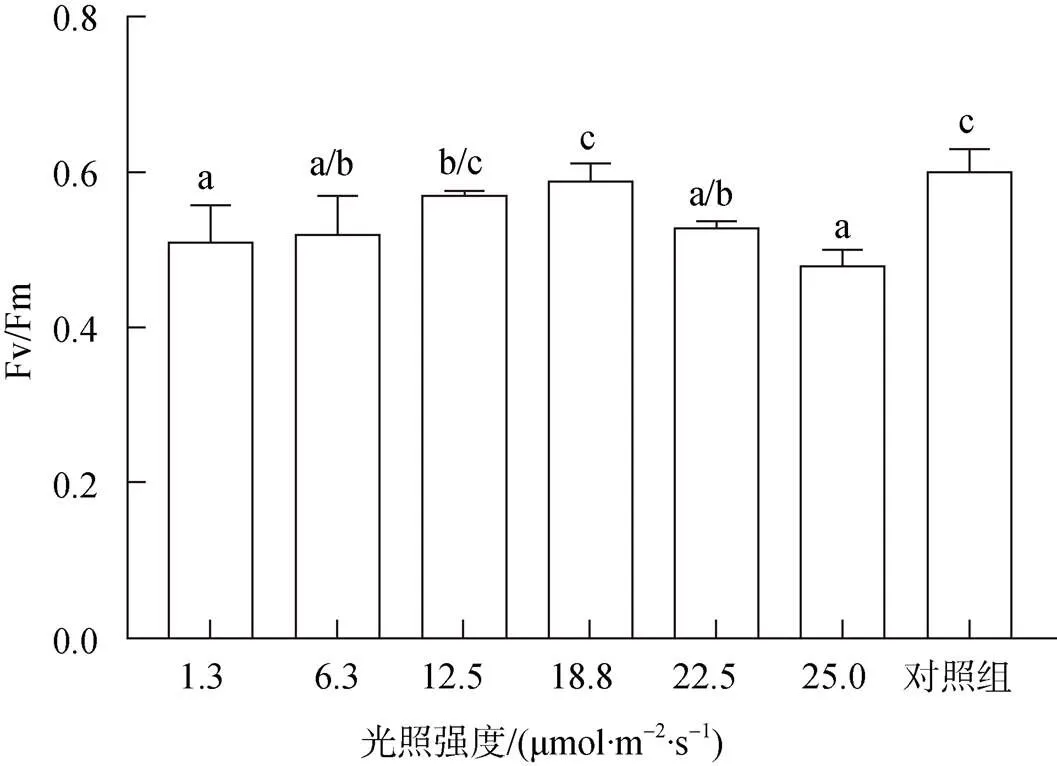
圖7 不同光強下條斑紫菜貝殼絲狀體PS II最大光化學量子效率(Fv/Fm)
2.5 光強對貝殼絲狀體殼孢子放散的影響
為了研究不同光強培養下的貝殼絲狀體殼孢子放散水平, 連續20 d測定了每個貝殼日放散量。結果顯示, 從14 d內殼孢子平均日放散量由大至小為:對照>18.8>6.3>12.5>25.0>1.3 μmol/(m2·s), 即除對照組外, 18.8 μmol/(m2·s)光強下的平均日放散量最大, 達14 746個, 1.3 μmol/m2/s光強下的平均日放散量最小, 為4 760個。生產上將日放散量達1 000~ 10 000個時, 作為貝殼絲狀體即將出現更高數量級放散的先兆[12], 因此本研究將日放散量大于10 000個的天數計為放散高峰日, 通過對放散高峰日的統計發現, 放散高峰天數由多至少為: 18.8>對照>6.3> 12.5=25.0>1.3 μmol/ (m2·s), 18.8 μmol/(m2·s)放散高峰天數為12 d, 1.3 μmol/ (m2·s)放散高峰天數為3 d (圖8)。

圖8 不同光強下條斑紫菜貝殼絲狀體殼孢子放散量
3 討論
光照和溫度的交互作用對藻類生長具有重要影響, JIANG等[13]報道在低溫環境下, 高光強對藍藻有很強的抑制作用, 溫度升高可增加藍藻對高光強環境的適應能力。阮紫曦等[14]報道, 溫度和光強對擬柱孢藻存在顯著的交互作用, 光照對生長速率的影響強度與溫度有關, 生長速率對溫度的響應取決于光強。因此本研究為了探討光照強度對條斑紫菜貝殼絲狀體的影響, 從絲狀體接種至殼孢子放散各階段培育溫度均設為16 ℃, 排除了溫度變化引起的交互影響。任國忠等[15]報道條斑紫菜營養藻絲在5 ℃~ 30 ℃、孢子囊枝在12.5 ℃~30 ℃、殼孢子在12.5 ℃~ 22.5 ℃范圍內均可生長。本研究表明, 16 ℃下條斑紫菜貝殼絲狀體可以發育成孢子囊枝并放散殼孢子。
一些藻類可以通過調整其在水體中的深度, 從而達到調節光照強度的目的[16], 如衣藻()在低中光強的環境下表現為正向的趨光性, 在高光強環境中表現為負向的趨光性[17]。紫菜貝殼絲狀體的自然生長階段正值光強較高的夏季, 絲狀體通過鉆入貝殼基質達到調節光照強度的目的。本研究條斑紫菜貝殼絲狀體培育初期, 隨著光照強度的增加, 絲狀體鉆入文蛤貝殼深度增加, 但縱向生長深度基本不超過珍珠層厚度, 只有少量藻絲進入棱柱層, 而相同條件培養下, 絲狀體可穿透厚度為300~400 μm的海月貝殼生長, 海月貝殼為方解石結構, 可見光范圍內的透光率達80%[18], 文蛤殼珍珠層為文石結構, 棱柱層為方解石結構[19]本研究采用10%濃鹽酸溶解文蛤殼外殼角質層, 測得珍珠層與棱柱層透光率達15%±3%, 再溶解棱柱層后測得珍珠層透光率達36%±2%, 因此貝殼絲狀體的鉆入深度可能與培養基質的結構和透光性相關。
過高的光強會抑制藻體的光合作用和生長速率, 光強越高抑制作用越強。湯文仲等[20]報道長石莼的Fv/Fm值在18~72 μmol/(m2·s)光強范圍內隨光強增加而升高, 當光強范圍提高至72~216 μmol/(m2·s)時, 長石莼的Fv/Fm值隨光強增加而下降。張玉榮等[21]報道銅藻幼苗在受到強光脅迫時其Fv/Fm值降至0.4, 當光強減弱后, Fv/Fm值可恢復到初始值0.73。在魏家慧等[22]報道中, 條斑紫菜的營養藻絲和孢子囊枝在15 ℃, 40 μmol/(m2·s)(該研究中最低培養光強)環境下培養3 d, 其Fv/Fm值達0.14與0.19, 均高于100和300 μmol/(m2·s)處理組, 且營養藻絲和孢子囊枝的的Fv/Fm值隨光強的升高而降低。而本研究中貝殼絲狀體在1.3~18.8 μmol/(m2·s)光強范圍內的Fv/Fm值隨光強增加而增加, 其后隨光照強度的升高而降低, 25 μmol/m2/s下的Fv/Fm值為0.48, 仍高于上述40 μmol/(m2·s)時的Fv/Fm值。因此, 貝殼絲狀體的Fv/Fm隨著光強增加呈現先上升后下降趨勢, 并于18.8 μmol/(m2·s)時達到最大。張濤等[23]研究表明, 條斑紫菜絲狀體在20 μmol/(m2·s)光強的葉綠素熒光參數最大, 后隨光強的增高而降低, 這與本研究在18.8~25 μmol/(m2·s)光強下條斑紫菜絲狀體葉綠素熒光參數的變化趨勢一致。
在紫菜育苗過程中, 絲狀體的顏色在一定程度上反應了藻體的生長情況。朱建一等[4]和許璞等[9]報道中, 健康的條斑紫菜貝殼絲狀體呈紫黑色。孫維華[24]報道中, 正常的紫菜絲狀體的顏色呈紫褐色, 光照強度過低時絲狀體呈蒼白色, 光照強度過高時絲狀體呈桃紅色。唐興本等[25]報道, 貝殼絲狀體在淡水環境或光照強度過低的條件下, 貝殼絲狀體呈紫紅色。本實驗中, 光強越高, 貝殼絲狀體鉆入貝殼深度越大。在1.3 μmol/(m2·s)下貝殼絲狀體鉆入深度為28.9±14.4 μm, 藻斑顏色偏灰黑; 25.0 μmol/(m2·s)光強下鉆入深度達88.6±36.1 μm, 少量藻絲進入棱柱層, 藻斑顏色偏淺黃, 當光強由25.0降低到12.5 μmol/(m2·s)培養2周后, 藻斑顏色變深。在6.3~18.8 μmol/(m2·s)光強范圍內, 貝殼絲狀體水平生長速率高于其他處理組, 且鉆入文蛤殼的深度與藻斑顏色趨于一致, 深度達73±17.7 μm, 顏色呈黑色。說明6.3~18.8 μmol/(m2·s)光強范圍為貝殼絲狀體的適宜生長光照范圍。
光照強度是條斑紫菜生長的重要因素, 條斑紫菜在不同生長階段的光照強度和溫度均不相同。朱建一等[4, 26]報道條斑紫菜自由絲狀體的適宜培養光強為1 200~2 200 Lx, 貝殼絲狀體營養藻絲的適宜生長光強為3 000 Lx, 孢子囊枝階段的適宜光強為1 500 Lx; 孔曉銳等[27]報道條斑紫菜殼孢子放散時的適宜光照為27 μmol/(m2·s)。本研究的結果顯示, 條斑紫菜貝殼絲狀體的適宜光照強度為6.3~18.8 μmol/(m2·s), 低于朱建一等[26]報道的自由絲狀體適宜生長光強范圍, 推測是由于貝殼絲狀體較自由絲狀體受光均勻, 透光性較強的緣故。
在生產性育苗過程中, 貝殼絲狀體接受光照強度受天氣、育苗池空間布置等原因易出現較大波動, 且光強測量位置、方向的不同均會引起較大的誤差, 因此, 光照強度的調節應進行固定方位的周期性記錄, 以提高準確性。同時貝殼育苗池內會因水質、種質等原因容易造成硅藻等雜藻污染, 附著在貝殼表面的雜藻可間接調節光照強度, 光照強度越大, 貝殼表面附生的硅藻量越大, 從而降低貝殼絲狀體的光照強度。因此, 在實際生產中, 光線強度的調節需要綜合光照強度、天氣、育苗池的空間分布、雜藻、貝殼洗刷成本等各種因素。
4 結論
本研究結果顯示, 條斑紫菜絲狀體著生的最適光照強度范圍為6.3~18.8 μmol/(m2·s)。從貝殼絲狀體的著生效率、生長速度、光合生理及殼孢子放散量來看, 18.8 μmol/(m2·s)更有利于絲狀體的著生, 而在1.3與25.0 μmol/(m2·s)光強下絲狀體著生效率及生長發育水平均處于低水平狀態。
[1] YANG L E, DENG Y Y, RUSSEL S, et al. Redefining Pyropia (Bangiales, Rhodophyta): four new genera, resurrection ofand description ofsp. nov. from China[J]. Journal of Phy-cology, 2020, 56(4): 862-879.
[2] 張學成, 秦松, 馬家海, 等. 海藻遺傳學[M]. 北京: 農業出版社, 2005: 184-187.
ZHANG Xuecheng, QIN Song, MA Jiahai, et al. The genetics of marine algae[M]. Beijing: Agricultural Press, 2005: 184-187.
[3] Kok B. On the inhibition of photosynthesis by intense light[J]. Biochimica Et Biophysica Acta, 1956, 21(2): 234-244.
[4] 朱建一, 嚴興洪, 丁蘭平, 等. 中國紫菜原色圖集[M]. 北京: 中國農業出版社, 2017: 59-106.
ZHU Jianyi, YAN Xinghong, DING Lanping, et al. Color atlas of Chinese laver[M]. Beijing: China Agriculture Press, 2017: 59-106.
[5] 潘潔, 施定基, 陳建新, 等. 紫菜兩個光系統間激發能分配研究對光合進化的啟示[J]. 科學通報, 2000, 45(12): 1276.
PAN Jie, SHI Dingji, CHEN Jianxin, et al. Study on excitation energy distribution between twoand its enlightenment to photosynthetic evolution[J]. Chinese Science Bulletin, 2000, 45(12): 1276.
[6] 尾形英二. ノリ糸狀體の生長に関する研究[J]. 水講研究報告, 1961, 10(3): 423-500.
EIJI O. Study on the growth ofconchocelis[J]. Water Lecture Research Report, 1961, 10(3): 423-500.
[7] 鄭寶福, 陳美琴, 費修綆. 培養光強對條斑紫菜絲狀體生長發育的影響[J]. 海洋與湖沼, 1980, 1(4): 362- 369.
ZHENG Baofu, CHEN Meiqin, FEI Xiugeng. Effects of culture light intensity on the growth and development ofconchocelis[J]. Oceanologia et Limnologia Sinica, 1980, 1(4): 362-369.
[8] ZHANG X C, BRAMMER E, MARIANNE P, et al. Effects of light photon flux density and spectral quality on photosynthesis and respiration in(Bangiales, Rhodophyta)[J]. Phycological Research, 2010, 45(1): 29-37.
[9] 許璞, 張學成, 王素娟. 中國主要經濟海藻的繁殖與發育[M]. 北京: 中國農業出版社, 2013: 118-121.
XU Pu, ZHANG Xuecheng, WANG Sujuan. Reproduc-tion and development of major economic marine algae in China[M]. Beijing: China Agriculture Press, 2013: 118-121.
[10] 呂峰, 嚴興洪, 王小紅, 等. 移植量、光密度及溫度對條斑紫菜不同品系殼孢子放散量的影響[J]. 江蘇農業科學, 2019, 47(10): 186-188.
LV Feng, YAN Xinghong, WANG Xiaohong, et al. Effects of transplantation volume, optical density and temperature on the release of conchospores from different strains of[J]. Jiangsu Agricultural Sciences, 2019, 47(10): 186-188.
[11] 付春輝, 嚴興洪, 黃林彬, 等. 條斑紫菜()選育品系殼孢子的放散量與耐高溫性研究[J]. 海洋與湖沼, 2011, 42(3): 460-466.
FU Chunhui, YAN Xinghong, HUANG Linbin, et al. Study on the release amount and high temperature tole-rance of ascospores in the breeding line of[J]. Oceanologia et Limnologia Sinica, 2011, 42(3): 460-466.
[12] 中國科學院海洋研究所. 條斑紫菜的人工養殖[M]. 北京: 科學出版社, 1978, 23-108.
Institute of Oceanology, Chinese Academy of Sciences. Artificial cultivation of[M]. Beijing: Science Press, 1978, 23-108.
[13] JIANG H, KONG R, XU X. The N-acetylmuramic acid 6-phosphate etherase gene promotes the growth and cell differentiation in cyanobacteria under light-limiting conditions[J]. Journal of Bacteriology, 2010, 192(8): 2239-2245.
[14] 阮紫曦, 于婷, 雷臘梅, 等. 光照-溫度交互作用及不同氮源對擬柱孢藻生長的影響[J]. 熱帶亞熱帶植物學報, 2018, 26(2): 133-140.
RUAN Zixi, YU Ting, LEI Lamei, et al. The effect of light-temperature interaction and different nitrogen sour-ces on the growth of.[J]. Journal of Tropical and Subtropical Botany, 2018, 26(2): 133-140.
[15] 任國忠, 曾呈奎, 崔廣法, 等. 溫度對條斑紫菜絲狀體生長發育的影響[J]. 海洋科學, 1978, 1(2): 28-38.
REN Guozhong, ZENG Chengkui, CUI Guangfa, et al. Effects of temperature on growth and development offilaments[J]. Marine Sciences, 1978, 1(2): 28-38.
[16] 高坤山. 藻類固碳[M]. 北京: 科學出版社, 2014: 8-9.
GAO Kunshan. Algal carbon fixaution[M]. Beijing: Science Press, 2014: 8-9.
[17] TAKAHASHI T, WATANABE M. Photosynthesis mo-dulates the sign of phototaxis of wild-typereinhardtii[J]. Febs Letters, 1993, 336(3): 516- 520.
[18] LI L, ORTIZ C. Pervasive nanoscale deformation twin-ning as a catalyst for efficient energy dissipation in a bioceramic armour[J]. Nature Materials, 2014, 13(5): 501-507.
[19] 鄧志華. 文蛤貝殼層狀結構及其性能研究[D]. 長春: 吉林大學, 2011.
DENG Zhihua. Study on clam shells structure and pro-perties of layered[D]. Changchun: Jilin University, 2011.
[20] 湯文仲, 李信書, 黃海燕, 等. 不同光強和溫度對長石莼(緣管滸苔)光合作用和葉綠素熒光參數的影響[J]. 水產學報, 2009, 33(5): 762-769.
TANG Wenzhong, LI Xinshu, HUANG Haiyan, et al. Effects of different light intensities and temperatures on the photosynthesis and chlorophyll fluorescence parameters of Ulva linza ()[J]. Acta Fisheries Sinica, 2009, 33(5): 762-769.
[21] 張玉榮, 劉峰, 單體鋒, 等. 利用葉綠素熒光技術揭示人工培育的銅藻幼苗對脅迫溫度、光照和鹽度的反應[J]. 南方水產科學, 2009, 5(2): 1-9.
ZHANG Yurong, LIU Feng, SHAN Tifeng, et al. Stress resistance of young seedlings ofto a variety of temperature, irradiances and salinity revealed by chlorophyll fluorescence measurements[J]. Southern Fisheries Science, 2009, 5(2): 1-9.
[22] 魏家慧, 李國梁, 汪文俊. 條斑紫菜絲狀體不同發育時期對光照和溫度的光合適應能力[J]. 漁業科學進展, 2020, 41(6): 115-124.
WEI Jiahui, LI Guoliang, WANG Wenjun.filaments at different developmental stages respond to light and temperature[J]. Progress in Fishe-ries Science, 2020, 41(6): 115-124.
[23] 張濤, 沈宗根, 李家富, 等. 紫菜不同品系貝殼絲狀體葉綠素熒光特性比較[J]. 江蘇農業科學, 2012, 11: 238-242.
ZHANG Tao, SHEN Zonggen, LI Jiafu, et al. Compa-ri-son of chlorophyll fluorescence characteristics of conchocelis of[J]. Jiangsu Agricultural Sciences, 2012, 11: 238-242.
[24] 孫維華. 條斑紫菜絲狀體培育技術[J]. 水產養殖, 1994, 1(2): 11.
SUN Weihua. Cultivation technology offilaments[J]. Aquaculture, 1994, 1(2): 11.
[25] 唐興本, 陳百堯, 時勤. 根據貝殼絲狀體顏色進行紫菜育苗病害防治[J]. 江西水產科技, 2006, 1(3): 26-27.
TANG Xingben, CHEN Baiyao, SHI Qin. Prevention and control ofseedling diseases based on the color of conchocelis[J]. Jiangxi Fisheries Science and Technology, 2006, 1(3): 26-27.
[26] 朱建一, 鄭慶樹, 陸勤勤, 等. 條斑紫菜絲狀體懸浮培養研究[J]. 水產養殖, 1997, 12(2): 12-14.
ZHU Jianyi, ZHENG Qingshu, LU Qinqin, et al. Study on suspension culture offilaments[J]. Aquaculture, 1997, 12(2): 12-14.
[27] 孔曉銳, 吳菲菲. 條斑紫菜殼孢子附著條件研究[J]. 現代農業科技, 2012, 579(13): 236-237.
KONG Xiaorui, WU Feifei. Study on the attachment con-ditions ofconchospores[J]. Mo-dern Agricultural Science and Technology, 2012, 579(13): 236-237.
Influence of distinctive light intensities on the conchocelis of
SHANG Hao-jiang1, ZHOU Wei2, HU Chuan-ming2, SHEN Xin1, ZHU Peng-chang1, LI Shuai3
(1. Jiangsu Provincial Key Laboratory of Marine Biotechnology, Jiangsu Ocean University, Lianyungang 222000, China; 2. Jiangsu Marine Fisheries Research Institute, Nantong 226007, China; 3. Shanghai Ocean University, Shanghai 201306, China)
Some of the crucial factors that influence the growth, development, and conchospore release ofshell conchocelis are the light and the temperature. As a consequence of their synergistic effects, as well as the demand for distinctive light intensities at varied cultivation stages, the study of their influence on various cultivation aspects ofshell conchocelis was carried out by fluctuating the light intensities to observe the implantation, growth, development, and the conchospores release. This research would promote the administration of light intensity in the shell conchocelis stage ofcultivation. For the analysis, theconchocelis of Y-9101 strain was implanted on the clamshells at five distinct light intensities ranging between 1.3–25.0 μmol/m2/s at 16 ℃and was cultured until the conchospores were released. Various observation parameters of the shell conchocelis, such as the growth efficiency, horizontal growth rate, growth depth, chromatic value, photosynthetic activity, and the release amount of conchospores were measured and analyzed by the optical microscope, the scanning electron microscope, the colorimeter, and the chlorophyll fluorometer. The results demonstrated an upward trend initially followed by a downward course in both the implantation efficiency and the horizontal growth rate ofshell conchocelis. The highest implantation efficiency of 5.6% was measured at 18.8 μmol/m2/s, and the highest horizontal growth rate of 86.6 μm/d was measured at 6.3 μmol/m2/s. The longitudinal growth rate proliferated with increased light intensity. The final growth depth of shell conchocelis with the distinctive light intensities ranged between 6.3–18.8 μmol/m2/s was uniform, and the shell color spots appeared black. Moreover, the total release amount of conchospores was higher in comparison to the other groups. However, the color of the shell conchocelis spots at 25.0 μmol/m2/s appeared slightly yellow. In addition, the release amount of conchospores, actual quantum efficiency, light energy efficiency, and the maximum photochemical quantum yield under the light intensity of 25.0 μmol/m2/s was comparatively lower than the distinctive light intensity groups of 6.3–18.8 μmol/m2/s range. Based on the results, the study concluded that the light intensity range of 6.3–18.8 μmol/m2/s is recommended for the optimal growth ofshell conchocelis.
light intensity;; shell conchocelis; photosynthetic activity; growth rate
Apr. 7, 2021
S197.3
A
1000-3096(2022)02-0037-09
10.11759/hykx20210407002
2021-04-07;
2021-10-15
江蘇省種業振興項目(JBGS(2021)140); 江蘇省現代農業產業技術體系(JATS[2021]393、394、395, JATS[2020]371、372、373); 南通市科技計劃項目(MS22021016, JC2021087); 江蘇省研究生科研與實踐創新計劃項目(JSCX19_0984)
[Jiangsu Seed Industry Revitalization Project, No. JBGS (2021) 140; Modern Agricultural Industrial Technology System of Jiangsu Province, Nos. JATS[2021]393, 394, 395, JATS[2020]371, 372, 373; Nantong Science and Technology Project, Nos. MS22021016, JC2021087; Jiangsu Province Graduate Research and Practice Innovation Program, No. JSCX19_0984]
尚浩江(1991—), 男, 碩士研究生, 主要從事紫菜育苗研究, E-mail: 353867506@qq.com; 胡傳明(1980—),通信作者, E-mail: hucharming@163.com
(本文編輯: 譚雪靜)

