基于網絡藥理學探討黨參、海藻“藥對”治療肝癌的作用機制及關鍵的靶點通路預測
劉婷婷,李新,楊冰,田成旺,徐旭,李國霞
(1.天津醫科大學國際醫學院中西醫結合教研室,天津 300070;2.天津藥物研究院,天津市中藥質量標志物重點實驗室,天津 300301)
肝癌是全球第6 大最常見惡性腫瘤,我國是肝癌高發國家,每年全球肝癌新增病例約半數在中國。由于早期不易發現、不典型;晚期高轉移、高復發的特點,導致肝癌死亡率極高,肝癌死亡率從2018 年的第3 位上升到2020 年的第2 位,僅次于肺癌[1-2]。盡管傳統的肝臟切除術、肝臟移植術、靶向治療、放射介入和局部消融等新興治療手段的出現,使得肝癌的治療效果不斷提高,但肝癌發展迅速使得預后并不理想,因此尋找靶向清晰、高效低毒的新型抗肝癌藥物是今后肝癌研究的重要任務。
《諸病源候論》積聚病諸候篇中“諸臟受邪,初未能成積聚,留滯不去,乃成積聚。”認為肝癌的發生是外感六淫邪氣,內在機體虛損、情志內傷以及飲食不節等因素引起肝脾功能失調,寒積、痰濁、氣滯、血瘀、濕邪熱毒等實邪長期積聚形成[3]。同時,正邪交爭是癌癥發生的關鍵,人體正氣充足時能抵抗邪氣的入侵,不會發生癌癥,相反則會發生癌變。中醫治療原發性肝癌最常用的治法是“益氣軟堅”:“益氣”即增強自身免疫以抵御外邪,“軟堅”即軟堅散結消炎,目的是從根本上扶助正氣的同時祛除毒邪、消散腫瘤,改善機體邪盛正衰的狀態[4]。本次網絡藥理實驗依據中醫治療肝癌法則之“益氣軟堅”,選用黨參作為“益氣”之用,海藻發揮“軟堅”之功,探討該“藥對”治療肝癌化學成分及其作用機制。
《本草從新》首載“黨參”,屬于上等之佳品,味甘、性平,歸脾、肺二經,有補中益氣、健脾益肺、養血生津之效。現代藥理研究證實黨參多糖可以抗腫瘤、提高免疫和抗疲勞等[5-6]。海藻始見于《神農本草經》,味苦、咸,性寒,歸肝、胃、腎經,有軟堅、化痰、利水、消腫的功效[7]。近年來,海藻在治療各種腫瘤中顯示出獨特的優勢,未來具有不錯的發展前景[8]。
1 材料和方法
1.1 材料
1.1.1 藥品 對照品巖藻甾醇(質量分數≥98%,批號99718),粉末4℃避光保存,購自美國MCE 公司。
1.1.2 細胞株 人HepG2 肝癌細胞,購自武漢普諾賽生物科技有限公司。
1.1.3 試劑 DMEM 細胞培養基(批號8121330)、胎牛血清(批號2279804CP)、0.25%胰蛋白酶(批號2186962)購自美國Gibco 公司;100×青霉素-鏈霉素溶液(批號C0222)購自碧云天生物技術有限公司;二甲基亞砜(DMSO,批號D8371)購自索萊寶公司;四甲基偶氮唑藍(MTT)粉劑(批號MKCL9866)購自美國Sigma 公司。
1.1.4 儀器 Multiskan Go 全自動酶標儀(美國Thermo 公司);TDL80-2B 型臺式離心機(上海安亭科學儀器廠);CKX-41 型倒置顯微鏡(日本Olympus公司);SeriesⅡ型二氧化碳培養箱(美國Thermo公司);Revco PLUS 型-80℃冰箱(美國Thermo 公司);超微量移液器(美國Thermo 公司);超凈工作臺(上海Heal Force 公司);細胞計數板(上海市求精生化試劑儀器有限公司)。
1.2 方法
1.2.1 獲取黨參、海藻化學成分 本研究從中藥系統藥理分析數據庫(Traditional Chinese Medicine Systems Pharmacology Database,TCMSP)以及“中國知網”中獲取黨參、海藻化學成分。篩選條件是根據TCMSP 數據庫中藥物動力學(absorption and distribution andmetabolismand excretion,ADME)參數而定,以口服生物利用度(OB)≥30%、類藥性指數(DL)≥0.18 為條件,篩選符合的化學成分。由于TCMSP 中收錄的化學成分有局限性,另外采用文獻挖掘的方法從“中國知網”中補充收集黨參、海藻“藥對”的化學成分。
1.2.2 獲得黨參、海藻化學成分的潛在作用靶點(1)從TCMSP 數據庫得到活性成分的部分靶點。(2)從PubChem 數據庫(https://pubchem.ncbi.nlm.nih.gov/)得到活性成分的Canonical SMILES,將其輸入SEA數據庫(http://sea.bkslab.org/)獲得活性成分的部分靶點。(3)從《中藥活性成分分析手冊》中查到黨參、海藻化學成分的結構,導入Swiss Target Prediction 數據庫(http://www.swisstargetprediction.ch/)獲得部分靶點。去掉重復靶點,得到最終靶點。
1.2.3 檢索肝癌的作用靶點 從TTD(http://bidd.nus.edu.sg/BIDD-Databases/TTD/TTD.asp)或OMIM數據庫(http://www.omim.org/)中搜集與肝癌相關的靶點,輸入“Liver cancer”、“Human hepatocellular carcinoma”等關鍵詞匯進行搜索,取得分≥0.4 的靶點。將挖掘得到的肝癌相關基因與黨參、海藻“藥對”靶點基因互相映射,獲得黨參、海藻“藥對”治療肝癌的作用靶點。
1.2.4 構建黨參、海藻-化合物-靶點-肝癌網絡 使用Cytoscape3.8.2 軟件來構建黨參、海藻-化合物-靶點-肝癌的可視化網絡,預測化合物和靶點之間的關系。網絡中的節點(node)表示黨參、海藻、肝癌、化合物以及靶點,以邊(edge)表示藥物化合物與靶點之間的聯系,靶點是肝癌與活性成分共有的靶點。
1.2.5 黨參、海藻“藥對”與肝癌作用靶點PPI 網絡構建 將關鍵靶點在STRING 在線分析平臺(https://string-db.org/)構建蛋白-蛋白相互作用(PPI)網絡,最低相互作用評分設為“medium confidence”(>0.4),選擇隱藏游離節點,其他保持默認值,限定研究物種為“Homo sapiens”,最后Cytoscape3.8.2 軟件以度值為標準構建蛋白互作網絡。
1.2.6 GO 生物功能、KEGG 通路富集分析 運用OmicsBean 數據庫(http://www.omicsbean.cn/)獲得32 個靶點蛋白的基因本體(GO)功能及基因組百科全書(KEGG)通路富集分析,GO 富集分析的結果有3 大類,分別為“藍色”生物過程(BP)、“紅色”細胞化合物(CC)和“黃色”分子功能(MF)。以P<0.05 為限定條件,從基因生物功能與信號通路角度進一步明確黨參、海藻”藥對”對治療肝癌的作用機制。
1.2.7 細胞培養 人HepG2 肝癌細胞培養于DMEM 完全培養基,5%CO2、飽和濕度的37℃恒溫培養箱中生長。生長至對數生長期且狀態良好時,用胰蛋白酶消化傳代,進行后續實驗。
1.2.8 MTT 法檢測巖藻甾醇對人HepG2 肝癌細胞增殖的影響 96 孔板中每孔接種100 μL HepG2細胞懸液,繼續生長至約40%時加入不同濃度的巖藻甾醇溶液(0、0.06、0.12、0.24 mmol/L),每組設6 個復孔,處理24 h,每孔加5 mg/mL MTT 溶液20 μL,孵育4 h,DMSO 振蕩搖勻10 min,測490 nm 處的吸光度(A490 值),重復3 次。計算各組巖藻甾醇溶液對HepG2 細胞的抑制率:(1-A給藥組/A空白對照組)×100%。
1.3 統計學處理 采用SPSS22.0 軟件實現數據的統計分析,計數資料用n(%)表示,組間比較采用χ2檢驗,計量資料進行正態性檢驗,符合正態分布的數據用±s 表示,多組間比較采用單因素方差分析,P<0.05 為差異具有統計學意義。
2 結果
2.1 獲取黨參、海藻化學成分 從TCMSP、中國知網中獲得黨參、海藻化合物成分29 種,剔除3 個未查詢到靶點的化合物,剩余26 種活性化合物,其中黨參20 種、海藻6 種,未有重復成分,化合物信息見表1。

表1 黨參20 種、海藻6 種化學成分基本信息Tab 1 Basic information of chemical constituents of 20 species of Codonopsispilosula and 6 species of Sargassum
2.2 獲得黨參、海藻化學成分的潛在作用靶點 通過TCMSP、SEA、Swiss Target Prediction 數據庫檢索29 種活性化合物潛在的相關靶點,收集到靶點黨參有978 個,海藻有839 個,去除重復后得到靶點964 個。
2.3 檢索肝癌的作用靶點 通過TTD、OMIM 數據庫,共獲得與肝癌相關的486 個靶點。黨參、海藻“藥對”治療肝癌的共同潛在作用靶點有32 個,見表2。

表2 黨參、海藻“藥對”治療肝癌的32 個共同潛在作用靶點Tab 2 32 common potential targets of "drug pair" of Codonopsispilosula and Sargassum in the treatment of liver cancer
2.4 構建黨參、海藻-化合物-靶點-肝癌網絡 對黨參、海藻“藥對”含有的化合物、化合物靶點以及肝癌靶點、肝癌進行關聯,利用軟件Cytoscape3.8.2 構建網絡圖,圖1 為得到的網絡圖(紅色為共同靶點,藍色為化合物,綠色為海藻,黃色為黨參,紫色為疾病肝癌)。圖中有26 種化合物節點,32 個靶點節點,2 個藥物節點,1 個疾病節點。在網絡圖中一個節點連接線的數目稱為度,度的高低代表節點在網絡中的重要程度。

圖1 黨參、海藻-化合物-靶點-肝癌網絡圖Fig 1 Codonopsispilosula,Sargassum -compound-target-liver cancer network map
2.5 靶點PPI 網絡、關鍵基因分析 將32 個黨參、海藻“藥對”與肝癌共同靶點輸入STRING 數據庫,獲得PPI 網絡,隱藏3 個游離節點之后PPI 網絡包含29個靶基因節點,共有199 條相互作用連線(圖2)。之后導入Cytoscape3.8.2 軟件,獲得各個蛋白的度值大小,PPI 網絡代表各個蛋白與其他蛋白相互作用,度值越大表示該蛋白在該網絡中發揮的作用越大,先根據度值篩選出前10 位,見表3。其中細胞表皮生長因子受體(EGFR)、蛋白激酶B(AKT1)、血管內皮生長因子A(VEGFA)與TP53 是表3 中度值最大的前4 位,預測可靠性更高、結構更精準,因此選擇前4位靶點作為本次網絡藥理篩選出的關鍵靶點。
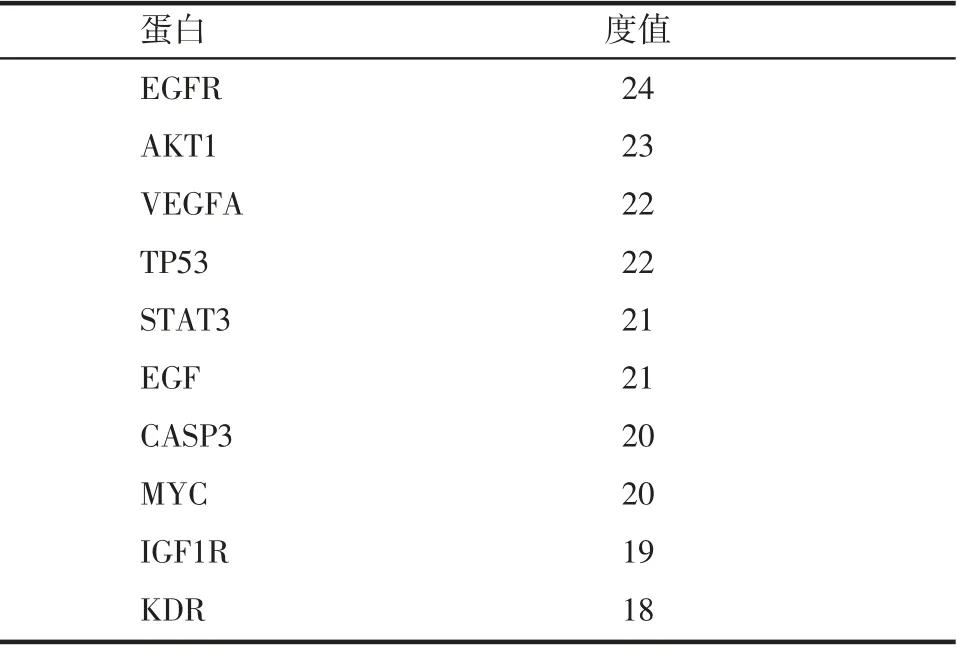
表3 蛋白度值表(按由大到小篩選出前10 位)Tab 3 Proteinvaluetable(thetop10arescreenedfromlargetosmall)
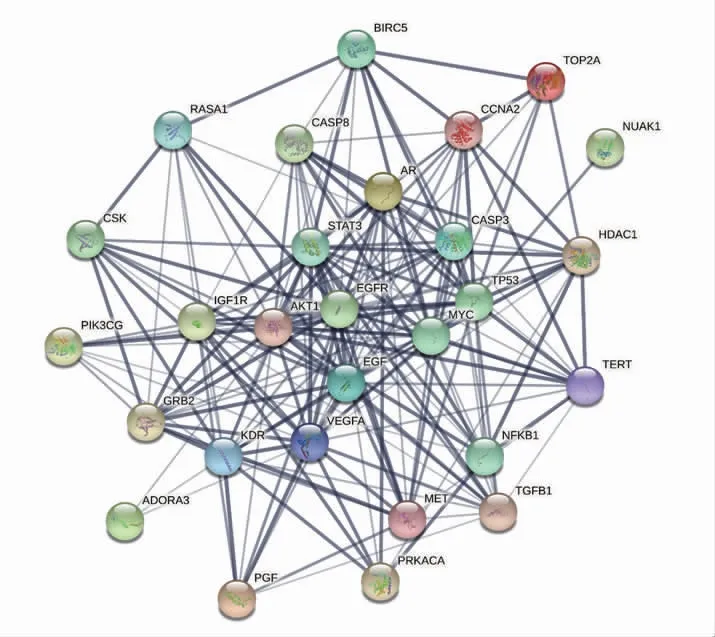
圖2 蛋白互作網絡圖Fig 2 Protein interaction network diagram
2.6 GO 集分析和KEGG 分析黨參、海藻“藥對”的32 個共同潛在靶點在信號通路中的作用 篩選BP、CC 和MF 的前10 個富集條件作圖,其中BP(生物學過程)涉及細胞增殖、程序性死亡調節、凋亡過程負調控和催化調節等多個生物過程,基因占比均>50%;CC(細胞化合物)涉及胞質、細胞器以及細胞核等細胞結構,胞質占比最高,除膜筏、核染色區占比較低之外,其他基因占比均在40%以上;MF(分子功能)涉及最關鍵的是蛋白質二聚活性,基因占比約90%左右(圖3、表4)。此外黨參、海藻“藥對”治療肝癌的KEGG 分析,根據P 值和分數篩選出前10 條KEGG 通路(P<0.05),其中信號通路包括癌癥通路、MAPK 信號通路、PI3K-AKT 信號通路和Ras信號通路等,疾病通路有乙型肝炎、丙型肝炎、肝癌、結直腸癌等,其中MAPK 和PI3K-AKT 是最關鍵的兩條通路(表5、圖4),圖4 中P 值越小,圓圈越大,關聯度越大,顏色越深。

圖4 黨參、海藻“藥對”治療肝癌KEGG 通路富集分析氣泡圖Fig 4 Bubble diagram of KEGG pathway enrichment analysis of Codonopsispilosula and Sargassum"drug pair"in the treatment of hepatocellular carcinoma

表4 黨參、海藻“藥對”治療肝癌潛在靶點GO 富集結果(各前10 條)Tab 4 GO enrichment results of potential targets of Codonopsispilosula and Sargassum"drug pairs"in the treatment of liver cancer(top 10 each)

表5 黨參、海藻“藥對”治療肝癌潛在靶點KEGG 富集分析(前10 條)Tab 5 KEGG enrichment analysis of potential targets of Codonopsispilosula and Sargassum "drug pair" in the treatment of hepatocellular carcinoma(Top 10)
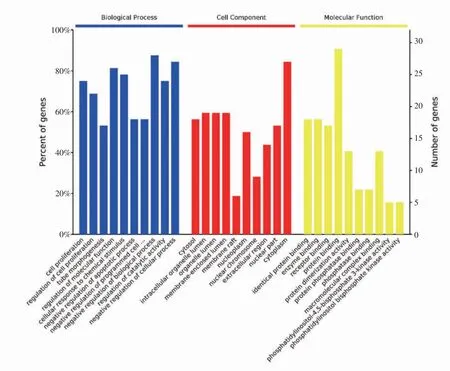
圖3 黨參、海藻“藥對”治療肝癌的潛在靶點GO 富集分析柱狀圖Fig 3 Histogram of GO enrichment analysis of potential targets of"drug pair"of Codonopsispilosula and Sargassum in the treatment of liver cancer
2.7 巖藻甾醇對人HepG2 肝癌細胞增殖的影響如表6 所示,與空白對照組(0 mmol/L)相比,巖藻甾醇各劑量組細胞存活率明顯降低,差異均有顯著性(均P<0.05)。
表6 巖藻甾醇對人HepG2 肝癌細胞增殖抑制率的影響(±s,n=6)Tab 6 Effect of fucosterol on proliferation inhibition rate of human HepG2 hepatoma cells(±s,n=6)
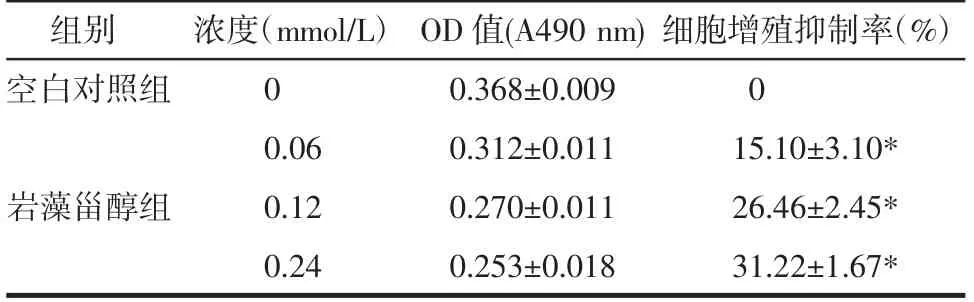
表6 巖藻甾醇對人HepG2 肝癌細胞增殖抑制率的影響(±s,n=6)Tab 6 Effect of fucosterol on proliferation inhibition rate of human HepG2 hepatoma cells(±s,n=6)
注:與空白對照組相比,*P<0.05
組別 細胞增殖抑制率(%)空白對照組 0 15.10±3.10*巖藻甾醇組 26.46±2.45*31.22±1.67*濃度(mmol/L)0 0.06 0.12 0.24 OD 值(A490 nm)0.368±0.009 0.312±0.011 0.270±0.011 0.253±0.018
3 討論
黨參、海藻“藥對”抗肝癌網絡藥理實驗獲得4 種有后續研究意義的化合物,依次為木犀草素、黨參炔苷、槲皮素、巖藻甾醇。木犀草素與槲皮素是大多數中藥普遍含有的活性化學物質,目前已有許多文獻報道其有抗腫瘤作用,對于肝癌也有不錯的治療效果。黨參炔苷是黨參的主要代表成分,海藻多糖由于種類繁多且結構非常復雜,TCMSP 數據庫并未收入,因此巖藻甾醇作為海藻主要代表成分,目前還未有文獻報道顯示黨參炔苷與巖藻甾醇可以抗肝癌,本次網絡藥理預測結果顯示黨參炔苷與巖藻甾醇對于肝癌的治療有一定的作用;EGFR、AKT1、VEGFA與TP53 等為主要作用靶點;MAPK 和PI3K-AKT等為最主要的信號通路。
木犀草素(Luteolin)是一種天然黃酮類化合物,主要存在于十字花科、天南星科、傘形科等藥物和蔬菜中,有抗肝癌作用[9]。槲皮素(Quercetin)廣泛存在于各種食品中,功效有抗氧化、抗炎癥、抗腫瘤等[10],據報道顯示槲皮素可以抑制人肝癌HepG2 細胞增殖和遷移[11]。巖藻甾醇(Fucosterol)是從褐藻中提取的一種成分,研究表明巖藻甾醇可誘導卵巢癌細胞分化、抑制細胞增殖[12],目前尚未有抗肝癌的報道。黨參炔苷(Lobetyolin)是一種聚乙炔糖苷,在黨參屬植物中含量較高,實驗證明黨參炔苷呈劑量依賴性(10~40 μmol/L)抑制體外培養的HCT116 結腸癌細胞的增殖,并誘導caspase 依賴性的凋亡[13],目前黨參炔苷尚未有抗肝癌的報道。
EGFR 是一種酪氨酸激酶,其過表達與腫瘤發生、發展密切相關,可作用于下游相關信號通路來調節腫瘤細胞增殖、侵襲和遷移[14]。AKT1 是PI3K/AKT 信號通路重要的下游靶標[15]。AKT1 可通過抑制細胞凋亡而促使細胞存活,AKT1 被磷酸化激活預示著肝癌細胞有侵襲性[16]。VEGFR 參與血管相關細胞的分裂、增殖和遷移,腫瘤血管的形成是誘發腫瘤侵襲和轉移的必要步驟[17]。TP53 是一種抑癌基因,若該基因發生突變將會促進腫瘤發展,同時細胞分化、細胞凋亡、血管生成和抑制轉移等也會隨之相應改變[18]。目前槲皮素、木犀草素均被發現可抑制人肝癌細胞中AKT1 蛋白的磷酸化激活,誘導細胞凋亡[19-20]。研究顯示[21-22],槲皮素、木犀草素可激活P53 信號通路中TP53 抑癌基因,造成胰腺癌、肝癌和結腸癌腫瘤細胞凋亡。巖藻甾醇與黨參炔苷未有相關研究證實是通過以上分子發揮作用,今后還需不斷探索。
MAPK 信號通路包括ERKs、c-Jun 氨基末端激酶(JNK)和p38MAPK 介導通路[23]。研究證明ERKs、JNK 和p38MAPK 信號通路都能引起HepG2 細胞G2/M 周期阻滯,從而起到抗肝癌細胞增殖的效果[24]。PI3K/AKT 信號通路對細胞凋亡發揮著重要調控作用[25]。諸多研究將PI3K/AKT 信號通路作為治療慢性肝病的重要靶標[26]。孫佳等[27]證明槲皮素能下調肝癌細胞PI3K/AKT 通路,增強凋亡因子、降低抗凋亡蛋白的活性,從而促使肝癌細胞凋亡,發揮抗肝癌的作用。
綜上所述,黨參、海藻治療肝癌是多成分、多靶點、多生物過程而實現的,體現了中醫藥治病的整體理念,為后續相關研究提供實驗依據。本實驗通過MTT 法初步驗證巖藻甾醇可以抑制HepG2 肝癌細胞增殖,且與濃度呈正相關。后期將以上述實驗結果為基礎,繼續通過細胞和動物實驗深入研究,為黨參、海藻藥對抗肝癌提供扎實有力的實驗依據。

