血清HBV大、中、小表面蛋白檢測的臨床意義
莊 輝
北京大學 醫學部,北京 100191
1 HBV大表面蛋白(large HBV surface protein,LHBs)、中表面蛋白(middle HBV surface protein,MHBs)、小表面蛋白(small HBV surface protein,SHBs)的基因結構和特點
在自然條件下,HBV在冷凍電鏡下為直徑約52 nm的球狀顆粒[1-2],其外膜由3種外膜蛋白和不同脂類組成,包裹20面體核衣殼核心,該核心由240個核心蛋白亞單位組成,直徑約36 nm;病毒體偶爾也可含直徑為32 nm核衣殼核心,由180個核心亞單位組成。除病毒體外,被感染的肝細胞也分泌HBV表面蛋白的球狀顆粒(直徑為20 nm)和絲狀顆粒(圖1)。在高病毒血癥患者的血清中,表面蛋白顆粒數量一般較病毒體多1000~10 000倍。由于這些顆粒不含病毒DNA,因此無傳染性,只形成抗原血癥[3]。
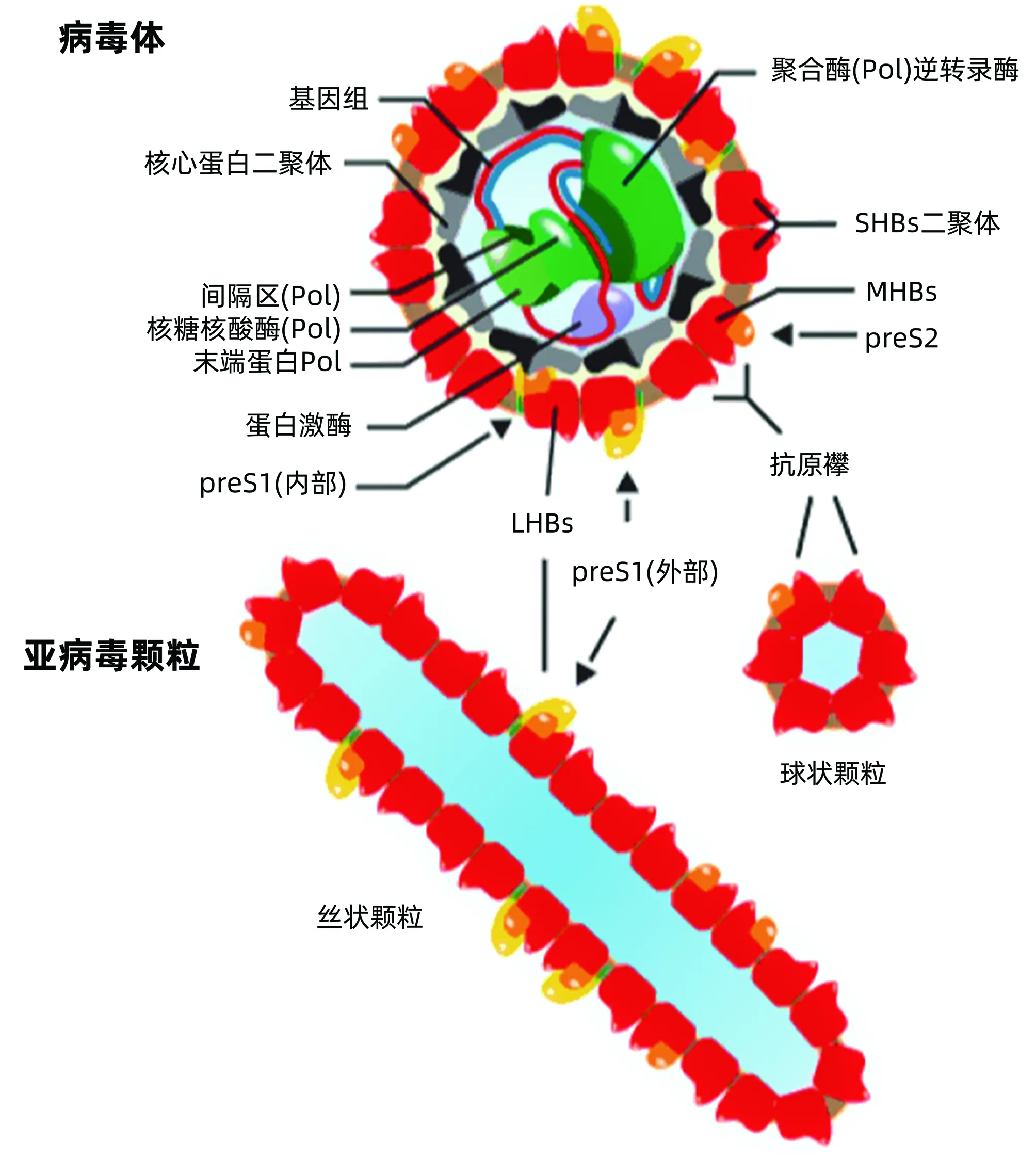
圖1 HBV體和亞病毒顆粒(引自參考文獻[3])
3種HBV表面蛋白均在一個開放讀碼框(open reading frame)內,由框內啟動子編碼,由2個不同的mRNA翻譯:一個2.4 kb mRNA翻譯LHBs,另一個2.1 kb mRNA翻譯MHBs和SHBs,并各自由特異的啟動子區轉錄,通過對蛋白表達的不同調節,合成大、中、小 3種表面蛋白。LHBs mRNA的preS1啟動子含有肝臟特異性轉錄因子(即肝細胞核因子1)的結合位點[4],其功能弱于preS/S啟動子[5]。
3種HBV表面蛋白基因由S、preS2和preS1組成,因HBV基因型不同,preS1可編碼108個、或118個、或119個氨基酸,為LHBs,在甘氨酸2位點為豆蔻酰化N末端,僅LHBs有此末端;preS2區長55個氨基酸,為MHBs,僅MHBs有乙酰化N末端;S區編碼226個氨基酸[3],為SHBs(圖2)。
LHBs在20 nm球狀顆粒上僅占1%~2%,但在絲狀顆粒和完整病毒體中高達20%,含受體結合域,為感染肝細胞所必須,應用核苷(酸)類似物(NUC)治療時,HBV量減少,LHBs也減少;MHBs在病毒體和2種亞單位顆粒中占5%~10%,其對HBV復制不起主要作用,在HBeAg 陽性患者中可檢測到,但在HBeAg 陰性患者中很少檢測到,表明MHBs與HBeAg表達相關;SHBs主要在HBV亞單位顆粒上,因此,NUC治療不導致SHBs減少[3]。
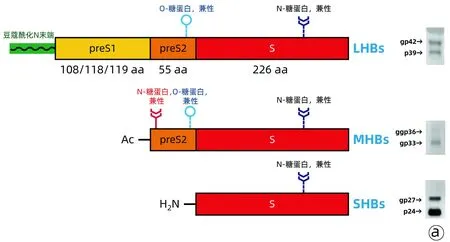
注:a,LHBs、MHBs和SHBs基因結構;b,preS1和preS2區域結構。感染性區(2~77 aa);感染-干擾豆蔻酰化前S1肽與假設的結合位點重疊;受體結合位點:關鍵的結合位點(9~18 aa),輔助的結合位點(28~48 aa);豆蔻酰化信號區(2~9 aa);形成外膜的關鍵區:preS1(92~108 aa)與preS2(1~5 aa)。
2 HBV LHBs、MHBs和SHBs的檢測方法
20世紀70年代初期,有研究[6-12]報告HBsAg是由若干種多肽組成,但由于研究方法不同,各報告的HBsAg多肽數量及其分子量不完全一致。1984、1987年,Heermann等[13-14]應用單克隆抗體蛋白印跡試驗,發現HBsAg由GP42、P39、GP36、GP33、GP27和P24等 6種蛋白組成,GP42和P39為LHBs,GP36和GP33為MHBs,GP27和P24為SHBs(圖2)。單克隆抗體A18/7為LHBs特異性抗體,其僅與LHBs起免疫反應,與MHBs和SHBs不起免疫反應;單克隆抗體Q19/10為MHBs特異性抗體,其僅與MHBs起免疫反應,與LHBs和SHBs不起免疫反應。因此,目前應用雙抗體夾心酶聯免疫吸附試驗(ELISA)檢測血清LHBs和MHBs,即分別用A18/7和Q19/10單克隆抗體包被酶標板微孔,加入待檢血清,如果待檢血清中含有LHBs或MHBs,即與包被于酶標板微孔中的單克隆抗體結合,再加入酶標記的A18/7或Q19/10單克隆抗體(A18/7-HRP或Q19/10-HRP),形成“包被抗體-抗原-酶標抗體”復合物,最后加入顯色劑顯色。根據顏色深淺度判定LHBs或MHBs含量。SHBs為間接計算獲得,即總HBsAg量減去LHBs和MHBs量[15-19]。
3 檢測血清HBV LHBs、MHBs和SHBs的臨床意義
3.1 LHBs、MHBs和SHBs水平與HBV基因型有關 Peiffer等[20]對德國HBeAg陰性(HBV DNA<100 000 IU/mL、ALT<2倍正常值上限)A~E基因型慢性乙型肝炎(CHB)患者血清LHBs、MHBs和SHBs組成進行了比較,除B基因型LHBs比例高于MHBs以外,A、C、D、E基因型MHBs比例均高于LHBs;B基因型LHBs比例高于其他基因型;D基因型MHBs比例最高(圖3)。
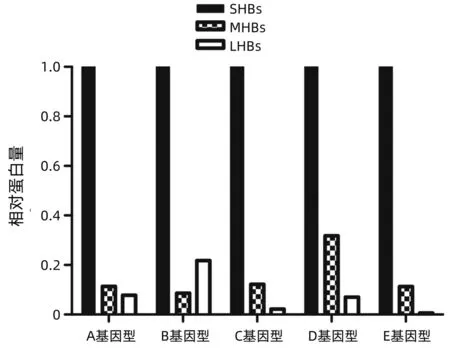
圖3 HBV A~E基因型患者LHBs、MHBs和SHBs組成比較(引自參考文獻[20])
Rinker等[17]比較了21例B基因型和49例C基因型HBeAg陽性CHB患者,B基因型患者LHBs比例較C基因型高2倍以上(13% vs 6%)。Pfefferkorn等[16]分析46例D和C基因型HBeAg陰性CHB患者血清LHBs、MHBs和SHBs組成,D基因型CHB患者LHBs和MHBs比例(7.1%±3.5%、3.1%±2.2%)均高于A基因型(5.4%±2.4%、2.4%±1.7%),與Peiffer等[20]報告基本一致。
3.2 LHBs和MHBs消失可預測急性乙型肝炎康復 Gerken等[21]對20例急性乙型肝炎患者動態檢測總HBsAg、LHBs和MHBs,其中16例檢測到LHBs,15例檢測到MHBs。其中,1例首份血清標本LHBs陽性但MHBs陰性患者,于發病后1周內HBeAg和總HBsAg均消失;50%的患者于發病后1周內MHBs陰轉,50%的患者于發病后4周內LHBs陰轉,所有MHBs和LHBs轉陰患者總HBsAg均消失,表明為自限性急性乙型肝炎。對1例無并發癥急性乙型肝炎患者的系列血清標本動態檢測HBV DNA、HBeAg、抗-HBe、LHBs、MHBs和總HBsAg,結果顯示,發病第1天即可檢測到HBV DNA、HBeAg、LHBs、MHBs和總HBsAg,于發病后第3周和第4周MHBs和LHBs先后轉陰,于發病后第4周HBV DNA檢測不到,第18周總HBsAg消失(圖4)。因此,MHBs和LHBs消失可預測急性乙型肝炎康復。Pfefferkorn等[19]報告,相較于LHBs,MHBs可以更早地預測HBsAg消失,與Gerken等[21]報告一致。
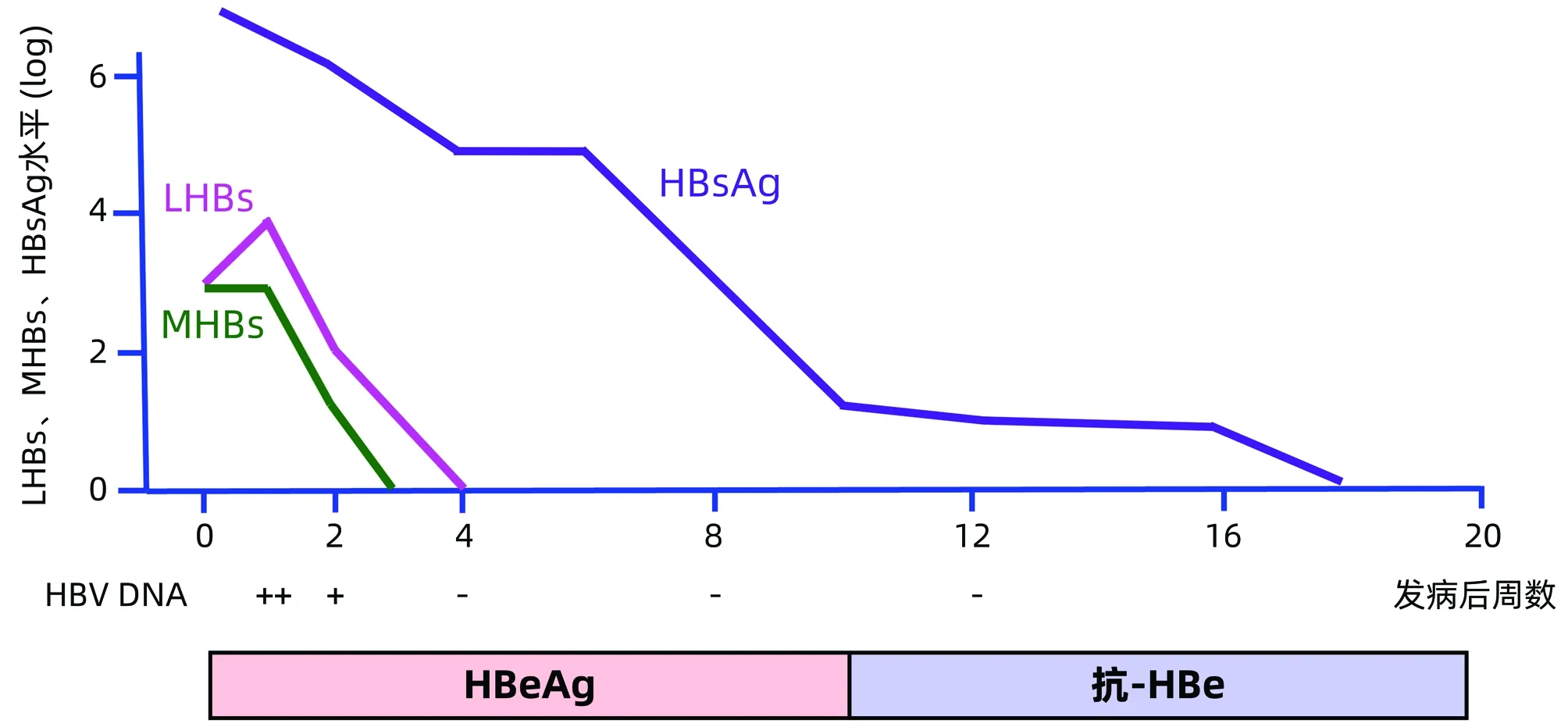
圖4 1例無并發癥急性乙型肝炎患者LHBs、MHBs和HBsAg動態變化(引自參考文獻[21])
3.3 LHBs和MHBs可預測CHB患者HBsAg消失 Pfefferkorn等[19]對83例CHB患者進行回顧性分析,其中64例經NUC治療,17例總HBsAg消失;19例經聚乙二醇干擾素α-2a(PEG-IFN-2a)治療48周,3例HBsAg消失;63例總HBsAg未消失作為對照,檢測總HBsAg消失與未消失組患者治療前和治療中血清LHBs、MHBs和SHBs水平。與總HBsAg未消失組比較,治療前,總HBsAg消失組的MHBs中位數水平較低(P=0.005);在治療過程中,總HBsAg消失組MHBs和LHBs比例快速下降,但無血清學應答或只有HBeAg血清學轉換的患者MHBs和LHBs比例無下降;經NUC獲得總HBsAg消失的所有患者于治療6個月時均檢測不到MHBs,平均在總HBsAg消失前(12.8±8.7)個月MHBs即檢測不到。應用受試者工作特征(ROC)曲線分析表明,NUC治療前MHBs比例是總HBsAg消失最早的預測指標[ROC曲線下面積(AUC)=0.726,P=0.019];經PEG-IFNα-2a治療獲得總HBsAg消失的患者,其MHBs和LHBs比例的動態變化相似。本研究表明,血清MHBs定量檢測可預測NUC治療應答。
Rinker等[17]對74例單用PEG-IFNα-2a和53例用PEG-IFNα-2a聯合拉米夫定治療HBeAg 陽性慢性乙性肝炎患者,動態檢測總HBsAg、LHBs、MHBs、SHBs水平,結果發現,LHBs、MHBs和SHBs預測PEG-IFNα-2a應答并不優于HBV DNA、HBeAg、總HBsAg,與Pfefferkorn等[19]報告一致。
Zhu等[15]對41例經恩替卡韋治療和21例經PEG-IFNα-2a治療的HBeAg陽性CHB患者于基線和抗病毒治療后4、12、24、36和48周定量檢測LHBs、HBsAg和HBV DNA,結果發現血清LHBs水平與HBV DNA和HBsAg呈正相關(相關系數分別為0.635和0.588);2組患者血清LHBs和HBV DNA水平下降顯著,但HBsAg下降緩慢;PEG-IFNα-2a組于治療第4周血清LHBs為88.46 ng/mL的病毒學應答的陽性和陰性預示值分別為88.9%和100%,優于預測恩替卡韋治療應答;聯合LHBs、總HBsAg和HBV DNA可更好地預測病毒學應答和血清學應答。該結果與Rinker等[17]和Pfefferkorn等[19]報告不完全一致,可能與檢測方法不同有關。因此,需對LHBs和MHBs檢測方法進行標準化。
3.4 治療過程中MHBs升高可能與肝細胞癌(HCC)有關 Brancaccio等[18]對30例乙型肝炎肝硬化患者隨訪38(12~48)個月,其中13例發生HCC。發生HCC患者與未發生HCC患者入組時的LHBs、MHBs和SHBs中位數水平無差異;在治療過程中,發生HCC患者與未發生HCC患者的SHBs下降>25%或持續穩定的比例相似,分別為58.3% vs 47.1%(SHBs下降>25%)和25% vs 29.4%(SHBs持續穩定);相反,發生HCC患者MHBs水平升高>25%比例高于未發生HCC患者,分別50% vs 11.8%(P=0.02);發生HCC患者與未發生HCC患者的LHBs動態變化無差異。因此,在治療過程中,動態檢測MHBs可確定發生HCC的風險,其機制尚需進一步研究。
3.5 LHBs或MHBs檢測可確定非活動期HBV感染 Pfefferkorn等[16]對14例急性HBV感染、44例非活動期HBV感染、46例HBeAg陰性CHB、68例HBeAg陽性CHB和11例HBV/HDV合并感染患者應用preS1和preS2 ELISA法檢測LHBs和MHBs,應用商品試劑定量檢測總的HBsAg,結果顯示,不同期HBV感染者的表面蛋白組成不同,非活動期患者的LHBs和MHBs比例低于其他各期(P<0.000 1);HBV/HDV合并感染患者的LHBs高于其他各期(P<0.000 1);ROC曲線分析表明,LHBs、MHBs和總HBsAg確定非活動期HBV感染的AUC分別為0.89、0.73和0.62,表明LHB和MHBs確定非活動期HBV感染的敏感度和特異度優于HBsAg。
4 小結
總HBsAg由LHBs、MHBs和SHBs組成;LHBs、MHBs和SHBs水平與HBV基因型有關;LHBs和MHBs消失提示急性乙型肝炎康復;MHBs顯著下降可預測NUC治療應答和HBsAg消失;治療過程中MHBs升高可能與HCC發生有關;非活動期HBV感染患者的MHBs和LHBs水平較低,用其確定非活動期HBV感染優于總HBsAg;HBV/HDV合并感染者LHBs水平較高。但當前,關于LHBs、MHBs和SHBs臨床意義的研究仍較少,亟需進一步探討。
利益沖突聲明:作者聲明不存在利益沖突。

