富馬酸丙酚替諾福韋對恩替卡韋經治后低病毒載量的慢性乙型肝炎患者的臨床療效
程海林,胡旭東,夏 冰,柏 濤,盧斯霞
武漢市金銀潭醫院 消化內科,武漢 430023
HBV感染是慢性乙型肝炎(CHB)、肝纖維化及肝細胞癌的重要病因。近年來,在長期接受規范的核苷(酸)類似物(NUC)治療患者中,即使應用恩替卡韋(ETV)或富馬酸替諾福韋酯等一線藥物,部分患者血清中HBV DNA仍持續或間歇性低水平檢測陽性(10~2000 IU/mL),卻并未發現與明確耐NUC相關的HBV pol/RT突變,而長期低病毒血癥狀態對肝臟慢性纖維化及癌變均有潛在風險[1],本研究旨在探討富馬酸丙酚替諾福韋(TAF)對ETV治療48周后仍處于低病毒血癥狀態的CHB患者的臨床療效及安全性。
1 資料與方法
1.1 研究對象 選取 2019 年3月—2020年10月在本院治療的CHB患者160例。納入標準:(1)符合CHB臨床診斷標準;(2)ETV抗病毒治療>48周;(3)HBV DNA定量10~2000 IU/mL;(4)耐藥芯片檢測未提示耐藥位點;(5)自愿參加研究。排除標準:(1)TAF治療禁忌證患者;(2)其他急、慢性病毒性肝炎(甲型、丙型、戊型、丁型肝炎及巨細胞、EB病毒性肝炎)、酒精性及非酒精性肝病、自身免疫性肝炎、腎病及HIV患者;(3)治療依從性差患者。
1.2 分組及方法 根據患者意愿換藥為TAF或繼續ETV治療,為減少選擇偏差的影響,經傾向評分匹配(PSM)分組將本院治療的160例CHB患者分成試驗組(80例)及對照組(80例)。對照組繼續口服ETV(批號:H20100129),0.5 mg/次,1次/d;試驗組停用ETV,換用TAF(批號:H20180060)口服,25 mg/次,1 次/d。2組患者均治療24周。
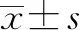
1.3 檢測指標及使用儀器 治療前后分別檢測血常規,肝、腎功能,HBsAg,HBV DNA定量及肝瞬時彈性成像,記錄PLT、ALT、AST、腎小球濾過率(eGFR)、HBeAg定量、HBV DNA定量及肝硬度值,并記錄FIB-4值。FIB-4值計算公式:年齡(歲)× AST(U/L)/PLT(109/L)× ALT(U/L)1/2。采用Sysmex XS-800i全自動血液分析儀檢測血常規,東芝TBA120全自動生化儀檢測血生化,Fibroscan肝瞬時彈性檢測儀檢測肝硬度值,HBV DNA用實時熒光定量聚合酶鏈式反應系統檢測(雅培試劑),檢測下限為10 IU/mL。HBV血清學標記物采用HBsAg quantitative Elecsys (羅氏診斷,德國)檢測,HBeAg>1.0 COI為陽性。
2 結果
2.1 一般資料 對照組男48例,女32例;體質量56.8~73.2 kg,平均63.5 kg;年齡25~48歲,平均35.82歲。試驗組男47例,女33例;體質量53.9~75.8 kg,平均64.7 kg;年齡24~51歲,平均35.57歲。兩組患者治療前一般資料比較差異均無統計學意義 (P值均>0.05),具有可比性(表1)。

表1 2組患者治療前一般資料比較
2.2 HBV DNA及 HBeAg轉陰率比較 試驗組HBV DNA轉陰率及HBeAg轉陰率與對照組相比較均明顯升高,差異均有統計學意義(P值均<0.05)(表2)。

表2 2組患者治療后HBeAg和HBV DNA轉陰率比較
2.3 治療前后 ALT、eGFR、FIB-4、肝硬度值水平變化情況比較 治療后,試驗組ALT、eGFR、FIB-4、肝硬度值較對照組有明顯改善,差異均有統計學意義(P值均<0.05)(表3)。

表3 2組治療后ALT、eGFR、FIB-4 和肝硬度值比較
2.4 安全性評價 試驗組患者治療后出現惡心3 例,腹脹2例,頭暈1例,對照組出現腹脹3例,頭暈2例,關節痛1例,失眠1例。治療過程中不良反應發生率試驗組 (7.50%)與對照組(8.75%)差異無統計學意義 (P>0.05)。
3 討論
國內外目前對CHB的低病毒血癥尚無統一的定義。2018年美國肝病學會(AASLD)指南[2]將低病毒血癥定義為HBV DNA<2000 IU/mL但仍能被檢測到的狀態(最低檢測下限為10 IU/mL)。近些年來,CHB患者雖然長期接受規范的NUC抗病毒治療,但部分患者仍存在低病毒血癥的問題,而大量研究[3-5]表明,長期的低病毒血癥狀態可能與肝纖維化進展甚至肝癌的發生有關。一項長期回顧性隊列研究[6]表明,長期接受ETV單藥治療的CHB患者中,低病毒血癥患者較持續病毒應答患者進展至肝硬化及發生肝癌的風險明顯升高。因此,對于長期處于低病毒血癥的CHB及時換用抗病毒效力更強,耐藥屏障更高的抗病毒藥物是非常必要的。但除AASLD以外的其他CHB管理指南尚未提出針對低病毒血癥的管理策略,我國 2019 版指南[7]也未提及低病毒血癥的管理建議。基于低病毒血癥對CHB患者潛在的危害性,近年來對于ETV經治的低病毒血癥采取了不同調整方案,如增加ETV的劑量、聯合富馬酸替諾福韋酯或聚乙二醇干擾素α(PEG-IFNα)[8-10]及換用TAF[6]治療等。
TAF是一種新型的核苷類逆轉錄酶抑制劑,TAF是在替諾福韋的結構上填加酰胺鍵,使其不能在血液中水解,而是通過被動擴散及肝臟主動攝取進入原代肝細胞,繼而被羧酸酯酶1水解為替諾福韋,發揮抗病毒作用[11]。因其半衰期長,肝臟靶向性強,血漿暴露量低,經血液循環進入腎小管的量也顯著降低,因此應用TAF可大大減輕CHB患者的腎小管損害[12],一直是歐洲肝病學會和AASLD推薦的治療CHB的一線藥物[13-14]。
本研究對ETV治療48周后低病毒血癥的CHB患者更換TAF治療發現,病毒載量轉陰率(96.25%)比較理想,提示TAF可有效控制低病毒血癥狀態。本研究中HBeAg血清學轉換率(34.78%)與對照組差異顯著,且明顯高于NUC治療CHB患者HBeAg陰轉率為20%的報道[9],考慮其原因可能與ETV經治后低HBeAg水平有關,真實原因有待進一步對比研究。
本研究中,試驗組較對照組肝功能改善明顯,FIB-4及肝硬度值也明顯改善,提示病毒有效控制后,肝臟炎性反應及肝纖維化明顯改善,因而能夠有效阻止和延緩病情進展。試驗組腎小球濾過率升高,可能與受損傷的腎小管在祛除損害因素后得到修復有關,提示TAF有更強的腎臟安全性,因此,對于ETV經治后仍伴有低病毒血癥的CHB患者,尤其是合并腎功能不全的患者,更換為TAF繼續抗病毒治療可能為最佳選擇。兩組治療過程中不良反應事件發生率無明顯差異,安全性較好。
綜上所述,TAF治療低病毒血癥的CHB患者,具有強效的抗病毒作用、較高的HBeAg陰轉率以及較好的ALT復常率和良好的腎臟安全性,總體安全性良好,但和其他的NUC一樣,不能有效清除cccDNA和整合的HBV DNA,HBsAg陰轉率低,依然需要長期用藥。TAF聯合PEG-IFNα是否能夠提高臨床療效尚有待進一步研究。
倫理學聲明:本研究方案于2021年7月19日經由武漢市金銀潭醫院倫理委員會審批,批號:KY-2021-07,所納入患者均簽署知情同意書。
利益沖突聲明:本研究不存在研究者、倫理委員會成員、受試者監護人以及與公開研究成果有關的利益沖突。
作者貢獻聲明:程海林、胡旭東責研究設計,資料分析及論文撰寫;夏冰、柏濤負責數據收集及統計分析;盧斯霞負責患者隨訪。

