血清熱休克蛋白90α對肝細胞癌經肝動脈化療栓塞術后生存的預測價值
陳 乾,姚輝華,李 波
1 西南醫科大學 臨床醫學院,四川 瀘州 646000;2 西南醫科大學附屬醫院 肝膽外科,四川 瀘州 646000; 3 成都市第一人民醫院 肝膽外科,成都 610041
肝細胞癌(HCC,以下簡稱肝癌)作為最常見的消化系統惡性腫瘤之一,發病率居惡性腫瘤第五位,死亡率居第三位[1]。TACE是治療肝癌的主要手段之一,然而由于療效差異較大,患者術后生存時間從13~43個月不等[2]。因此,及早評估肝癌患者TACE治療預后并制訂科學合理的個體化治療方案至關重要。
HSP90α是一種高度保守的蛋白質,作為一種廣譜腫瘤標志物,近年來在肝癌領域成為研究熱點。前期研究[3]證實,血清HSP90α可有效鑒別肝癌,有望成為診斷肝癌的潛在腫瘤標志物。進一步相關研究[4]結果顯示,血清HSP90α水平對肝癌患者預后有重要意義。本研究通過回顧性分析接受TACE治療肝癌患者的臨床資料,初步探討術前血清HSP90α水平對肝癌患者TACE術后生存時間的影響。
1 資料與方法
1.1 研究對象 回顧性分析2019年1月1日—2020年6月1日于西南醫科大學附屬醫院肝膽外科接受單一TACE治療的97例HCC患者的臨床資料。納入標準:(1)參照美國肝病學會肝細胞癌診療指南(2018 年版)[5]診斷為HCC;(2)尚未經過手術、介入、局部消融、靶向及放化療等抗腫瘤治療的首診患者。排除標準:(1)合并有其他腫瘤病史(如胃癌、結腸癌、乳腺癌等)的患者;(2)拒絕TACE治療或存在TACE治療禁忌證[5](肝功能Child-Pugh C級、ECOG評分3分及以上、預期生存期<3月、門靜脈主干栓塞、腎功能障礙、嚴重凝血功能障礙等)的患者;(3)治療過程中因嚴重并發癥(如:術后大出血、肺栓塞)死亡的患者;(4)合并有肺部感染、膽道感染等各臟器感染的患者;(5)合并有嚴重心、肺、腎功能障礙或者其他嚴重疾病的患者;(6)失訪患者。收集患者的年齡、性別、入院時的血常規(包括中性粒細胞、淋巴細胞及血小板計數)、血清前白蛋白、AFP、肝功能Child-Pugh分級、有無腫瘤壞死、美國東部腫瘤協作組體力狀態(Eastern Cooperative Oncology Group,ECOG)評分及BCLC分期。根據患者血常規結果,分別計算中性粒細胞與淋巴細胞比值(neutrophil to lymphocyte ratio,NLR)及血小板與淋巴細胞比值(platelet to lymphocyte ratio,PLR)。
1.2 血清HSP90α的檢測 所有患者入院當天抽取空腹靜脈血約10 mL,保存于5 ℃的冷藏箱中,2 h內送檢。血清HSP90α檢測采用酶聯反應法,設備購自中國煙臺普羅吉生物科技發展有限公司,試劑為配套試劑(測定范圍為:20~400 ng/mL,當檢測結果超過400 ng/mL,可采用樣本稀釋液提高稀釋倍數重新檢測)。所有操作步驟均嚴格按照產品使用說明書執行。
1.3 TACE治療方法 采用Seldinger技術引導微導管至腫瘤供血動脈,分別灌注洛鉑、氟尿嘧啶,乳化罌粟乙碘化油與鹽酸表柔比星后,與聚乙烯醇微球交叉栓塞供血動脈,直至造影明確腫瘤供血動脈栓塞。手術由同一位經驗豐富的肝膽科介入醫師完成,藥物劑量由手術醫師根據術中情況控制,根據患者腫瘤栓塞情況及肝功能Child-Pugh分級,可治療1~3次,間隔時間1個月。其中47例治療1次,26例2次,24例3次,平均1.76次。
1.4 術后隨訪 隨訪方式采用門診隨訪或電話隨訪,末次隨訪時間為2021年6月1日,生存時間為患者首次TACE治療至死亡時間或末次隨訪時間。
2 結果
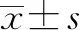
2.1 HSP90α水平與患者臨床病理特征的關系 97例肝癌患者中男性81例,女性16例,年齡(56.32±12.06)歲,BCLC分期A期5例,B期32例,C期60例;ECOG評分,0分59例,1分37例,2分1例。以患者血清HSP90α水平的中位數作為臨界值,將入組患者分為高水平組(HSP90α>135 ng/L,n=48)和低水平組(HSP90α≤135 ng/L,n=49)。血清HSP90α高水平組與低水平組患者的肝功能Child-Pugh分級、腫瘤壞死、BCLC分期及ECOG評分比較,差異均有統計學意義(P值均<0.05)(表1)。

表1 HSP90α高水平組與低水平組患者臨床病理特征
2.2 HSP90α水平與患者生存時間的關系 總體隨訪時間為12~30個月,至末次隨訪日期,總計有77例(79.4%)患者死亡,20例(20.6%)患者存活。總體中位生存時間為11.00個月(95%CI:9.39~12.61)。HSP90α高水平組中位生存時間為8.00個月(95%CI:5.74~10.26),HSP90α低水平組中位生存時間為17個月(95%CI:12.76~21.24),兩組差異有統計學意義(χ2=15.551,P<0.01)(圖1)。

圖1 HSP90α高水平組與低水平組的生存曲線
2.3 影響患者生存時間的單因素及多因素分析 通過單因素分析發現(表2),血清HSP90α水平、NLR、AFP、Child-Pugh分級、BCLC分期和ECOG評分均是肝癌患者TACE術后生存時間的影響因素(P值均<0.05)。將單因素分析中影響患者生存時間的因素納入Cox回歸模型進一步多因素分析顯示(表3),HSP90α水平及BCLC分期均是影響肝癌患者TACE術后生存時間的獨立影響因素(P值均<0.05)。

表2 影響患者生存時間的單因素分析

表3 影響患者生存時間的Cox多因素分析
3 討論
近年來,肝癌的發病率和死亡率居高不下。TACE作為治療中晚期肝癌的有效手段,廣泛應用于臨床[6-8]。但由于患者個體差異較大,TACE治療療效差異亦較大,使得部分患者難以取得生存獲益[9]。因此,術前評估肝癌患者TACE治療的預后,并為高風險患者制訂更積極的綜合治療方案,延長患者生存,是臨床工作者努力的方向。近年來,盡管Child-Pugh分級、BCLC分期、AFP水平及門靜脈侵犯等臨床指標預測肝癌患者TACE術后生存的價值不斷被報道[10-12],但目前尚缺乏能有效評估行TACE治療肝癌患者預后的方法[13],相關指標亦有待進一步探索。
HSP90α是熱休克蛋白90家族中的重要成員,不僅參與細胞信號轉導、蛋白質成熟及轉錄調控,在生物活動中至關重要[14];還在調節致癌蛋白的構象、穩定性和功能方面發揮作用,在腫瘤的發生發展中扮演重要角色[15-16]。相關研究[4,17-18]發現,血清HSP90α不僅可作為診斷肝癌的潛在腫瘤標志物,其高水平還與門靜脈侵犯、更大腫瘤、多發腫瘤、肝外轉移、腫瘤分期及腫瘤侵襲能力有關。本研究中,肝癌患者血清HSP90α水平與肝功能Child-Pugh分級、腫瘤壞死、BCLC分期及ECOG評分有關,與既往研究結果類似,說明血漿HSP90α水平對肝癌患者預后有重要意義。一直以來,磷酯酰肌醇3激酶/蛋白激酶B(phosphatidylinositol 3-kinase/protein kinase B,PI3K/AKt)信號通路在肝癌發生發展中的重要作用被廣泛認可,PI3K/AKt信號通路的激活可使多種靶基因、轉錄因子及其他調節因子磷酸化,促進腫瘤細胞生長、轉移[19]。近期報道[20]認為,HSP90α可通過激活PI3K/AKt信號通路提高肝癌細胞的侵襲能力。既往研究證實,基質金屬蛋白-2(matrix metalloprotein-2,MMP-2)可降解Ⅳ型膠原蛋白,破壞基底膜,與肝癌的侵襲及轉移能力呈正相關[21];HSP90α可促進細胞外MMP-2的成熟,進而提高肝癌的侵襲能力[22]。高水平HSP90α有助于肝癌進展,促進腫瘤轉移,進一步損害肝臟[23],致使患者預后不良。
本次研究結果顯示,HSP90α水平及BCLC分期是影響肝癌患者TACE術后生存時間的獨立危險因素(P值均<0.05),HSP90α高水平的肝癌患者中位生存時間較低水平患者短(P<0.01),提示血清HSP90α高水平的肝癌患者TACE術后風險更高、生存時間更短、預后更差。近期國內一項納入手術病例的研究[24]認為,HSP90α水平是影響肝癌患者術后生存的獨立因素,與患者預后相關。另一項有關TACE治療的相關研究[25]發現,HSP90α是肝癌患者術后生存的獨立影響因子。因此,HSP90α在評估肝癌患者TACE術后生存中具有較好的價值,HSP90α或將成為評估TACE治療肝癌患者預后的潛在指標。
綜上,血清HSP90α水平是影響TACE治療肝癌患者術后生存時間的獨立因素,有望成為評估TACE治療肝癌患者預后的潛在指標,可協同BCLC分期等其他臨床指標預測或評估肝癌患者TACE術后生存情況。本研究尚存在一些不足。本研究系單中心研究,樣本量較少,難以設置HSP90α水平梯度進一步分析,分組亦不夠細致,希望在今后的研究中能進行多中心、大樣本、分層分組研究,進一步深入探討HSP90α在TACE治療肝癌患者預后中的價值;此外,HSP90α水平臨界值的選取也需擴大樣本量進一步探討,更為精準地評價HSP90α在TACE治療肝癌患者預后中的價值,為臨床工作提供參考。
倫理學聲明:本研究方案于2021年4月16日經由西南醫科大學附屬醫院倫理委員會批準,批號:KY2021109,所有患者均知情同意。
利益沖突聲明:本研究不存在研究者、倫理委員會成員、受試者監護人以及與公開研究成果有關的利益沖突。
作者貢獻聲明:陳乾負責研究思路或設計,參與研究數據獲取分析;陳乾、李波、姚輝華參與起草或修改文章關鍵內容。

