非小細胞肺癌惡性胸水中PD-L1(22C3)的表達及其臨床意義
覃玲艷,顧冬梅,郭凌川,馬文霞,尤志群,楊紅麗
肺癌是最常見的惡性腫瘤。2018年國際癌癥研究機構發布的肺癌發病率為11.6%,其病死率占癌癥死亡總例數的18.4%,是癌癥死亡的主要原因[1]。肺癌中大部分為非小細胞肺癌(non-small cell lung cancer, NSCLC),惡性胸水是中晚期NSCLC較為常見的并發癥。胸水脫落細胞學檢查具有微創、快捷、可重復等優點,已廣泛應用于臨床病理診斷中。免疫治療是目前癌癥研究的熱點,其中程序性死亡受體-1(programmed death receptor-1, PD-1)/程序性死亡配體-1(programmed death-ligand 1, PD-L1)通路在腫瘤免疫逃逸中發揮重要作用,PD-L1是PD-1的一種配體,兩者均可影響腫瘤免疫微環境[2]。本文采用免疫組化EnVision兩步法檢測PD-L1(22C3)在149例NSCLC惡性胸水細胞蠟塊中的表達,并分析其表達與NSCLC臨床病理學特征、ALK(D5F3)表達、EGFR突變及患者總生存期的關系,旨在探討PD-L1(22C3)在NSCLC惡性胸水中的檢測意義。
1 材料與方法
1.1 材料收集2017年12月~2019年12月蘇州大學附屬第一醫院診治的149例伴有惡性胸水并經細胞蠟塊免疫組化證實為轉移性NSCLC的標本,其中男性72例,女性77例,男女比約為1 ∶0.94,患者年齡37~92歲,中位年齡65歲;腫瘤直徑≤3 cm者93例,>3 cm者56例;吸煙者55例,非吸煙者94例。由兩名有經驗的病理醫師依據WHO(2015)呼吸系統腫瘤分類標準對各病例進行分類[3]:其中腺癌144例,鱗狀細胞癌5例;高+中分化癌79例,低分化癌70例;有淋巴結轉移76例,無淋巴結轉移73例;伴遠處臟器轉移61例;有胸膜累及74例,無胸膜累及75例;接受放、化療54例,未接受放、化療95例。
1.2 細胞學涂片及沉渣包埋對臨床送檢的200 mL胸腔積液行常規細胞學涂片及沉渣包埋,經10%中性福爾馬林固定,常規脫水,石蠟包埋,4 μm厚切片,鏡下觀察,評估細胞蠟塊腫瘤細胞數均大于100個,行后續相關檢測。
1.3 免疫組化采用全自動Benchmark XT檢測系統進行免疫組化EnVision兩步法染色。選擇Ep-CAM、CK7、TTF-1、Napsin A、CK5/6、p40、p63、Calretinin、Ki-67等抗體作為轉移性肺癌的診斷和鑒別診斷指標。同時檢測ALK(D5F3)、PD-L1(22C3)的表達。所有抗體及試劑盒均購自北京中杉金橋生物公司。PD-L1(22C3)抗體稀釋比為1 ∶50,試劑盒購自南京大鳥生物公司,染色步驟嚴格按照試劑盒說明書進行。
1.4 基因檢測采用ARMS法(廈門艾德生物公司)檢測惡性胸水細胞蠟塊中EGFR基因18、19、20及21號外顯子的突變情況。具體檢測步驟參照試劑盒說明書。
1.5 結果判讀Ep-CAM、CK7、Napsin A、CK5/6、Calretinin陽性定位于細胞質,呈棕黃色,TTF-1、p40、p63、Ki-67陽性定位于細胞核,呈棕黃色。ALK(D5F3)判讀參照《Ventana anti-ALK(D5F3)評分解讀指南》[4]。PD-L1(22C3)評分判讀標準:只判讀活的腫瘤細胞,至少讀取100個形態良好的腫瘤細胞,任何可見的線性細胞膜染色(部分或完整)及細胞質和細胞膜染色均為陽性;細胞膜無染色,僅細胞質染色為陰性。由兩名有經驗的病理科診斷醫師進行ALK(D5F3)、PD-L1(22C3)結果判讀。腫瘤陽性細胞百分比TPS=(PD-L1陽性腫瘤細胞數/腫瘤細胞總數)×100%。
1.6 統計學分析采用SPSS 16.0軟件對數據進行統計學分析。表達的差異性采用χ2檢驗、校正χ2檢驗,相關性采用Spearman秩相關檢驗,組間生存率采用Kaplan-Meier法繪制生存曲線,Log-rank檢驗比較生存曲線的差異性,以P<0.05為差異有統計學意義。
2 結果
2.1 NSCLC患者惡性胸水中癌細胞的鑒定NSCLC惡性胸水中轉移性腺癌脫落細胞學HE染色,鏡下見癌細胞呈散在或團片狀分布,極性紊亂,核質比增高,胞質豐富,含有黏液,細胞核呈圓形、卵圓形或不規則形,核染色質深染呈粗顆粒狀,部分細胞可見核仁(圖1);胸水沉渣包埋細胞塊HE染色(圖2A),轉移性腺癌相關免疫指標的表達:Ep-CAM表達于腫瘤細胞胞膜或胞質(圖2B)、Napsin A表達于腫瘤細胞胞質(圖2C)、TTF-1表達于腫瘤細胞胞核(圖2D)、PD-L1表達于腫瘤細胞胞膜或胞質(圖2E)。NSCLC惡性胸水中轉移性鱗狀細胞癌脫落細胞學HE染色,鏡下見癌細胞大小不一,呈團片狀分布,極性紊亂,核質比增高,胞質較少,細胞核呈圓形或不規則形,核染色質濃染呈粗顆粒狀(圖3);胸水沉渣包埋細胞塊HE染色(圖4A),轉移性鱗狀細胞癌相關免疫指標的表達:CK5/6表達于腫瘤細胞胞膜或胞質(圖4B)、p40表達于腫瘤細胞胞核(圖4C)、p63表達于腫瘤細胞胞核(圖4D)、PD-L1表達于腫瘤細胞胞膜或胞質(圖4E)。

圖1 NSCLC惡性胸水(轉移性腺癌)的HE染色 圖2 NSCLC惡性胸水(轉移性腺癌):A.胸水細胞塊HE染色;B.Ep-CAM呈胞膜或胞質陽性,EnVision兩步法;C.Napsin A呈胞質陽性,EnVision兩步法;D.TTF-1呈胞核陽性,EnVision兩步法;E.PD-L1呈胞膜和胞質陽性,EnVision兩步法 圖3 NSCLC惡性胸水(轉移性鱗狀細胞癌)的HE染色 圖4 NSCLC惡性胸水(轉移性鱗狀細胞癌):A.胸水細胞塊HE染色;B.CK5/6呈胞膜或胞質陽性,EnVision兩步法;C.p40呈胞核陽性,EnVision兩步法;D.p63呈胞核陽性,EnVision兩步法;E.PD-L1呈胞膜和胞質陽性,EnVision兩步法
2.2 NSCLC患者惡性胸水中PD-L1(22C3)蛋白的表達在149例NSCLC患者惡性胸水中,PD-L1(22C3)陽性定位于細胞膜和(或)細胞質,17例PD-L1(22C3)陽性率<1%(圖5A);29例為1%~49%(圖5B),17例≥50%(圖5C),總陽性率為42.3%。

圖5 PD-L1(22C3)蛋白在NSCLC惡性胸水中的表達,EnVision兩步法:A.PD-L1陽性率<1%;B.PD-L1陽性率1%~49%;C.PD-L1陽性率≥50%
2.3 NSCLC惡性胸水中PD-L1(22C3)表達與臨床病理特征的關系在NSCLC患者惡性胸水中,PD-L1(22C3)表達與腫瘤分化程度、有無淋巴結轉移、有無其他臟器轉移相關(P<0.05);PD-L1(22C3)的陽性率區間分布與腫瘤直徑、有無其他臟器轉移相關(P<0.05,表1)。

表1 PD-L1(22C3)表達與NSCLC臨床病理特征的關系[n(%)]
2.4 NSCLC惡性胸水中PD-L1(22C3)表達與ALK(D5F3)表達及EGFR突變的相關性PD-L1(22C3)在NSCLC患者惡性胸水中的表達與ALK(D5F3)表達呈正相關(rs=11.49,P<0.05),與EGFR突變無關(rs=0.004,P>0.05,表2)。

表2 NSCLC中PD-L1(22C3)的表達與ALK(D5F3)表達及EGFR突變的相關性(n=97)
2.5 NSCLC惡性胸水中PD-L1(22C3)表達與患者預后的關系對149例伴有惡性胸水的NSCLC患者進行隨訪,PD-L1(22C3)陽性患者與陰性患者的中位總生存期分別為6和12個月,差異有顯著性(P<0.05,圖6)。
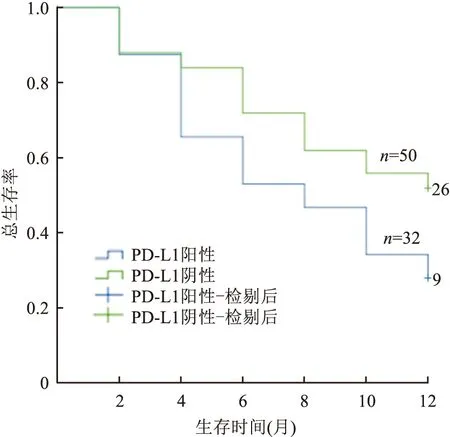
圖6 NSCLC惡性胸水中PD-L1(22C3)表達與患者總生存期的關系
3 討論
中晚期NSCLC常伴發惡性胸水,且部分患者存在基因靶向治療受限或治療后耐藥等瓶頸,預后較差[5]。免疫治療是目前癌癥研究的新領域,PD-1/PD-L1通路在腫瘤免疫逃逸中起主導作用[6],通過對其相關通路機制的研究,可為臨床NSCLC的免疫治療提供新的理論依據。
目前,多種腫瘤中均發現PD-L1的表達,包括NSCLC、乳腺癌、胃癌、神經膠質瘤、黑色素瘤等。李毓飛等[7]報道,在胃癌組織中PD-L1的表達高于癌旁組織,且其表達與腫瘤直徑和分化程度相關,提示腫瘤預后不良。Lin等[8]研究證實,PD-1、PD-L1(22C3)在肺癌組織中的表達與腫瘤直徑、有無淋巴結轉移及組織學分級相關。本實驗結果表明,在149例NSCLC患者惡性胸水中,PD-L1(22C3)的總陽性率為42.3%,其表達與腫瘤分化程度、有無淋巴結轉移、有無其他臟器轉移相關(P<0.05)。提示PD-L1(22C3)參與NSCLC的發生、發展,可作為NSCLC惡性進展和預后評估的重要分子標志物。
隨著對NSCLC靶向治療的研究與進展,以ALK、EGFR為驅動基因的分子靶向治療已在臨床成熟應用,相關研究結果表明對于ALK融合蛋白陽性且EGFR基因突變的病例,采用EGFR-TKI及克唑替尼治療均表現為臨床獲益[9]。本實驗結果顯示,PD-L1(22C3)與ALK(D5F3)的表達呈正相關(P<0.05),而與EGFR突變無關(P>0.05)。了解基因之間的相互作用有助于理解臨床腫瘤靶向治療時出現的耐藥機制。
通過對抗PD-1/PD-L1通路免疫逃逸機制的研究,目前已有多種PD-1/PD-L1單克隆抗體治療性藥物問世,其中PD-L1單克隆抗體包括Nivolumb、Atezolizumab、Pembrolizumab、Durvalumab等[10]。前期臨床研究結果表明在抗PD-1/PD-L1免疫治療中,腫瘤細胞PD-L1高表達患者的中位總生存期、1年生存率、客觀緩解率等比PD-L1低表達患者有明顯優勢[11]。本實驗發現PD-L1(22C3)陽性患者與陰性患者的中位總生存期差異有顯著性(P<0.05),檢測PD-L1(22C3)在晚期NSCLC惡性胸水中的表達,可為臨床腫瘤免疫治療提供一定的參考依據。
綜上所述,PD-L1(22C3)參與NSCLC的發生、發展,其表達與腫瘤進展和不良預后相關。行胸水細胞蠟塊PD-L1(22C3)免疫組化檢測具有簡單易行、快速實用、微創并可重復檢查等優點。檢測中晚期NSCLC患者惡性胸水中PD-L1(22C3)的表達,對NSCLC患者的鞏固治療與預后監測均具有重要的臨床應用價值。

