基于網絡藥理學和動物實驗探討紅曲治療腦小血管病的作用機制
孫紀,蘇恒,聊曉玉,桂文琪,方媛,韓嵐*,彭代銀*(1. 安徽中醫藥大學藥學院,合肥 230000;2. 中藥復方安徽省重點實驗室,合肥 230000;3. 安徽道地中藥材品質提升協同創新中心,合肥230000;. 安徽康和中藥科技有限公司,安徽 亳州 236000)
腦小血管病(CSVD)是直徑介于40~200 μm的腦血管病變引起的綜合征[1],臨床表現為腦白質病變、腦微出血、腔隙性梗死等[2]。研究表明,CSVD與癡呆、卒中等疾病關系密切,約有45%的血管性癡呆和20%的缺血性卒中由CSVD引起[3]。西醫治療CSVD主要通過溶栓藥、降壓藥、抗血小板等早期干預,效果不佳且不良反應較大。中醫理論認為CSVD屬“絡病”范疇,治法為扶正祛邪,中藥治絡病效果顯著,不良反應較少,已成為近年來的研究熱點。
紅曲(red yeast rice,HQ)為藥食兩用中藥,生產歷史悠久,藥用記載始于《飲膳正要》[4]。2020年版《中國藥典》[5]記載紅曲為紫色紅曲霉Monascus purpureusWent寄生于粳米發酵而得。其味甘,性溫,無毒,歸肝、脾經,有活血化瘀、通經活絡功效。現代藥理研究表明,紅曲成分中MonacolinK及其衍生物、紅曲色素、γ-氨基丁酸等具有顯著的降血脂、降血壓、神經保護、改善微循環等作用[6-7],提示紅曲可作為治療CSVD的潛在藥物。
網絡藥理學是基于生物信息學、藥理學等的綜合性學科,通過構建生物分子互作網絡,系統化詮釋分子作用機制[8]。因此,本研究基于網絡藥理學研究方法構建紅曲“藥物-成分-靶點”網絡,獲取相關成分、靶點、通路信息,通過動物實驗對網絡藥理學結果進行驗證,探討紅曲治療CSVD的物質基礎和分子機制。
1 資料與方法
1.1 網絡藥理學
1.1.1 數據庫及軟件 TCMSP(https://tcmsp-e.com/)、SwissTargetPrediction數 據 庫(http://www.swisstargetprediction.ch/)、GeneCards數 據庫(https://www.genecards.org/)、OMIM數 據庫(https://omim.org/)、CTD數據庫(https://ctdbase.org/)、DisGeNET數據庫(https://www.disgenet.org/)、Uniprot(https://www.uniprot.org/)、STRING 11.0數 據 庫(https://string-db.org/)、DAVID 6.8數據庫(https://david.ncifcrf.gov/home.jsp)、CytoScape 3.7.1軟件。
1.1.2 紅曲成分及作用靶點收集 通過PubChem、SwissTargetPrediction及文獻收集紅曲成分,根據里賓斯基五規則進行篩選。將紅曲成分文件上傳至SwissTargetPrediction數據庫,選擇物種為“Homo sapiens”,獲取紅曲作用靶點,并對靶點進行去重整合。
1.1.3 CSVD疾病靶點篩選 將“Cerebral Small Vessel Disease”輸入GeneCards數據庫、OMIM數據庫、CTD數據庫、DisGeNET數據庫尋找CSVD疾病靶點。
1.1.4 交集靶點Venny分析 登入Venny 2.1網站,將CSVD疾病靶點信息輸入List 1,紅曲作用靶點輸入List 2,獲取交集靶點信息。
1.1.5 構建紅曲“藥物-成分-靶點”網絡 利用CytoScape 3.7.1軟件構建藥物紅曲“藥物-成分-靶點”網絡,通過CytoScape 3.7.1軟件工具NetworkAnalyzer對網絡進行拓撲參數分析,收集主要活性成分及靶點度值(degree)信息。
1.1.6 PPI網絡構建 將“1.1.4”項下的交集靶點導入STRING 11.0數據庫,限定物種為“Homo sapiens”,置信度區間大于0.4,構建PPI網絡。利用CytoScape 3.7.1軟件進行參數分析,以大于Degree均值為條件篩選關鍵靶點。
1.1.7 GO和KEGG富集分析 選擇獲取的關鍵靶點導入DAVID 6.8數據庫,限定物種為“Homo sapiens”,獲取GO、KEGG富集結果并進行可視化分析。
1.2 動物實驗
1.2.1 儀器與試藥 酶標儀(318MC,美國賽默飛世爾科技公司);石蠟包埋機(YB-7B,孝感市亞光醫用電子技術有限公司);離心機(LC-4016,安徽中科中佳科學儀器有限公司);恒溫振蕩培養箱(BHWY-100BC,常州杰博森儀器有限公司);紅曲(批號:210201,毫州市京皖中藥飲片廠),經安徽中醫藥大學中藥資源室鑒定為正品。TNF-α、IL-6、IL-1β試劑盒(睿信生物公司);尼莫地平(批號:200108,亞寶藥業集團股份有限公司)。
1.2.2 動物 SPF級雄性大鼠,體質量 200~230 g[杭州醫學院,生產許可證號:SCXK(浙)2019-0002,動物倫理編號:AHUCM-rats-2021051]。
1.2.3 紅曲水提液的制備 取紅曲原料藥,粉碎,過篩,加入藥物總量10倍的水煎煮1 h后,過濾并保留濾液,再加入藥物總量8倍的水煎煮1 h,過濾并保留濾液;合并兩次濾液,旋轉蒸發濃縮成3 g·kg-1的提取液備用。
1.2.4 CSVD模型大鼠的復制 健康雄性SD大鼠200~230 g,麻醉后鈍性分離右頸總動脈(common carotid artery,CCA)采用絲線于右側CCA遠、近心端進行永久性結扎,距離約1.5 cm左右,結扎完成后縫合皮膚,放回籠中飼養。7 d后永久性結扎左側CCA,操作步驟同上。假手術組僅分離CCA,不進行結扎操作。大鼠出現癲癇、偏癱等異常行為則判斷模型復制成功。
1.2.5 實驗分組與給藥 大鼠隨機分為6組,每組10只,分別為假手術組、模型組、紅曲高劑量組(3 g·kg-1)、紅曲中劑量組(1.5 g·kg-1)、紅曲低劑量組(0.75 g·kg-1)、尼莫地平組(20 mg·kg-1),按體質量灌胃給藥,假手術組、模型組灌胃等量生理鹽水,每日一次,連續30 d。
1.2.6 Morris水迷宮實驗 水迷宮為黑色圓形水池,等分為4個象限,平臺置于象限中。將大鼠面向池壁從4個象限隨機選擇入水點,記錄其在2 min內尋找并爬上平臺所需時間,即逃避潛伏期;撤除平臺,從平臺所在象限對側選入水點,觀察其在2 min內穿越平臺次數。實驗為期5 d,前4 d用于訓練大鼠,第5日進行實驗。
1.2.7 海馬CA1區病理觀察 各組大鼠麻醉后,從胸膛部剪開暴露心臟,用4%多聚甲醛進行灌注,灌注完成后將大鼠斷頭取腦,隨后用石蠟包埋、切片,于顯微鏡下觀察海馬CA1區。
1.2.8 指標檢測 大鼠麻醉后腹主動脈取血,靜置30 min,3000 r·min-1離心10 min,收集上層血清,根據試劑盒說明書進行檢測。
1.2.9 Western blot實驗 大鼠斷頭處死,迅速取出海馬組織置于冰上,剪碎,按每20 mg組織加入150~250 μL裂解液的比例加入裂解液,勻漿直至完全裂解。裂解后的樣品4℃、12 000 r·min-1離心15 min,取上清液,定量后貯存于-80℃冰箱用于蛋白測定,結果用Image J軟件進行灰度分析。
1.3 統計分析方法
各組數據用SPSS 23.0軟件進行分析,結果用“均數±標準差(±s)”表示,多組間數據采用單因素方差分析,兩兩比較采用LSD-t檢驗,P<0.05或P<0.01表示差異有統計學意義。
2 結果
2.1 網絡藥理學預測研究
2.1.1 紅曲成分及作用靶點收集 經篩選共獲得43種紅曲主要成分,包含Monacolin類、紅曲色素類、十氫萘衍生物、有機酸等;將紅曲成分上傳至SwissTargetPrediction數據庫預測,去重合并共獲得391個潛在作用靶點。
2.1.2 紅曲作用靶點及CSVD疾病及預測“Cerebral Small Vessel Disease”作為檢索信息輸入GeneCards、OMIM、DisGeNET、CTD數據庫尋找治療CSVD疾病的靶點,去重合并后共獲得1126個疾病靶點。
2.1.3 交集靶點收集 登入Venny 2.1網站,將1126個CSVD疾病靶點和391個紅曲作用靶點信息輸入列表,共獲得交集靶點91個。
2.1.4 藥物-成分-靶點網絡 如圖1所示,利用CytoScape 3.7.1軟件構建“藥物-成分-靶點”網絡,運用軟件內置工具NetworkAnalyzer對網絡進行拓撲參數分析,收集活性成分度值(Degree)信息,結果顯示Degree值排名靠前的成分有Monacolin K、Monacolin J、Ankaflavin等,提示上述成分可能在紅曲治療CSVD過程中起重要作用。

圖1 紅曲“藥物-成分-靶點”網絡圖Fig 1 Red yeast rice “drug-component-target” network
2.1.5 PPI網絡構建 將交集靶點導入STRING數據庫,構建PPI網絡,如圖2所示。結果顯示PPI網絡有91個節點,752條邊,平均Degree值為16.7,EGFR、MAPK1、ESR1、CLCX8等大于Degree均值關鍵靶點共計37個,提示這些蛋白可作為紅曲治療CSVD的關鍵靶點。

圖2 PPI網絡圖Fig 2 Protein-protein interaction network
2.1.6 GO和KEGG富集分析 運用DAVID 6.8數據庫進行GO和KEGG分析,GO分析結果涉及171個生物過程,33個細胞組分和51個分子功能,選取排名前10結果繪制條形柱狀圖,如圖3所示;結果表明紅曲中的活性成分可能通過參與神經炎癥、細胞增殖、信號轉導等過程發揮治療CSVD作用。KEGG分析得到104個通路,選取排名前20通路繪制氣泡圖,如圖4所示。去除與CSVD無關的通路,獲得PI3K-Akt信號通路、RAS信號通路等。其中,PI3K-Akt信號通路的count值最大,表示該差異蛋白富集顯著性較大。近年來的研究已證實PI3K-Akt信號通路在癡呆類腦血管病中的治療是通過調節下游靶蛋白mTOR、GSK3β等的活性,介導神經元細胞凋亡、增殖過程,因此選擇PI3K-AKT-mTOR通路作為機制研究對象。
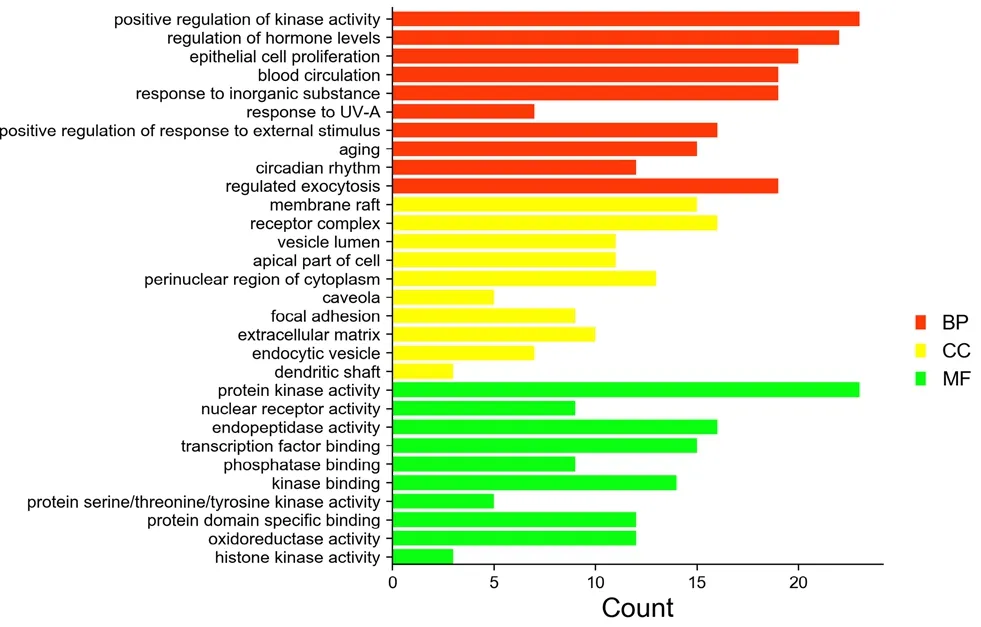
圖3 GO富集分析Fig 3 GO enrichment analysis

圖4 KEGG通路富集分析Fig 4 KEGG pathway enrichment analysis
2.2 動物實驗
2.2.1 Morris水迷宮實驗 如表1所示,與假手術組比較,模型組大鼠逃避潛伏期顯著延長(P<0.01),撤去平臺后穿越平臺次數明顯減少(P<0.01),表明模型復制成功;與模型組相比,紅曲高、中劑量組及尼莫地平組逃避潛伏期顯著減少,穿越平臺次數明顯增加(P<0.05或P<0.01),紅曲低劑量組差異無統計學意義。
表1 紅曲對CSVD 模型大鼠逃避潛伏期和穿越平臺次數的影響( ±s,n=10)Tab 1 Effect of HQ on the escape latency and the number of crossing platforms in CSVD model rats ( ±s,n=10)

表1 紅曲對CSVD 模型大鼠逃避潛伏期和穿越平臺次數的影響( ±s,n=10)Tab 1 Effect of HQ on the escape latency and the number of crossing platforms in CSVD model rats ( ±s,n=10)
注:與假手術組比較,##P<0.01;與模型組比較,*P<0.05,**P<0.01。Note:Compared with the sham group,##P<0.01;compared with the model group,*P<0.05,**P<0.01.
組別 劑量 逃避潛伏期/s 穿越平臺次數/次假手術組 - 14.37±5.39 8.30±1.42模型組 - 39.92±4.59## 2.10±1.37##紅曲高劑量組 3 g·kg-1 24.16±5.29** 5.20±1.40**紅曲中劑量組 1.5 g·kg-1 29.86±4.81** 4.50±1.96*紅曲低劑量組 0.75 g·kg-1 37.27±7.80 2.70±1.55尼莫地平組 20 mg·kg-1 23.96±4.98** 5.40±1.80**
2.2.2 大鼠海馬組織病理 如圖5所示,假手術組大鼠海馬CA1區細胞排列整齊,形態完整,可明顯觀察到核仁和胞漿;與假手術組相比,模型組大鼠海馬CA1區細胞排列松散,細胞較為稀疏,細胞多呈不規則形,核仁和胞漿界限不清晰,提示造模成功;與模型組相比,紅曲各劑量組及尼莫地平組大鼠海馬CA1區細胞排列趨于規則、緊密,病變程度均有明顯改善,表明紅曲對CSVD模型大鼠的海馬組織具有一定的保護作用。

圖5 CSVD模型大鼠海馬CA1區HE染色(×200)Fig 5 HE staining of CA1 area of hippocampus in CSVD model rats(×200)
2.2.3 指標測定 如表2所示,與假手術組相比,模型組大鼠血清中TNF-α、IL-6、IL-1β含量顯著增高(P<0.01);與模型組相比,紅曲高、中劑量組及尼莫地平組大鼠血清中TNF-α、IL-6、IL-1β含量顯著降低(P<0.05或P<0.01),紅曲低劑量組大鼠血清中TNF-α、IL-1β水平顯著降低(P<0.05),IL-6水平無統計學意義。表明紅曲能顯著降低CSVD大鼠血清中炎癥因子水平,顯示出紅曲具有良好的抗炎作用。
表2 紅曲對CSVD大鼠血清中TNF-α、IL-6、IL-1β炎癥因子的影響( ±s,n=10)Tab 2 Effect of HQ on TNF-α,IL-6 and IL-1β inflammatory factors in serum of CSVD rats ( ±s,n=10)

表2 紅曲對CSVD大鼠血清中TNF-α、IL-6、IL-1β炎癥因子的影響( ±s,n=10)Tab 2 Effect of HQ on TNF-α,IL-6 and IL-1β inflammatory factors in serum of CSVD rats ( ±s,n=10)
注:與假手術組比較,##P<0.01;與模型組比較,*P<0.05,**P<0.01。Note:Compared with the sham group,##P<0.01;compared with the model group,*P<0.05,**P<0.01.
組別 TNF-α/(ng·L-1)IL-6/(ng·L-1)IL-1β/(ng·L-1)假手術組 312.58±24.79 46.32±6.27 28.71±7.62模型組 491.52±39.89## 70.23±12.37## 42.37±4.36##紅曲高劑量組 372.62±45.59** 54.41±10.77** 30.44±6.23**紅曲中劑量組 394.23±20.35* 62.32±13.27** 32.25±5.27*紅曲低劑量組 412.61±49.58* 68.45±5.86 34.36±5.86*尼莫地平組 336.65±25.95** 50.37±10.68** 31.25±4.68**
2.2.4 Western blot實驗 蛋白電泳結果如圖6所示。結果顯示,與假手術組比較,模型組大鼠海馬區PI3K、Akt、mTOR蛋白表達水平均顯著降低(P<0.01);與模型組比較,紅曲高、中劑量組及尼莫地平組PI3K、Akt、mTOR蛋白表達水平顯著升高(P<0.01),紅曲低劑量組PI3K、mTOR表達水平顯著升高(P<0.05),Akt蛋白表達水平差異無統計學意義。結果表明紅曲可通過調節PI3KAKT-mTOR通路,調控神經細胞增值、凋亡過程,發揮對于CSVD模型大鼠的治療作用。
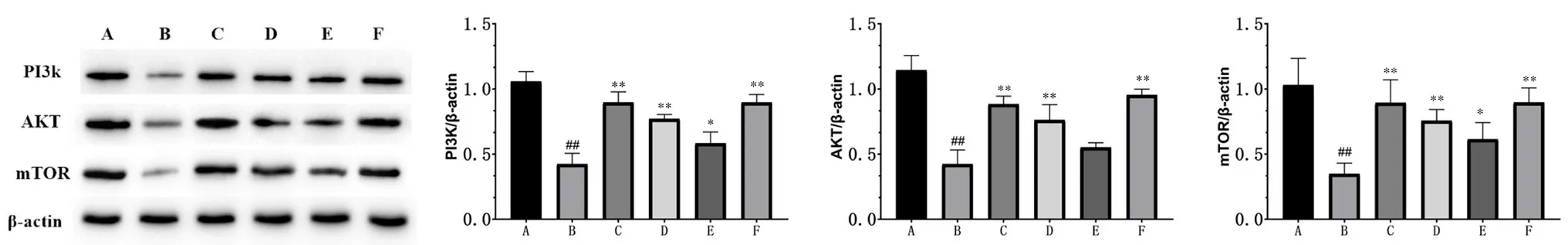
圖6 各組大鼠海馬區PI3K,Akt,mTOR蛋白表達水平圖( ±s,n=3)Fig 6 Expression levels of PI3K,Akt and mTOR protein in the hippocampus of each group of rats( ±s,n=3)
3 討論
CSVD是臨床常見的腦血管疾病,與高血脂、高血壓等危險因素關系密切[9]。中醫理論尚未明確定義CSVD,通常認為其屬于絡病,病位在腦,由濁邪入血,入髓傷髓所致[10]。臨床治療CSVD應以活血化瘀、化濁益髓的中藥為主[11]。紅曲具有活血化瘀、健脾消食的功效,臨床上常用的中成藥血脂康、脂必妥均以紅曲為主要成分,廣泛用于治療高血脂、動脈粥樣硬化、心腦血管病等[12-14],可作為治療CSVD的潛在藥物。
本研究運用網絡藥理學方法篩選獲得Monacolin K、Ankaflavin、GABA等43個紅曲活性成分,PIK3CA、MTOR、MAPK1等1126個腦小血管病靶點;PPI網絡分析共發現91個節點,752條邊,平均Degree值為16.7,獲得EGFR、MAPK1、ESR1等37個關鍵靶點;GO分析結果涉及171個生物過程、33個細胞組分、51個分子功能,主要涉及神經炎癥、信號轉導、細胞增殖等。研究表明,神經炎癥在腦血管疾病的發展中起重要作用,降低相關炎癥因子如TNF-α、IL-6、IL-1β等水平,可改善血腦屏障通透性,減輕腦組織損傷,促使大腦結構功能恢復正常[15-16]。KEGG分析結果得到104個通路,主要有PI3K-Akt、Rap1、RAS通路等,PI3K-Akt通路研究較為廣泛,其在腦卒中、血管性癡呆等疾病的治療中起著重要作用。Qi等[17]研究發現3-丁基苯酞(NBP)能通過激活PI3K/Akt信號通路抑制CSVD大鼠神經細胞凋亡,恢復細胞基本功能,提高大鼠學習記憶能力。Chen等[18]研究表明人參皂苷Rg1可通過PI3K/Akt/mTOR信號通路增加缺血性卒中后血管內皮生長因子的表達,促進腦內血管生成,改善腦血流量。
本研究選擇不同劑量紅曲干預CSVD模型大鼠,探究其作用機制,對網絡藥理學研究結果進行驗證。Morris水迷宮實驗結果顯示,紅曲能顯著縮短CSVD大鼠的逃避潛伏期,增加穿越平臺次數,表明紅曲顯著改善CSVD模型大鼠的短期學習記憶能力;HE病理切片結果顯示紅曲治療組大鼠海馬CA1區細胞形態完整、排列整齊,核仁和胞漿界限清晰,不同劑量紅曲治療組海馬CA1區病變程度均有明顯改善,高、中劑量效果較為明顯;網絡藥理學GO分析結果表明,紅曲治療CSVD可能與神經炎癥、細胞增殖、信號轉導等生物過程相關,其中神經炎癥在CSVD發展過程起重要作用。生化指標結果顯示,不同劑量紅曲治療組可顯著降低CSVD模型大鼠血清TNF-α、IL-6、IL-1β炎癥因子水平,其效果呈劑量依賴性;網絡藥理學研究結果顯示紅曲中Monacolin類、紅曲色素等為其活性成分,本研究結果中紅曲能顯著降低TNF-α、IL-6、IL-1β水平可能與上述成分有關。KEGG分析結果顯示,涉及CSVD的有PI3K-Akt、RAS、Rap1信號通路等。研究表明PI3K-Akt信號通路可通過調節下游靶蛋白mTOR活性,參與自噬清除β淀粉樣蛋白的沉積、恢復細胞功能等發揮神經保護作用[17-18];Western blot結果表明,與假手術組相比,模型組PI3K、AKT、mTOR蛋白水平顯著降低;與模型組相比,紅曲治療組可不同程度增加PI3K、AKT、mTOR蛋白水平,提示紅曲可通過上調PI3K/AKT/mTOR蛋白的表達,參與調控神經元細胞增殖、分化、凋亡等發揮治療CSVD的作用。
綜上,通過網絡藥理學和分子對接,構建紅曲治療CSVD的成分、疾病、作用靶點、相關通路之間的復雜網絡關系,展現了中藥多成分、多靶點、多途徑的治療優勢。通過Morris水迷宮,海馬組織HE染色,TNF-α、IL-6、IL-1β炎癥因子檢測,PI3K、AKT、mTOR蛋白測定等實驗驗證網絡藥理學預測結果,初步揭示了紅曲治療CSVD的藥效機制,可為后期深入探究其治療CSVD機制提供理論依據。

