牙齦卟啉單胞菌來(lái)源的脂多糖通過(guò)X盒結(jié)合蛋白1調(diào)控脂肪細(xì)胞胰島素信號(hào)通路的機(jī)制研究
陸佳藝伍倩琪陳伊燕葉蕾蕾蘇媛,
1.南方醫(yī)科大學(xué)順德醫(yī)院(佛山市順德區(qū)第一人民醫(yī)院)口腔中心,順德528300;
2.南方醫(yī)科大學(xué)口腔醫(yī)院牙周科,廣州510280
牙周炎是口腔中常見(jiàn)的慢性炎癥性疾病,主要表現(xiàn)為牙齒周?chē)浻步M織的炎性破壞[1]。研究發(fā)現(xiàn),牙周炎對(duì)2型糖尿病(type 2 diabetes mellitus,T2DM)的發(fā)生發(fā)展具有促進(jìn)作用[2-3],但具體機(jī)制尚不清楚。牙齦卟啉單胞菌(Porphyromonas gingivalis,P.gingivalis)是牙周炎的主要致病菌,其外膜蛋白脂多糖(lipopolysaccharid,LPS)是主要毒力因子。牙齦卟啉單胞菌脂多糖(Porphyromonas gingivalis-lipopolysaccharid,P.gingivalis-LPS)通過(guò)破潰的牙周組織進(jìn)入血循環(huán)到達(dá)遠(yuǎn)隔器官,影響機(jī)體的糖代謝水平[4-5]。而作為糖代謝的重要靶組織脂肪組織,是否受牙周炎的影響目前尚未證實(shí)。
近年來(lái),內(nèi)質(zhì)網(wǎng)應(yīng)激(endoplasmic reticulum stress,ERS)的關(guān)鍵信號(hào)分子X(jué)盒結(jié)合蛋白1(Xbox binding protein 1,XBP1)被證實(shí)可受P.gingivalis-LPS的調(diào)控[6],而XBP1同時(shí)又參與胰島素信號(hào)通路的傳導(dǎo)[7-8]。因此,XBP1有望成為P.gingivalis-LPS調(diào)控大鼠脂肪細(xì)胞胰島素信號(hào)的關(guān)鍵靶點(diǎn)。本實(shí)驗(yàn)通過(guò)體外構(gòu)建pLVX-XBP1載體、p-LVX-XBP1-RNAi載體分別轉(zhuǎn)染到大鼠原代脂肪細(xì)胞中,采用P.gingivalis-LPS刺激轉(zhuǎn)染后的細(xì)胞,驗(yàn)證XBP1能否調(diào)控大鼠脂肪細(xì)胞胰島素信號(hào)通路關(guān)鍵蛋白胰島素受體底物(insulin receptor substrate,IRS)-1、下游磷脂酰肌醇依賴(lài)性激酶(phosphoinositide dependent protein kinase,PDK)-1和蛋白激酶B(protein kinase B,PKB),又稱(chēng)AKT的表達(dá)。
1 材料和方法
1.1 材料
4~5周雄性SD大鼠(南方醫(yī)科大學(xué)動(dòng)物實(shí)驗(yàn)中心),杜氏培養(yǎng)液(Dulbecco’s Modified Eagle Medium/F12,DMEM/F12)、胎牛血清(Gibco公司,美國(guó)),油紅O試劑盒(南京建成生物工程研究所),多聚賴(lài)氨酸(Sigma公司,美國(guó)),P.gingivalis-LPS(InvivoGen公司,美國(guó)),pLVX-XBP1慢病毒、pLVX-XBP1-RNAi慢病毒、逆轉(zhuǎn)錄試劑盒、實(shí)時(shí)定量聚合酶鏈反應(yīng)(real-time quantitative polymerase chain reaction,RT-qPCR)試劑盒(重慶威斯騰生物醫(yī)藥科技有限責(zé)任公司),ab245314型IRS-1抗體(Abcam公司,美國(guó)),3848T型p-PDK-1抗體、4060T型p-AKT抗體(CST公司,美國(guó))。
1.2 實(shí)驗(yàn)方法
1.2.1 分離培養(yǎng)原代大鼠脂肪細(xì)胞 斷頸處死SD大鼠后,在無(wú)菌條件下剪開(kāi)大鼠腹部皮毛,取附睪脂肪組織,采用眼科剪將脂肪組織剪成0.5~1.0 mm大小的均勻顆粒,采用0.1%Ⅰ型膠原酶消化液在37℃條件下消化脂肪組織,每隔5 min手動(dòng)振蕩30 s以促進(jìn)消化,消化時(shí)間為60 min,直到脂肪組織被消化成乳糜液樣液體。將消化后的乳糜樣液體加入4 mL PBS,輕輕吹打混勻,通過(guò)200目孔徑的不銹鋼細(xì)胞篩過(guò)濾,濾液轉(zhuǎn)移入離心管中,向離心管中加入10 mL PBS洗細(xì)胞3次。以250g·min-1的轉(zhuǎn)速離心5 min,用吸管吸出上清液,加入另一試管中,加入PBS 10 mL洗細(xì)胞,再次離心、去除下清液,重復(fù)此步驟2次。再用10 mL含20%胎牛血清的DMEM/F12細(xì)胞培養(yǎng)液洗滌并重懸細(xì)胞,調(diào)整密度為2×106個(gè)·mL-1,取50μL加入每孔2 mL的培養(yǎng)液的6孔板中,蓋以20 mm×20 mm多聚賴(lài)氨酸處理過(guò)的無(wú)菌蓋玻片,放37℃、5%CO2飽和濕度培養(yǎng)箱中培養(yǎng)。
1.2.2 油紅O鑒定原代大鼠脂肪細(xì)胞 用油紅O固定液固定原代大鼠脂肪細(xì)胞10~15 min,吸出固定液后,放于流通的空氣中10~15 min,加入新配制好的油紅O染色劑浸染15 min;吸出染色液,加入60%異丙醇漂洗20~30 s,流水沖洗,蒸餾水稍微清洗;吸出蒸餾水,加入蘇木素染色液,復(fù)染核2 min;去除蘇木素染色液,流水沖洗,晾干;200倍倒置光學(xué)顯微鏡觀察拍照。
1.2.3 蛋白質(zhì)印跡(Western Bolt)檢測(cè)P.gingivalis-LPS刺激脂肪細(xì)胞后IRS-1、磷酸化PDK-1(p-PDK-1)、磷酸化AKT(p-AKT)的表達(dá) 將培養(yǎng)48 h的脂肪細(xì)胞接種于6 cm培養(yǎng)皿24 h后,分為空白對(duì)照組和刺激組,空白對(duì)照組為100 ng·mL-1P.gingivalis-LPS刺激的大鼠脂肪細(xì)胞0 h;刺激組為100 ng·mL-1P.gingivalis-LPS分別刺激大鼠脂肪細(xì)胞4、8、12、24 h。刺激后提取細(xì)胞總蛋白,用BCA蛋白質(zhì)定量法檢測(cè)總蛋白濃度,每個(gè)上樣孔等量蛋白(20μg)通過(guò)聚丙烯酰胺凝膠電泳分離蛋白后,10%脫脂牛奶搖床封閉1 h;將含有目的蛋白IRS-1、p-PDK-1、p-AKT和內(nèi)參蛋白β肌動(dòng)蛋白(β-actin)的聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)放于相應(yīng)的抗體中,4℃孵育過(guò)夜;用含Tween 20的Tris緩沖鹽水(Tris buffered saline with Tween 20,TBST)漂洗后,加入辣根過(guò)氧化物酶標(biāo)記的免疫球蛋白(immunoglobulin,Ig)G二抗室溫孵育1 h。TBST漂洗,化學(xué)發(fā)光顯影并拍照。用Image J圖像分析軟件對(duì)各組條帶行灰度值分析,以β-actin作為內(nèi)參,目的蛋白與內(nèi)參蛋白的灰度比值為IRS-1、p-PDK-1、p-AKT蛋白表達(dá)的相對(duì)表達(dá)水平。
1.2.4 RT-qPCR檢測(cè)過(guò)表達(dá)、干擾XBP1慢病毒載體轉(zhuǎn)染的脂肪細(xì)胞 過(guò)表達(dá)XBP1慢病毒載體pLVX-XBP1、干擾XBP1慢病毒載體pLVX-XBP1-RNAi由重慶威斯騰生物醫(yī)藥科技有限責(zé)任公司構(gòu)建。實(shí)驗(yàn)分為空白對(duì)照組、空載過(guò)表達(dá)慢病毒(pLVX-NC1)、過(guò)表達(dá)XBP1慢病毒(pLVX-XBP1)、空載干擾慢病毒(pLVX-NC2)、干擾XBP1慢病毒(pLVX-XBP1-RNAi)。
將pLVX-NC1、p-LVX-XBP1、pLVX-NC2、pLVX-XBP1-RNAi分別轉(zhuǎn)染到大鼠原代脂肪細(xì)胞后,分別接種于6 cm培養(yǎng)皿24 h后,用TRIzol法分別提取5個(gè)實(shí)驗(yàn)組細(xì)胞的總RNA,并測(cè)定RNA濃度和純度。用逆轉(zhuǎn)錄試劑盒將RNA逆轉(zhuǎn)錄成互補(bǔ)DNA,RT-qPCR檢測(cè)轉(zhuǎn)染后的脂肪細(xì)胞內(nèi)XBP1的mRNA表達(dá)水平。
XBP1引物序列:上游AAAGAAAGCCCGGATGAGC,下游ATTCATCCCCAAGCGTGTCC。甘油醛-3-磷酸脫氫酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)引物序列:上游AGTGCCAGCCTCGTCTCATA,下游GAGAAGGCAGCCCTGGTAAC。擴(kuò)增條件均為95℃30 s;然后反復(fù)95℃5 s,60℃30 s循環(huán)40次。以2-ΔΔCT公式法計(jì)算目的基因XBP1的mRNA相對(duì)表達(dá)水平。
1.2.5 Western Bolt檢測(cè)在過(guò)表達(dá)XBP1、干擾XBP1慢病毒轉(zhuǎn)染脂肪細(xì)胞后P.gingivalis-LPS刺激下IRS-1、p-PDK-1、p-AKT的表達(dá) 本實(shí)驗(yàn)采用以下4組:pLVX-NC1、pLVX-XBP1、pLVX-NC2、pLVX-XBP1-RNAi分別轉(zhuǎn)染大鼠原代脂肪細(xì)胞,分別接種于6 cm培養(yǎng)皿24 h,通過(guò)100 ng·mL-1P.gingivalis-LPS刺激轉(zhuǎn)染后的大鼠脂肪細(xì)胞4、8、12、24 h,用BCA法檢測(cè)蛋白濃度。
每個(gè)上樣孔皆取等量蛋白(20μg)通過(guò)聚丙烯酰胺凝膠電泳分離蛋白后,10%脫脂牛奶搖床封閉1 h。將含有目的蛋白IRS-1、p-PDK-1、p-AKT和內(nèi)參蛋白β-actin的PVDF膜放于相應(yīng)的抗體中,4℃孵育過(guò)夜。TBST漂洗后,加入辣根過(guò)氧化物酶標(biāo)記的IgG二抗室溫孵育1 h。TBST漂洗,化學(xué)發(fā)光顯影并拍照。用Image J圖像分析軟件對(duì)各組條帶行灰度值分析,以β-actin作為內(nèi)參,目的蛋白與內(nèi)參蛋白的灰度比值為IRS-1、p-PDK-1、p-AKT蛋白表達(dá)相對(duì)表達(dá)水平。
1.3 統(tǒng)計(jì)學(xué)分析
實(shí)驗(yàn)數(shù)據(jù)用GraphPad Prism 7軟件進(jìn)行分析,實(shí)驗(yàn)數(shù)據(jù)以均數(shù)±標(biāo)準(zhǔn)差表示,兩組間單因素比較采用t檢驗(yàn),組間雙因素比較采用雙因素方差分析,P<0.05為差異有統(tǒng)計(jì)學(xué)意義。研究數(shù)據(jù)均來(lái)自3次或3次以上獨(dú)立實(shí)驗(yàn)。
2 結(jié)果
2.1 大鼠脂肪細(xì)胞原代分離培養(yǎng)以及油紅O鑒定脂肪細(xì)胞
原代細(xì)胞培養(yǎng)的形態(tài)觀察顯示,細(xì)胞貼壁后為類(lèi)圓形如圖1所示。培養(yǎng)2周后,胞內(nèi)出現(xiàn)脂肪顆粒積聚,經(jīng)過(guò)油紅O染色,確定細(xì)胞分化成為脂肪細(xì)胞如圖2所示。
圖1 原代培養(yǎng)的大鼠脂肪細(xì)胞 倒置光學(xué)顯微鏡 ×200Fig 1 Primary cultured rat adipocytes inverted optical microscope ×200
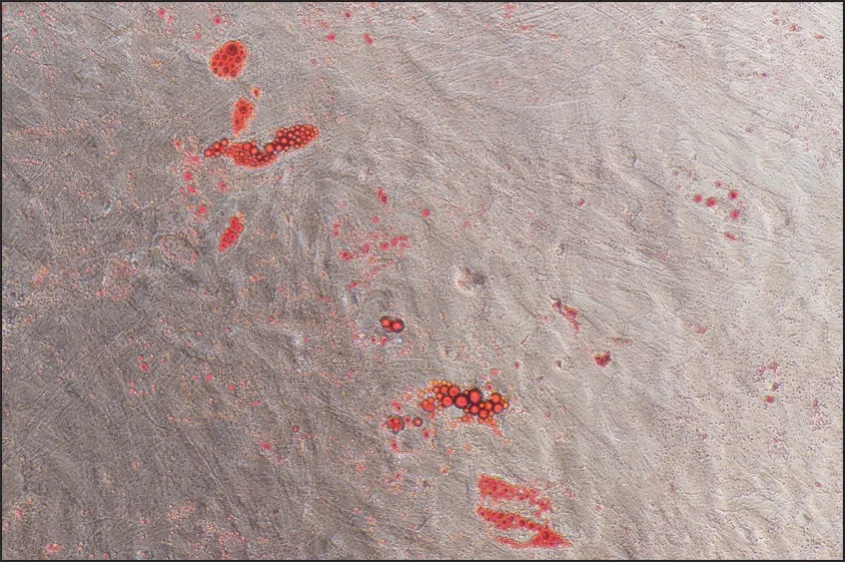
圖2 油紅O染色鑒定原代大鼠脂肪細(xì)胞 ×200Fig 2 Primary rat adipocytes were identified by red staining O×200
2.2 Western Bolt檢測(cè)P.gingivalis-LPS刺激脂肪細(xì)胞后胰島素信號(hào)通路蛋白表達(dá)結(jié)果
Western Bolt檢測(cè)P.gingivalis-LPS刺激脂肪細(xì)胞0、4、8、12、24 h后,胰島素信號(hào)通路IRS-1、p-PDK-1、p-AKT的蛋白表達(dá)如圖3A所示,圖3B~D所示刺激4、8、12、24 h后,IRS-1、p-AKT、p-PDK-1蛋白表達(dá)與空白對(duì)照組0 h相比呈明顯下降趨勢(shì),差異有統(tǒng)計(jì)學(xué)意義(P<0.05)。統(tǒng)計(jì)結(jié)果表明,脂肪細(xì)胞在P.gingivalis-LPS刺激下,胰島素信號(hào)通路蛋白IRS-1、PDK-1、AKT受抑制,隨著刺激時(shí)間的推移,IRS-1、p-PDK-1、p-AKT蛋白的表達(dá)呈下降趨勢(shì)。
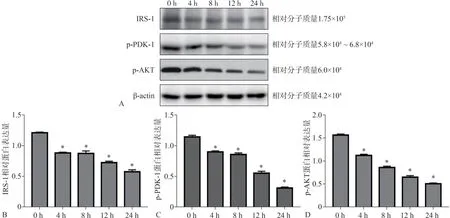
圖3 Western Bolt檢測(cè)P.gingivalis-LPS刺激脂肪細(xì)胞后IRS-1、p-PDK-1、p-AKT的蛋白表達(dá)結(jié)果Fig 3 Western Bolt detected theprotein expression of adipocytes IRS-1,p-PDK-1 and p-AKT after stimulated by P.gingivalis-LPS
2.3 RT-qPCR檢測(cè)過(guò)表達(dá)、干擾XBP1慢病毒載體轉(zhuǎn)染脂肪細(xì)胞結(jié)果
結(jié)果如圖4所示,pLVX-XBP1組XBP1 mRNA相對(duì)表達(dá)量為2.06±0.01,與pLVX-NC1組(1.03±0.01)相比明顯升高,差異有統(tǒng)計(jì)學(xué)意義(P<0.05);pLVX-XBP1-RNAi組XBP1 mRNA相對(duì)表達(dá)量為0.53±0.03,與pLVX-NC2組(1.12±0.1)相比明顯降低,差異有統(tǒng)計(jì)學(xué)意義(P<0.05)。綜上,p-LVX-XBP1、pLVX-XBP1-RNAi成功構(gòu)建。
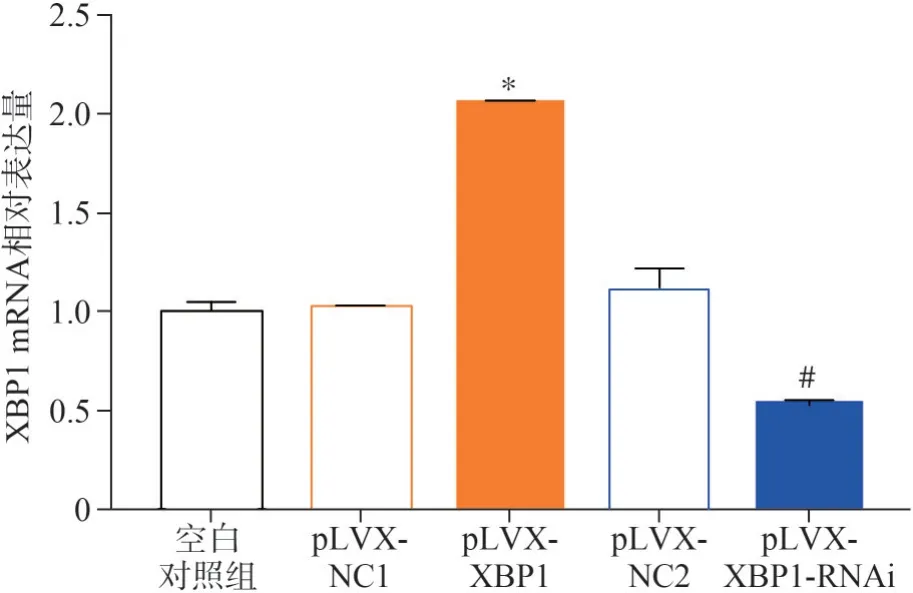
圖4 qRT-PCR檢測(cè)慢病毒轉(zhuǎn)染脂肪細(xì)胞結(jié)果Fig 4 qRT-PCR detected the transfection results of lentivirus into adipocytes
2.4 Western Bolt檢測(cè)在pLVX-XBP1、pLVX-XBP-1-RNAi轉(zhuǎn)染脂肪細(xì)胞后P.gingivalis-LPS刺激下胰島素信號(hào)通路的表達(dá)
pLVX-XBP1轉(zhuǎn)染脂肪細(xì)胞后,Western Bolt檢測(cè)胰島素信號(hào)通路IRS-1、p-PDK-1、p-AKT的蛋白表達(dá)如圖5A所示,圖5B~E所示,P.gingivalis-LPS刺激4 h后,pLVX-XBP1組IRS-1的蛋白表達(dá)明顯高于pLVX-NC1組,差異有統(tǒng)計(jì)學(xué)意義(P<0.05);pLVX-XBP1組p-PDK-1的蛋白表達(dá)略低于pLVX-NC1組,差異無(wú)統(tǒng)計(jì)學(xué)意義;pLVX-XBP1組p-AKT的蛋白表達(dá)明顯低于pLVX-NC1組,差異有統(tǒng)計(jì)學(xué)意義(P<0.05)。刺激8、12 h后,pLVX-XBP1組IRS-1、p-PDK-1、p-AKT的蛋白表達(dá)明顯高于pLVX-NC1組,差異有統(tǒng)計(jì)學(xué)意義(P<0.05)。刺激24 h后,pLVX-XBP1組IRS-1的蛋白表達(dá)明顯高于pLVX-NC1組,差異有統(tǒng)計(jì)學(xué)意義(P<0.05);pLVX-XBP1組p-PDK-1、p-AKT的蛋白表達(dá)明顯低于pLVX-NC1組,差異有統(tǒng)計(jì)學(xué)意義(P<0.05)。
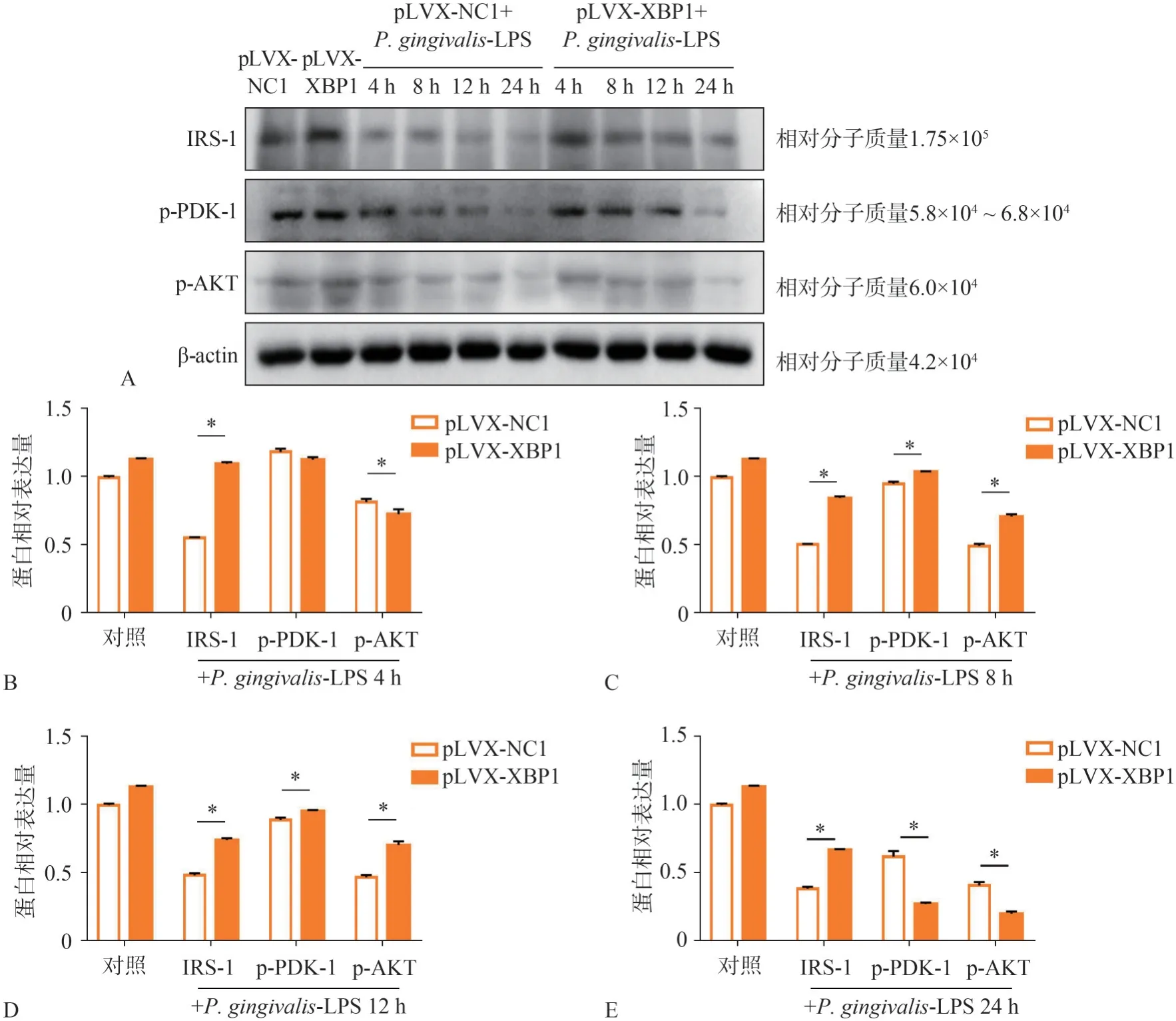
圖5 Western Bolt檢測(cè)pLVX-XBP1轉(zhuǎn)染脂肪細(xì)胞后P.gingivalis-LPS刺激下IRS-1、p-PDK-1、p-AKT的蛋白表達(dá)結(jié)果Fig 5 Western Bolt detected theexpression of protein IRS-1,p-PDK-1 and p-AKT,stimulated by P.gingivalis-LPSafter pLVX-XBP1 transfecting adipocytes
pLVX-XBP1-RNAi轉(zhuǎn)染脂肪細(xì)胞后,Western Bolt法檢測(cè)胰島素信號(hào)通路IRS-1、p-PDK-1、p-AKT的蛋白表達(dá)如圖6A所示,如圖6B~E所示,P.gingivalis-LPS刺激4、8、12、24 h后,pLVXXBP1-RNAi組IRS-1、p-PDK-1、p-AKT的蛋白表達(dá)皆明顯低于pLVX-NC2組,差異有統(tǒng)計(jì)學(xué)意義(P<0.05)。
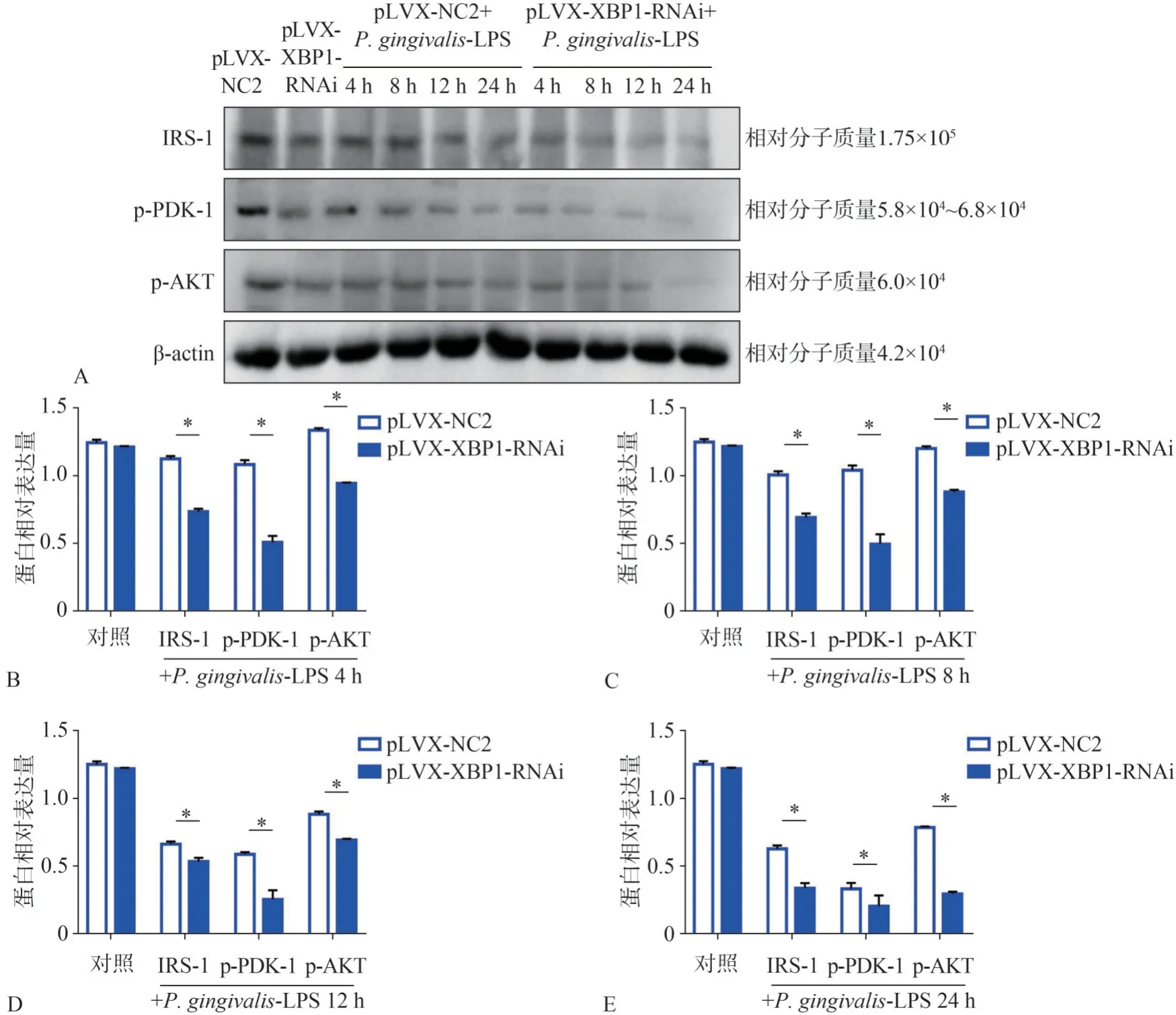
圖6 Western Bolt檢測(cè)pLVX-XBP1-RNAi轉(zhuǎn)染脂肪細(xì)胞后P.gingivalis-LPS刺激下IRS-1、p-PDK-1、p-AKT的蛋白表達(dá)結(jié)果Fig 6 Western Bolt detected the expression of protein IRS-1,p-PDK-1 and p-AKT,stimulated by P.gingivalis-LPSafter pLVX-XBP1-RNAi transfecting adipocytes
3 討論
流行病學(xué)調(diào)查[9]顯示,牙周炎的嚴(yán)重程度與T2DM的糖代謝水平相關(guān)。在臨床上,牙周基礎(chǔ)治療能降低糖化血紅蛋白和空腹血糖,改善患者的糖代謝水平[10]。因此,牙周炎對(duì)T2DM的影響意義重大,是目前交叉學(xué)科領(lǐng)域的研究熱點(diǎn)之一。
T2DM的重要病理機(jī)制是胰島素抵抗(insulin resistance,IR),它是指肝臟、脂肪和骨骼肌等胰島素靶組織對(duì)胰島素敏感性下降,胰島素信號(hào)傳導(dǎo)受阻,造成糖代謝異常[11]。其中,脂肪組織胰島素信號(hào)受阻對(duì)全身糖代謝水平有重要影響[12],是誘導(dǎo)機(jī)體發(fā)生IR的起始[13]。研究[14]發(fā)現(xiàn),牙周炎可引起大鼠內(nèi)臟脂肪組織發(fā)生炎癥性改變,并且這種改變與機(jī)體的IR高度相關(guān)。但牙周炎能否造成脂肪組織胰島素信號(hào)通路的改變,目前尚未見(jiàn)報(bào)道。本研究發(fā)現(xiàn),牙周炎的主要毒力因子P.gingivalis-LPS可造成脂肪細(xì)胞IRS-1蛋白表達(dá)降低,初步揭示了牙周炎可調(diào)控脂肪細(xì)胞的胰島素信號(hào)。胰島素通過(guò)與靶細(xì)胞表面的胰島素受體相結(jié)合激活I(lǐng)RS,調(diào)控下游信號(hào)轉(zhuǎn)導(dǎo)。IRS-1是IRS家族中的重要成員,對(duì)胰島素信號(hào)起關(guān)鍵調(diào)節(jié)作用。IRS-1的激活進(jìn)一步促進(jìn)下游PDK-1和AKT的磷酸化,從而促進(jìn)葡萄糖轉(zhuǎn)運(yùn),糖原合成等多種生物學(xué)效應(yīng)。因此,IRS-1、PDK-1、AKT通路作為一條經(jīng)典的糖代謝通路被廣泛關(guān)注。本研究中,P.gingivalis-LPS刺激大鼠脂肪細(xì)胞后,IRS-1的蛋白表達(dá)減少,其下游的PDK-1和AKT磷酸化水平降低,說(shuō)明P.gingivalis-LPS可抑制大鼠脂肪細(xì)胞中的IRS-1、PDK-1、AKT信號(hào)通路。
本研究旨在揭示P.gingivalis-LPS通過(guò)何種機(jī)制調(diào)控脂肪細(xì)胞IRS-1信號(hào)通路,結(jié)果顯示,ERS相關(guān)信號(hào)分子X(jué)BP1是P.gingivalis-LPS調(diào)控IRS-1信號(hào)通路的關(guān)鍵靶點(diǎn)。ERS是真核細(xì)胞的一種保護(hù)性應(yīng)激反應(yīng),細(xì)胞受外界刺激發(fā)生ERS時(shí),位于內(nèi)質(zhì)網(wǎng)腔內(nèi)的分子伴侶蛋白-結(jié)合免疫球蛋白(binding immunoglobulin protein,BiP)與內(nèi)質(zhì)網(wǎng)的3種跨膜蛋白解離并主動(dòng)結(jié)合到未折疊或錯(cuò)誤折疊蛋白,激活內(nèi)質(zhì)網(wǎng)跨膜蛋白并啟動(dòng)3條信號(hào)通路:肌醇需要酶1α(inositol-requiring enzyme 1α,IRE1α)、雙鏈RNA依賴(lài)的蛋白激酶R樣內(nèi)質(zhì)網(wǎng)激酶(PKR like-ER-resident kinase,PERK)和活化轉(zhuǎn)錄因子6(activating transcriptionfactor 6,ATF-6)。近年來(lái)研究表明,ERS在IR的發(fā)生發(fā)展中扮演重要作用,而XBP1是其中的關(guān)鍵信號(hào)分子。XBP1的活化可促進(jìn)脂聯(lián)素的多聚化,改善肥胖小鼠的葡萄糖耐量和胰島素敏感性。這與本實(shí)驗(yàn)結(jié)果相一致,抑制XBP1的脂肪細(xì)胞在P.gingivalis-LPS刺激后,IRS-1、PDK-1和AKT表達(dá)明顯下降,胰島素信號(hào)通路表達(dá)受阻,胰島素敏感性降低;過(guò)表達(dá)XBP1的脂肪細(xì)胞在P.gingivalis-LPS刺激后,IRS-1的表達(dá)升高,說(shuō)明上調(diào)XBP1能改善IRS-1的蛋白表達(dá);P.gingivalis-LPS刺激8、12 h后,PDK-1和AKT表達(dá)升高,但24 h后明顯下降,初步分析調(diào)控PDK-1和AKT信號(hào)通路的上游較為復(fù)雜,可能受XBP1以外的其他信號(hào)通路的影響,具體機(jī)制還有待進(jìn)一步探索。因此,本研究證實(shí)XBP1是介導(dǎo)牙周炎調(diào)控脂肪組織IRS-1信號(hào)通路的關(guān)鍵靶點(diǎn)。
綜上,P.gingivalis-LPS刺激大鼠脂肪細(xì)胞后,胰島素信號(hào)通路IRS-1/PDK-1/AKT的表達(dá)隨時(shí)間推移呈下降趨勢(shì)。過(guò)表達(dá)XBP1的脂肪細(xì)胞,IRS-1、PDK-1、AKT的蛋白表達(dá)水平得到改善;而抑制XBP1的脂肪細(xì)胞,IRS-1、PDK-1、AKT的蛋白表達(dá)受阻。本研究通過(guò)體外模型證實(shí),牙周毒力因子P.gingivalis-LPS可通過(guò)XBP1調(diào)控脂肪細(xì)胞IRS-1、PDK-1、AKT信號(hào)通路。
利益沖突聲明:作者聲明本文無(wú)利益沖突。

