白藜蘆醇酯化改性及其純化表征研究進展
胡小寧,李 甜,郭 芹,李寧陽,張 雨,屈 陽,王新萍,4,唐曉珍,*,王 強,*
(1.中國農業科學院農產品加工研究所,北京 100193;2.山東農業大學食品科學與工程學院,山東 泰安 271000;3.中國農業科學院生物技術研究所,北京 100081;4.新疆農業大學食品科學與藥學學院,新疆 烏魯木齊 830052)
白藜蘆醇(resveratrol,Res)又稱芪三酚,是一種存在于虎杖、花生、葡萄等植物中的非黃酮類多酚化合物,具有抗炎、抗氧化和抗腫瘤等作用,但存在熔點高、脂溶性差、靶點多、生物利用度低等問題,限制了其在食品領域的應用。為了解決以上問題,Res酯化改性近年來備受關注;酰氯法、Steglich法、酶法等成功用于Res芳香酯、Res長鏈脂肪酸酯、Res中鏈脂肪酸酯和Res長鏈脂肪酸酯的合成,并利用硅膠柱層析法、制備液相和重結晶法進行純化,薄層層析法、傅里葉變換紅外光譜(Fourier transform infrared spectra,FTIR)法、核磁共振及高效液相色譜法對Res酯進行表征,取得了重要的研究進展,但鮮見相關文獻對其進行系統綜述。本文重點綜述了國內外Res酯的性質、Res酯化改性方法、分離純化技術及表征方法的研究現狀和最新進展,以期為Res酯的定向合成及應用提供方法和技術支撐。
1 Res酯的性質與作用
1.1 Res性質
Res化學名稱為3,4’,5-三羥基二苯乙烯,分子式為C14H12O3,相對分子質量為228.25[1-2]。常溫下為白色針狀晶體,難溶于水和油,見光易分解,易溶于多數有機溶劑(如甲醇、乙醇、丙酮、乙醚、乙酸乙酯、氯仿等)[3]。在自然界中以順式、反式Res和順式、反式Res苷4 種形式存在,熔點為256~257 ℃,當溫度高于280 ℃時開始熱分解成苯酚和間二苯酚,超過425 ℃時氧化和熱解生成一氧化碳和二氧化碳[4]。現有研究已證明Res在植物中主要以反式構象存在,反式Res的活性遠高于順式Res[5],且反式Res中4’-OH的活性>3-OH的活性>5-OH的活性,4’-OH為主要活性位點,由于4’-OH的鍵長最長,容易斷裂,反應活性最好,即發生酯化反應時4’-OH最先參與反應[6]。這些活性的—OH在不同的條件下會與FeCl3(暗綠色)、氨水(紅色)、醋酸鎂的甲醇溶液(粉紅色)等發生顯色反應[7]。
1.2 Res酯的性質
Res的3 個羥基在一定條件下與羧酸、酰氯或酸酐等發生酯化反應生成單酯、二酯和三酯(圖1),根據不同的原料比例和反應條件會生成不同的酯化產物。經過酯化的Res難溶于水,但其脂溶性大大提高,并且脂溶性隨著脂肪酸鏈的延長而增加,隨著脂肪酸不飽和度的增加而降低[8]。目前,酯化改性的Res主要是Res三酯,如Res芳香酯、Res長鏈脂肪酸酯、Res中鏈脂肪酸酯及Res短鏈脂肪酸酯,其中Res芳香酯比例最大。現有研究發現Res磺酸酯與乙酰阿魏酸酯為黃色固體,其余Res芳香酯為白色固體;Res長鏈、中鏈與短鏈脂肪酸酯大部分為黃色固體,脂肪酸烷基數目越多,與羥基發生反應的能壘就越高,酯化越困難,經過酯化后的Res由于部分羥基被長鏈烷烴取代,其分子間氫鍵作用力減小,熔點降低,且隨著取代基團數量的增多而逐漸降低[9]。盡管Res酯化后活性的羥基被取代,但仍表現出良好的抗氧化活性[10]和穩定性。當改性變成Res三酯時,由于其結構中無酚羥基,故不能發生顯色反應(圖1)。
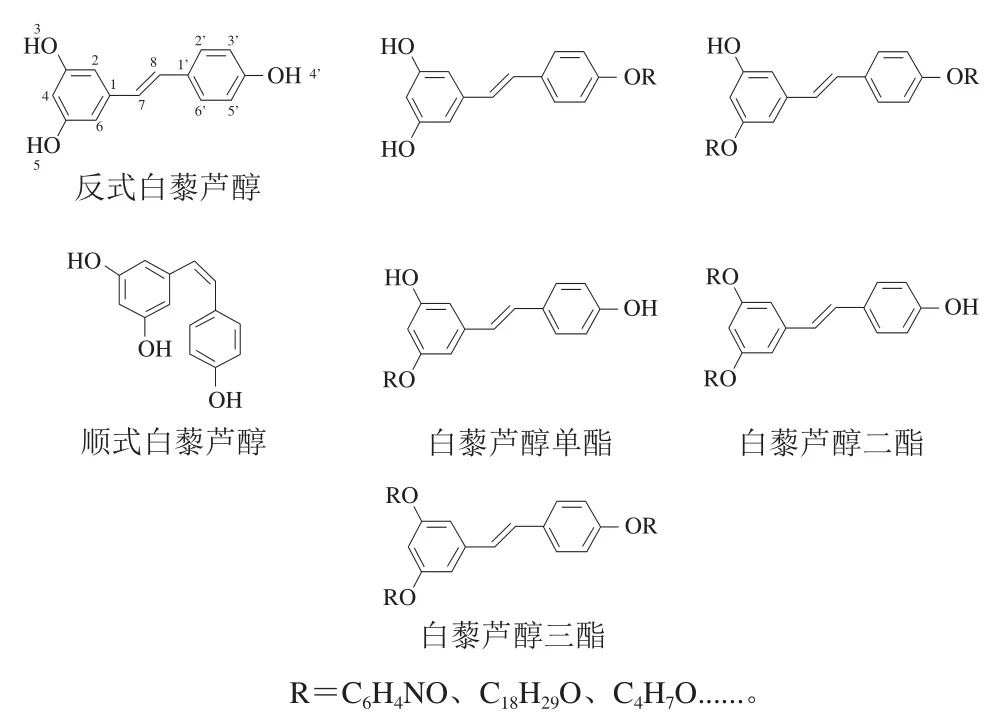
圖1 白藜蘆醇和白藜蘆醇酯分子結構式Fig. 1 Molecular structures of resveratrol and resveratrol esters
Res酯化改性既提高了Res的脂溶性和穩定性,也降低了不飽和脂肪酸的氧化速率,對Res的高效利用具有重要實際意義,但對不同結構(單酯、二酯和三酯)、不同種類(芳香酯、脂肪酸酯等)Res酯的物理和化學性質研究較少,亟待系統地研究從而進一步拓展其應用范圍。
1.3 Res酯的作用
關于Res的作用已有較多研究報道,且Res被證實具有抗炎[11-13]、降脂[14]、抗氧化[15-17]、抗腫瘤[18-20]和保肝[21-22]等作用。黃鵬等[23]研究發現Res煙酸酯對10%蛋清誘導大鼠足腫脹和二甲苯誘導大鼠耳腫脹的抑制作用優于Res,并且還可明顯降低75%蛋黃液引起的高脂血癥模型血清中甘油三酯和血清總膽固醇濃度升高。Res磺酸酯也具有較好的抗氧化作用,能夠有效清除1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基和2,2’-聯氮-雙-3-乙基苯并噻唑啉-6-磺酸(2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)陽離子自由基,同時還能顯著抑制人體肺癌細胞A549生長,起到抗腫瘤作用,且其作用效果優于Res[24]。現有研究也發現Res桂皮酸酯能顯著降低CCl4引起的小鼠血清中谷丙轉氨酶、天冬氨酸氨基轉移酶含量,從而起到保肝作用[25]。Res酯化后抗氧化活性隨著取代數目增加而降低,依次為Res>Res-3-c(單酯)>Res-4’-c(單酯)>Res-3,4’-c(二酯)>Res-3,4’,5(三酯),三酯因為不含羥基所以幾乎沒有任何抗氧化活性,其中4’-OH是決定Res抗氧化性最重要的基團[8]。
從以上研究分析可知,Res酯化后生物利用度顯著提高,且不同種類、不同結構的Res酯具有不同的活性和作用,且其在抗炎、抗腫瘤等方面的作用優于Res,但有關Res酯的作用研究主要集中在不同種類的活性對比上,體內的作用機制尚不清楚。此外,相關研究多集中于Res三酯,尤其缺乏對Res單酯和Res二酯的研究,且酯化取代位置、數量和羧酸種類的不同對其功效有何影響仍不清楚,不同酯化產物是否具有協同或者拮抗作用也亟待研究。
2 Res的酯化改性方法
Res含有3 個酚羥基,具有較高的生物活性,但其具有熔點高、脂溶性和水溶性差等特性導致生物利用度低,直接應用到食品中易結晶析出,特別是在Res含量高的體系中,嚴重影響食品品質。因此,為了增加Res的穩定性和脂溶性,降低熔點,提高其生物利用度,Res的酯化改性越來越受到國內外研究者和企業的高度關注。目前Res的酯化改性方法有化學改性法和酶催化法(表1)[26]。
2.1 化學改性法
2.1.1 酰氯酯化法
酰氯酯化法是將位阻大、難以直接酯化的羧酸先制成酰氯,再與Res發生酯化反應的一種方法,也是目前最常用的方法,酰氯的酯化能力比相應的羧酸和酸酐都強,但是改性路線復雜冗長,副產物較多。目前使用的酰氯試劑有氯化亞砜、草酰氯、五氯化磷和三氯化磷等,最常用的是氯化亞砜,但其在反應過程中會釋放出氯化氫和二氧化硫等酸性氣體,易對環境造成一定的污染。近年來,由于草酰氯更綠色環保,其逐步開始替代氯化亞砜[31]。由于Res難溶于水,為了增加其溶解度,常用丙酮、二氯甲烷(dichloromethane,DCM)和乙酸乙酯作為溶劑進行Res的酯化改性,其中丙酮的使用較多。此外,催化劑也是酯化改性Res的關鍵因素,現有文獻已報道三乙胺、DMAP和吡啶等有機堿被用作酰氯酯化法的催化劑,為了達到最佳酯化率,應根據羧酸的不同選擇合適的催化劑,雖然使用較多的是三乙胺,但是吡啶類催化劑可以解決反應結束時體系容易變黑色黏稠狀的問題[25]。
酰氯酯化法的優化反應條件:反應物(Res、酰氯)的物質的量比1∶2~1∶3.5、反應溫度25~65 ℃、反應時間2~5 h,產率可達78%~92%,但收率只有10%~35%。劉耀武等[29]在用三乙胺作催化劑的基礎上優化了采用DMAP催化制備Res煙酸酯的工藝,將反應時間由4~6 h縮短至1.5~2.0 h[39]。有研究以草酰氯作為酰化試劑,三乙胺為催化劑,DCM為溶劑,在冰浴下制備了Res乙酰水楊酸酯和Res肉桂酸酯、Res亞麻酸酯、Res花生四烯酸酯和Res DHA酯,收率分別達到了16.0%、16.0%、10.0%、12.6%和10.2%[40]。最近一項研究采用三乙胺為催化劑,丙酮為溶劑,在室溫下將Res和丙烯酰氯(物質的量比為1∶3.5)反應4 h,制備了一種新型Res丙烯酸酯,收率達30.2%[27]。
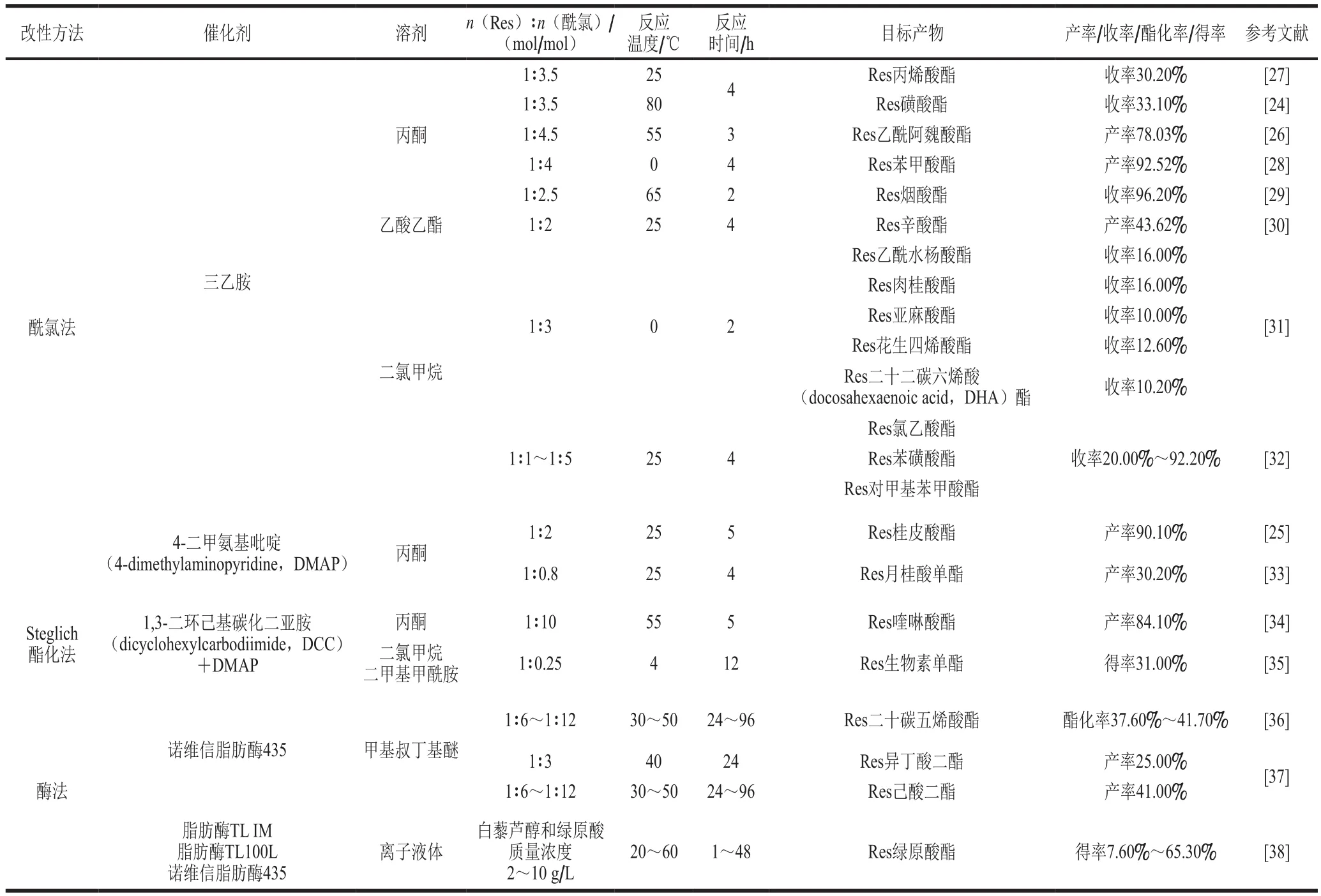
表1 白藜蘆醇的酯化改性方法Table 1 Esterification modification methods of resveratrol
通過以上分析可知,催化劑在酰氯酯化法中至關重要,催化劑活性低或不添加催化劑很難得到酯化產物;同時發現反應條件對產物的種類起關鍵作用,但僅通過調控反應條件無法實現精準定向酯化。酰氯酯化法的機理是先利用羧酸與氯化亞砜或草酰氯反應生成相應的鹽,再脫去二氧化硫或一氧化碳和二氧化碳生成相應的酰氯,接著與Res在DMAP、三乙胺等催化劑的作用下生成Res酯(圖2)。可見,要實現Res的定向酯化可利用溴化芐和三異丙基硅基三氟甲磺酸酯(trifluoromethanesulfonic acid triisopropylsilyl ester,TIPS-OTF)等基團選擇性保護酚羥基,待酯化結束后脫去保護基團即可實現定向酯化,但相關研究還需進一步實驗驗證。
2.1.2 Steglich酯化法
Steglich酯化法是以DCC或1-(3-二甲氨基丙基)-3-乙基碳二亞胺鹽酸鹽(1-ethyl-3-(3-dimethylaminopropyl)carbodiimide,EDC)為偶聯試劑的酯化方法,該方法具有反應條件溫和且改性路線相對簡單等優點,但反應時間比酰氯法長,且催化劑價格昂貴。已有的研究采用丙酮、DCM、三氯甲烷和N,N-二甲基甲酰胺(N,N-dimethylformamide,DMF)作為溶劑,DCC與EDC作為良好的酯化縮合劑(活化羧酸),脫水促使反應正向進行。其中,應用最多的縮合劑是DCC,DCC具有價格低廉、無需保護Res酚羥基等優勢,但反應之后會生成N,N’-二環乙基脲(N,N’-dicyclohexylurea,DCU),難以去除干凈(圖3)[35]。研究發現以Res和生物素(VH)為原料,DCC為縮合劑,DCM和DMF(9∶1,V∶V)作為溶劑,在低溫(4 ℃)下制備Res生物素單酯,得率達31%[35]。王鑫等[34]以丙酮為溶劑,采用DCC與EDC作為縮合劑由DMAP催化Res與2-喹啉羧酸制備Res喹啉酸酯,產率最高可達84.1%和72.3%。Peng Wei等[41]以乙酸酐和TIPS-OTF作為保護劑,EDC-DMAP為縮合劑,以較高收率(51%~63%)定向酯化得到4’-Res布洛芬酯。
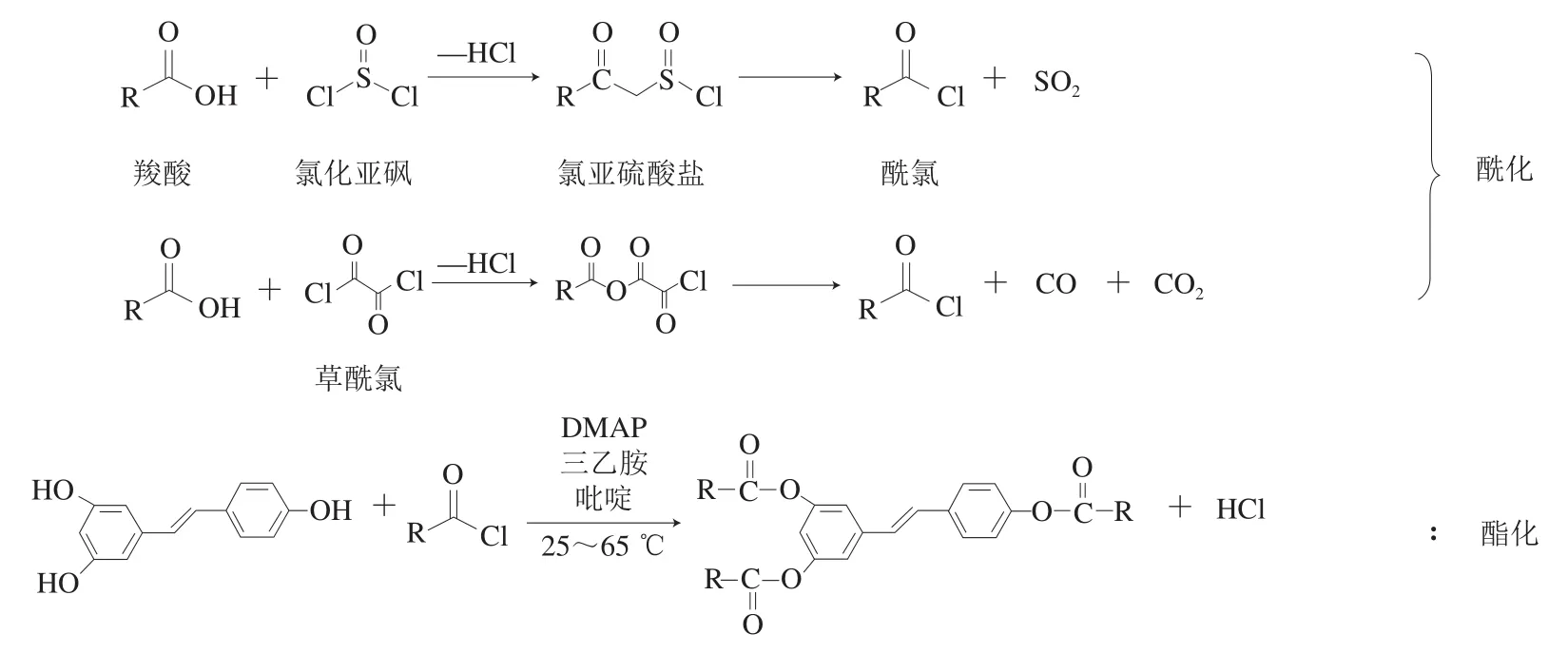
圖2 酰氯酯化改性法機理Fig. 2 Reaction routes for acid chloride esterification modification method

圖3 Steglich酯化法機理[35]Fig. 3 Reaction routes for Steglich esterification method[35]
Steglich酯化法機理與酰氯法類似,都是先用DCC或EDC將位阻大的羧酸活化為活性酯,接著與Res在DMAP的催化作用下生成Res酯(圖3)。早期的Steglich酯化法僅用DCC作縮合劑,經過改進后采用EDC作縮合劑,反應后副產物僅需酸性和堿性溶液洗滌即可除去,得到純酯產物,省去了色譜純化。采用Steglich酯化法最關鍵的是無水體系,有水會造成反應不充分。目前Steglich酯化法可實現定向酯化(圖3),但是相關理論研究較為匱乏。
2.1.3 其他方法
為了提高酯化率,微反應器酯化法也用于Res的酯化改性。李萬梅等[42]將Res的氫氧化鈉溶液與乙酸酐以1∶3~1∶6的物質的量比混合后置于微反應器中反應1~10 min(20~40 ℃),連續化制備Res三乙酸酯,產率達45%~95%(圖4)。與酰氯酯化法和Steglich酯化法相比,該方法避免了使用大量吡啶和三乙胺等催化劑產生的三廢,不僅減少了環境污染,還降低了反應溫度并縮短了反應時間,提高了產品收率和純度,但這種改性方法設備相對昂貴。在該反應中,若將乙酸酐置于二氯甲烷、二氯乙烷和正己烷等有機溶劑中可進一步提高Res酯的產率,但相關研究仍待加強。本課題組采用N,N’-羰基二咪唑(N,N’-carbonyldiimidazole,CDI)活化共軛亞油酸,成功制備Res共軛亞油酸酯,酯化率達96.87%(圖5),CDI活化羧酸后副產物咪唑易溶于水,僅需水洗就可得到高純度的Res酯,且無有毒有害氣體產生,酯化效果優于EDC,極具發展潛力。
2.2 酶催化法
酶作為生物催化劑,與化學催化劑相比,作用條件溫和,具有更好的選擇性、能控制酯化的位置和數量、副反應少、產物易分離、純化步驟相對簡單等優點。常用的酶有諾維信脂肪酶435、脂肪酶TL IM、RM IM和PLG等,但存在成本過高、難以實現工業化生產等問題,當前Res酶法酯化還處于實驗室研究階段[43],溶劑一般選用甲基叔丁基醚和離子液體。傳統的酶法是在水介質中催化反應,近年來非水介質催化無論在理論上還是在應用上都取得較大進展,為酶法提供了更加廣闊的發展前景[43]。
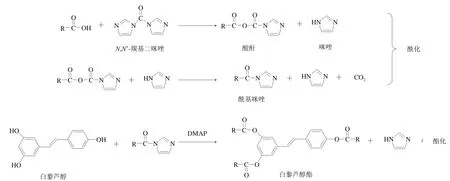
圖5 CDI催化酯化改性法機理Fig. 5 Reaction routes for CDI-catalyzed esterification modification method
酶法的一般反應條件:反應物的物質的量比(n(Res)∶n(羧酸))1∶6~1∶12,溶劑與Res體積-物質的量比1∶0.026~1∶0.044(L/mol),脂肪酶與Res質量-物質的量比100∶1~150∶1(g/mol),反應溫度20~60 ℃、反應時間24~96 h下,酯化率達37.6%~41.7%,純度80.3%~87.8%。周大勇等[36]將Res與二十二碳六烯酸(docosahexaenoic acid,EPA)溶于甲基叔丁基醚中,利用南極假絲酵母脂肪酶催化制備了Res EPA酯。Marian[37]首先采用酰氯法制備了Res異丁酸三酯與Res己酸三酯,然后在南極假絲酵母脂肪酶的作用下,經過40 ℃、24 h反應后得到了Res異丁酸二酯與Res己酸二酯,產率可達到25%和41%。不同脂肪酶對Res不同位置羥基酯化選擇性不同,其中諾維信脂肪酶435酯化位點在4’-OH,脂肪酶QLG酯化位點在3-OH,脂肪酶PLG在3-OH與4’-OH選擇性相同,脂肪酶TL IM在3-OH選擇性大于4’-OH,脂肪酶RM IM在4’-OH選擇性大于3-OH[44]。
綜上所述,酶法的最大優點是能實現定向酯化,但其反應時間較長且產率較低;酶的活性在酶法酯化反應過程中也至關重要,酶的活性低或失活會導致反應難以進行,因此需要控制反應體系的溫度、pH值等使酶處于最適酶活下,才能達到最佳酯化率;酶菌種的篩選及反應條件的優化還有待進一步研究。酶法酯化改性機理如圖6所示。
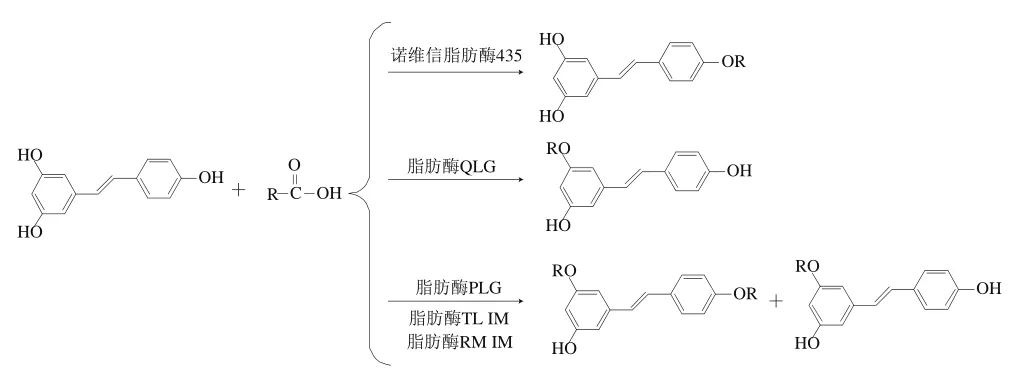
圖6 酶法酯化改性機理Fig. 6 Reaction routes for enzymatic esterification modification
3 Res酯的純化方法
Res酯化改性得到的粗產物一般純度低,還混有少量的Res和脂肪酸,而藥品、食品等行業所需的是高純度Res酯,因此需進一步分離純化以提高其價值。到目前為止,Res酯純化的主要方法有硅膠柱層析法、制備液相色譜法和重結晶法,為了獲得更好的純化效果,往往需要多種純化方法復配使用。
3.1 硅膠柱層析法
硅膠柱層析法具有綠色環保、操作簡單等優點,在Res酯的分離純化中有很高的應用價值。酯化改性的Res粗產物中常常含有游離的Res、Res單酯、二酯、三酯和過量羧酸,硅膠柱層析法可將其分離,但其分離效率低且耗時長,不適用于工業化生產,而且整個過程還需要薄層色譜法進行輔助檢測。其常用的洗脫液為正己烷-乙酸乙酯、石油醚-乙酸乙酯和正己烷-乙酸乙酯-甲酸等。Hu Xiaopei等[30]以正己烷和乙酸乙酯(15∶1~3∶1,V/V)為洗脫液分離得到了Res辛酸單酯、二酯和三酯。馮海燕[9]以正己烷-乙酸乙酯(5∶4,V/V)為洗脫溶劑,分離得到了Res月桂酸酯。
不同的Res酯需要的洗脫溶劑類型和體積比不同,其洗脫條件應根據目標產物的性質進行優化,但由于硅膠柱層析法粒徑(200~300 目)相比高效液相色譜柱粒徑(3~10 μm)大上百倍,有時無法將Res酯的5 種結構完全分離,若要獲得單一目標物,需考慮分離效率更高的方法。
3.2 制備與半制備型液相色譜法
液相色譜法根據應用方向分為分析型、制備和半制備液相色譜法[45]。制備與半制備液相色譜法相比于其他純化方法分辨率和成本高,常用于樣品純化的最后階段。制備與半制備液相色譜由于柱長(前者20~70 cm,后者15~50 cm)、柱內徑(前者高于20 mm,后者低于10 mm)和流速不同,兩者上樣量不同,制備型上樣量更大(0.1~100.0 g),但是沒有半制備型(<100 mg)靈敏[46]。在Res酯的純化中,無論是制備液相色譜法還是半制備液相色譜法常用的色譜柱都為C18。常用的流動相為乙腈-水和甲醇-水[47]。以丙酮-水作為流動相(60∶40或55∶45,V/V)可有效分離Res月桂酸單酯與二酯[9]。Hu Xiaopei等[30]以甲醇-水為流動相,在306 nm紫外波長下,采用制備高效液相色譜法分離純化得到了Res辛酸單酯和二酯。制備和半制備液相色譜法是目前最成熟的一種純化方法,經純化后樣品純度可達95%以上,但是其缺點也很明顯,如設備昂貴、運行費用較高、溶劑消耗大、無法避免有毒溶劑的使用等。在現有研究中,制備和半制備液相色譜法還無法將Res單酯、二酯和三酯完全分離,在色譜柱選擇和分離條件方面還有待優化。
3.3 重結晶法
重結晶法是利用結晶過程中不同物質溶解度不同而將混合物分離提純的方法。當Res酯純度較高時(雜質質量分數低于5%)宜采用重結晶法。重結晶法操作簡單、純度高、適合工業化生產,結晶溶劑的選擇也尤為重要。常用的結晶溶劑有甲醇、石油醚-乙酸乙酯、無水丙酮和氯仿-乙醇,結晶溶劑從毒性極大的氯仿逐步向毒性低的丙酮和甲醇轉變。現有研究以氯仿-乙醇作為結晶溶劑,采用重結晶法純化Res煙酸酯,得到白色固體[29]。最新研究將Res月桂酸酯經硅膠柱層析和半制備液相色譜分離,再以甲醇重結晶制得高純度的Res煙酸酯,純度可達99.3%[33]。
由于羧酸的種類和結構不同,酯化改性后Res的物理化學性質有較大差異,在進行分離純化時,要依據酯化產物溶解度、純度要求以及不同改性方法引入副產物種類的不同來選擇合適的純化方法。
4 Res酯的表征方法
將Res酯分離純化之后,需要對其進行表征來分析產物類型、純度、分子質量和分子式等。常用的表征方法有薄層色譜法(thin-layer chromatography,TLC)、FTIR、高效液相色譜法(high performance liquid chromatography,HPLC)、高效液相色譜-質譜聯用(high performance liquid chromatography-mass spectrum,HPLC-MS)和核磁共振(nuclear magnetic resonance,NMR)等。
4.1 薄層色譜法
TLC是利用同一吸附劑(通常選硅膠)對不同物質的吸附能力不同,從而實現對樣品中不同組分的有效分離,根據展開后比移值(Rf)和斑點數目判斷是否有新物質生成。酯化改性的Res一般包括5 種取代產物,需要經TLC分析,來判斷產物類別,監測反應進程[9]。Res含有3 個-OH,極性較大,酯化改性后極性減小,并隨著取代基數量的增多而減小(Rf隨取代基數量的增多而增加)。目前,常用的展開劑組合有石油醚-乙酸乙酯和正己烷-乙酸乙酯,通常會加入少量甲酸或乙酸防止斑點拖尾,其中最常用的是石油醚-乙酸乙酯。現有報道采用TLC分離Res月桂酸酯,比較了以石油醚-乙酸乙酯-甲醇-乙酸和正己烷-乙酸乙酯-乙酸作為展開劑的分離效果,后者分離效果明顯優于前者,當以正己烷-乙酸乙酯-乙酸(10∶7∶1,V/V)作為展開劑時分離效果最好[8]。Oh等[10]改性得到Res DHA酯,在薄層色譜板上顯示出兩種單酯、一種二酯和一種三酯,但是從HPLC-MS譜圖看出有兩種單酯和兩種二酯,并未檢測到三酯,說明僅僅采用一種檢測方法無法準確判斷出產物類別,要多種檢測方法共同分析。
該方法雖然簡單,但是選擇合適的展開劑和比例使酯化改性后的粗產物全部分離是該方法的難點,即使產物與雜質完全分離,也無法達到將已分離產物大量回收的目的。本課題組以正己烷-乙酸乙酯-冰醋酸按10∶8∶0.1(V∶V∶V)的比例作為展開劑,采用TLC分析制備的Res共軛亞油酸酯,可將Res、Res單酯、共軛亞油酸、Res二酯和Res三酯完全分離(圖7)。

圖7 白藜蘆醇共軛亞油酸酯的TLC圖Fig. 7 Thin layer chromatogram of resveratrol conjugated linoleic acid ester
4.2 傅里葉變換紅外光譜法
紅外光譜在食品領域已經應用了幾十年,直到20世紀70年代,隨著科技的進步,FTIR再次激起研究者的興趣,它可以提供化學鍵和官能團的特征頻率,FTIR與傳統紅外光譜相比提高了譜圖分辨率,降低了譜峰寬度,大大提高了儀器靈敏度和準確性,具有樣品用量少、檢測迅速、準確度高和無需樣品前處理等優勢[48]。利用FTIR可根據吸收峰來快速判斷是否有Res酯生成,掃描范圍一般在4 000~600 cm-1。對于Res,在3 500~3 000 cm-1有明顯的羥基吸收峰,如果有Res酯生成,其羥基吸收峰強度會明顯減小,并且會在1 740 cm-1和1 170 cm-1附近產生明顯的酯基(分別為C=O和C-O)吸收峰,但無法確定具體是Res分子哪個羥基參與酯化反應,如果在3 000 cm-1以上沒有強峰,說明Res 3 個羥基都參與反應[40]。利用FTIR只能判斷酯化反應是否發生,要想準確判斷酯化位置,需借助核磁進一步分析。
4.3 核磁共振法
NMR波譜法研究原子核對射頻輻射的吸收,是對物質定性分析最強有力的工具之一,NMR近年來被廣泛應用于Res和Res酯的相關分析,利用核磁可以判斷Res分子哪個羥基發生反應。Res的H NMR化學位移在δ6.1~9.5[49],C NMR化學位移在δ100~160[50]。常用的檢測溶劑有氚代二甲基亞砜、氚代氯仿(CDCl3)、氚代乙腈(CD3CN)、氚代丙酮和氚代甲醇(CD4O)。儀器兆赫數從之前的400 MHz逐漸升級為600 MHz,大大提高了譜圖的分辨率。Res的核磁氫譜從低位移到高位移特征吸收峰依次是4’位、35位、2’6’位、CH=CH、3’5’位、26位、4位[51]。目前Res碳譜的相關研究較少。當酯化改性后,取代位置處-OH的吸收峰會消失,其他位置的吸收峰會發生微小的偏移,可準確判斷酯化位點。但是所檢測的樣品需要把單酯、二酯和三酯分離,純度要盡可能高,否則譜圖雜峰過多,不利于解析。
4.4 高效液相色譜法
HPLC是檢測Res及Res酯常用的方法,在低溫下即可將Res與Res酯分離,可用來監測反應進程[52]。常用的色譜柱為C18,常用的流動相有乙腈-水、甲醇-乙腈-水,近年來開始用更環保的甲醇-水、丙酮-水來代替乙腈,常加入醋酸、甲酸等酸性改性劑來調整峰型,獲得最大分離度。檢測波長一般在306 nm,常用的檢測器有紫外檢測器(ultraviolet detector,UV)和二極管陣列檢測器(photo-diode array,PDA),UV只能獲得單一波長的色譜圖,而PDA可得到某一波長范圍內所有波長色譜圖,但是其靈敏度比UV低一個數量級。利用HPLC可計算Res酯的純度和酯化率,并且可以判斷產物類型。Res極性大,保留時間較短,如果制備單酯、二酯和三酯,保留時間依次延長。現有研究以丙酮-水作為流動相、UV檢測器,采用HPLC依據峰數目來判斷所制備Res月桂酸酯的類別,分離效果良好[9]。最新報道以乙腈-水作為流動相,采用PDA檢測器來檢測3 種Res辛酸酯在口腔、胃相和腸道的變化情況,研究了不同消化條件對酯鍵的影響[30]。HPLC-MS是在液相色譜基礎上發展起來的新技術,與HPLC相比選擇性更好、靈敏度和準確度更高,既能檢測單一成分,又能檢測混合物,既能定性,又能定量,其效果明顯優于PDA和紫外檢測器,最重要的是質譜具有強大的結構鑒定能力,可以根據分子質量將未知峰準確判斷出來[53]。馮磊等[35]采用HPLC-MS,以甲醇-水-1%乙酸為流動相,檢測得到Res生物素酯的純度>90%,相對分子質量為454.2。在分離Res酯時,往往會遇到單酯或二酯無法完全分離。為了更好地分離Res單酯、二酯和三酯,往往需要加大流動相中水相的比例,因為有機相的比例過高會導致Res酯難以停留在柱中。
5 結 語
雖然我國對Res酯的相關研究較少、起步較晚,但近年來研究數量逐漸增加,尤其是定向制備不同結構的單酯、二酯和三酯已成為未來研究的方向和攻克的技術難點。傳統化學法雖然技術成熟、產率高,但存在產物復雜、純化困難和環境污染等問題;酶法雖然環保、副產物少、能耗較低,但酶價格過高且活性較難保持。由于Res的酚羥基易受芳環影響,親核性降低,發生酯化反應比醇困難,因此酯化改性工藝亟待在以下3 個方面進行深入的研究:1)尋找綠色高效的催化劑;2)研發低成本且對環境要求低的酶制劑;3)將微波、超聲等技術應用于Res的酯化改性。從分離純化角度看,需進一步探索高速逆流色譜、超臨界反溶劑萃取、分子蒸餾等現代分離技術以實現不同結構Res酯的高效純化。在表征方面應根據不同結構Res酯的性質來選擇適合的檢測方法,單一的檢測方法很難滿足深入研究的需要,兩種及以上方法的組合、聯用是未來研究趨勢;超高效液相色譜(ultra performance liquid chromatography,UPLC)和UPLC-四極桿-飛行時間質譜等新的結構表征方法由于分離度好、靈敏度高、分析時間短,也可用于Res酯的分析。總之,隨著改性、純化、檢測技術的不斷發展,越來越多的先進儀器和創新技術將會應用到Res酯的研究,以期開發出低成本、高純度的Res酯產品,不僅能實現Res酯的高值化利用,同時還能滿足市場需求。

