立體定向放療對早期非小細胞肺癌患者腫瘤標記物及免疫功能的影響
吳彬,陳明東,王凱,吳燕斌
福建醫科大學孟超肝膽醫院放療科 (福建福州 350025)
非小細胞肺癌(non-small cell lung cancer,NSCLC)是肺癌中最常見的類型,其發病率約占肺癌的80%。早期NSCLC約占所有NSCLC患者的30%,放療屬于早期NSCLC患者的重要治療方法,有利于緩解患者的臨床癥狀,提高腫瘤局部控制率,改善患者預后,但目前臨床上尚無統一的放療標準,且采用不同放療方法取得的效果及患者的預后也不相同[1-2]。采用常規放療治療NSCLC患者雖然能滿足治療需要,但不良反應相對較大,難以達到預期的治療效果。立體定向放療(stereotactic body radiation therapy,SBRT)是一種精確性放射治療方法,具有靶區劑量高、周圍正常組織劑量低等優點,已被美國綜合腫瘤網絡中心(National Comprehensive Cancer Network,NCCN)指南推薦為不可手術早期NSCLC治療的重要方法。鑒于此,本研究旨在探討SBRT對早期NSCLC患者腫瘤標記物及免疫功能的影響,現報道如下。
1 資料與方法
1.1 一般資料
選擇2018年10月至2020年10月我院收治的120例早期NSCLC患者為研究對象,按隨機數字表法將患者分為對照組和試驗組,各60例。試驗組男37例,女23例;年齡41~78歲,平均(58.61±2.80)歲;TNM分期:ⅠA期20例,ⅠB期15例,ⅡA期13例,ⅡB期12例。對照組男35例,女25例;年齡41~79歲,平均(58.56±2.83)歲;TNM分期:ⅠA期18例,ⅠB期15例,ⅡA期14例,ⅡB期13例。兩組一般資料比較,差異無統計學意義(P>0.05),具有可比性。患者均簽署知情同意書。本研究經醫院醫學倫理委員會審核批準。
納入標準:經影像學及病理學檢查確診;TNM分期為Ⅰ~Ⅱ期;存在可測量病灶,且直徑>2 cm;治療依從性較高;精神狀態良好。
排除標準:存在嚴重肝、腎功能不全;存在放療禁忌證;存在化療史;預計生存期<6個月;合并免疫系統疾病。
1.2 方法
對照組行常規放療:選取Varian公司提供的高能直線加速器6MV-X線, 依據患者實際情況設置放射劑量, 2 Gy/次, 照射總劑量為60~70 Gy,1次/d,每周連續放療5 d;對原發病灶及周圍2 cm的正常組織進行放療,必要時對隆突下5 cm以上縱膈、同側肺門進行放療。
試驗組行SBRT:選取深圳奧沃公司提供的全身伽馬射線立體定向放射系統,采用CT進行體部定位,采用負壓帶對肺部病灶、縱膈活動度進行準確記錄;利用儀器配套的工作站對影像圖進行分析,明確腫瘤區、治療靶區,并完成三維重建;固定照射野,設置放射劑量,2 Gy/d,照射總劑量為60~70 Gy,1次/d,每周連續放療5 d。
兩組均放療2個月。
1.3 評價指標
臨床療效[3]:放療2個月后,依據兩組影像學檢查結果評估臨床療效,病灶完全消失且維持≥4周,為完全緩解(complete response,CR);病灶縮小幅度>50%且維持≥4周,為部分緩解(partial remission,PR);病灶縮小幅度≤50%或增大<25%、無新病灶,為穩定(stable disease,SD);出現新病灶,或病灶增大幅度≥25%,為進展(progressive disease,PD);緩解率(response rate,RR)=(CR例數+PR例數)/總例數×100%。
腫瘤標記物水平:放療前及放療2個月后,分別采集兩組空腹肘靜脈血3 ml,以3 000 r/min轉速離心處理10 min后,取上清液,采用化學發光法檢測血清癌胚抗原(carcinoembryonic antigen,CEA)、糖類抗原125(carbohydrate antigen 125,CA125)水平,試劑由雅培公司提供。
免疫功能指標:放療前及放療2個月后,分別采集兩組3 ml外周靜脈血,采用流式細胞儀(BD FACSCanto Ⅱ,美國BD公司)檢測T淋巴細胞亞群中CD4+T細胞、CD4+與CD8+T細胞比值。
1.4 統計學處理

2 結果
2.1 臨床療效
試驗組RR高于對照組,差異有統計學意義(P<0.05),見表1。

表1 兩組臨床療效比較[例(%)]
2.2 腫瘤標記物水平及免疫功能指標
放療前,兩組血清CEA及CA125水平、CD4+、CD4+/CD8+比較,差異均無統計學意義(P>0.05);放療2個月后,兩組血清CEA、CA125水平均低于放療前,CD4+、CD4+/CD8+均高于放療前,且試驗組血清CEA、CA125水平均低于對照組,CD4+、CD4+/CD8+均高于對照組,差異有統計學意義(P<0.05),見表2。
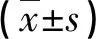
表2 兩組放療前后血清CEA、CA125水平及CD4+、CD4+/CD8+比較
3 討論
NSCLC是臨床常見的惡性腫瘤,其發病多與輻射、職業及吸煙等因素相關[4]。手術是治療早期NSCLC的優選方法,但手術對患者的創傷大,且患者可能伴有嚴重的內科疾病,無法耐受手術,對于這部分患者,放射治療扮演著關鍵的角色。放療已成為早期NSCLC患者的重要治療方法,可延長患者的生存時間。采用常規放療劑量對早期NSCLC患者進行放療可滿足臨床治療需求,但對患者周圍組織損傷較大,且存在較大的放療誤差,可影響放療的效果及安全性。
近年來,SBRT技術逐漸在臨床上被推廣應用,早期NSCLC的治療已逐漸向SBRT精確放療發展。SBRT作為一種精確性放療方法,不僅分次劑量大,且具有三維系統立體監測,有利于對病灶靶區周圍劑量的階梯變化進行監測及控制,可增加臨床病灶照射劑量,減少病灶周圍正常組織器官的照射劑量,從而有利于保護正常組織,增強放療的目的性和針對性[5]。與常規放療相比,SBRT不僅提高了腫瘤劑量,也降低了對正常組織的受照劑量,有利于減少不良反應,提高腫瘤控制率。研究發現,CEA屬于腫瘤相關抗原,是診斷肺癌的常用標志物;CA125屬于糖類抗原,在肺癌患者血清中呈高表達,通過檢測血清CA125可為肺癌診斷及病情評估提供依據[6]。T細胞源于骨髓淋巴干細胞,多數腫瘤患者會出現T細胞亞群表達異常現象,表現為CD4+、CD4+/CD8+下降,CD8+升高[7],因此,通過測定T細胞亞群,可評估患者的免疫狀態。本研究結果顯示,試驗組RR高于對照組,差異有統計學意義(P<0.05);放療2個月后,試驗組血清CEA、CA125水平均低于對照組,CD4+、CD4+/CD8+均高于對照組,差異有統計學意義(P<0.05)。這一結果提示,與常規放療相比,行SBRT時的放射劑量分布較為精確,可有效殺滅腫瘤細胞,減少對正常組織的射線劑量,減輕對免疫功能的損傷,有利于提高腫瘤控制率,降低腫瘤標志物水平。SBRT可利用多次分割治療及非共面多野三維集束照射,提高靶區照射劑量,提升局部控制率,減少癌細胞遠處轉移及局部復發,改善患者預后[8]。
綜上所述,對早期NSCLC患者進行SBRT,有利于提升抗腫瘤效果,降低腫瘤標志物水平,減輕放療對患者免疫功能的影響,可作為治療早期NSCLC的有效方法。

