施氮對貧瘠紅壤定植芒草根際土有機碳礦化過程的影響
伍旖旎, 許 依, 傅童成, 易自力, 薛帥*
(1. 作物種質創新與資源利用重點實驗室, 湖南農業大學生物科學技術學院, 湖南 長沙 410128; 2. 中國農業大學農學院,北京, 100193; 3. 芒屬植物生態應用技術湖南省工程實驗室, 湖南農業大學, 湖南 長沙 410128; 4. 國家能源非糧生物質原料研發中心湖南分中心, 湖南農業大學, 湖南 長沙 410128)
如今,我國人均耕地資源缺乏,承載力已達上限,糧食安全面臨威脅。在此背景下,國家頒布并實施了“藏糧于地、藏糧于技”戰略。其中,改良資源豐富的邊際土地可作為實施“藏糧于地”戰略的重要策略[1]。改良能使部分環境惡劣程度相對較輕的邊際土地具備中低等地產能水平,以保障國家糧食安全。貧瘠紅壤作為一種重要邊際土地類型,主要分布在我國南方地區,面積約有1.6億畝。和西北荒漠地、北方鹽堿地等邊際土壤類型相比,貧瘠紅壤主要特點是高度風化、水土流失嚴重、土壤有機質匱乏,而其光溫水條件較為充足,是改良難度最小,潛力最大的邊際土地類型[2]。
植物改良與其他改良方法相比,具有成本低、易操作、無二次污染等優點,可使邊際土地土壤有機質大量積累,土壤肥力與生產潛力大幅提高。理論上,芒草(Miscanthusspp.)、柳枝稷(PanicumvirgatumL.)等高大禾草在較為貧瘠的條件下依然能產生較高的生物量[3]。然后通過地上莖稈、落葉及地下老化根莖的腐爛將光合固定的碳輸入土壤,從而增加土壤有機質的含量[4-5]。另外,有研究表明,芒草根系統可以富集固氮微生物,進而增加土壤中的氮含量;其根系中的解磷、解鉀微生物的富集可以增加土壤中的有效磷和速效鉀含量[6-8]。芒草產生的生物質還可以轉化為生物能源(比如生物乙醇)、化工產品(比如低聚木糖、納米纖維等)等增加植物改良的經濟效益[9-11]。筆者所在課題組已經證明種植芒草可以改良鹽堿土,促使鹽堿土壤的pH值、電導率降低,土壤有機質、總鉀含量增加,還可以改變土壤微生物群落的組成豐度,富集有益菌以促進土壤脫鹽[12]。由此可見,芒草是一種改良邊際性土地的優勢植物類型。
土壤有機碳是土壤質量的核心,維系著糧食安全、氣候變化等關于人類生存發展的諸多要素[1]。土壤有機碳的含量主要取決于土壤中有機物料的投入與降解,即碳輸入與碳輸出。其中,大部分外來有機物料如生物殘體、有機肥料等被微生物降解生成CO2(即礦化),是微生物活動所利用碳源的主要來源,也是植物可利用養分的主要來源;而只有一部分不易被分解的成分以土壤有機質的形式儲藏于土壤之中,形成了土壤中的碳固存量[13]。施氮是利用改良后邊際土壤不可或缺的農藝措施,但人為添加氮后會迅速改變土壤中的C/N結構,從而影響土壤固定碳的重新釋放[14]。與此同時,在以往的實地研究中,施氮對陸地生態系統(森林、草原、荒漠、濕地以及受人工干預的農田)的土壤有機碳礦化有著不同的影響,包括促進[15]、抑制[14]和無影響[16]三種情況,主要取決于氮輸入后對土壤碳氮的存在形式與比值、植物根生長量與周轉、土壤微生物群落結構、微生物生物量與活性的影響[17]。基于此,本試驗擬在人工施氮條件下,將經長期種植芒屬植物改良后的貧瘠紅壤進行室內定溫礦化培養,探究氮肥對芒屬植物修復后的邊際土地中固定的土壤礦化影響以及驅動機制,為南方貧瘠酸性紅壤的改良修復后的田間管理提供參考依據。
1 材料與方法
1.1 土壤樣品采集及礦化培養
2021年1月于試驗基地采集芒屬植物根際土壤樣品:以“S”型隨機選取5棵植株挖出,抖動其根系,對仍附著在根和根莖上的土壤進行采集并充分混合,然后人工去除土壤內的枯枝落葉和根系殘茬,過2 mm網篩后,使用四分法采集4個重復總共收集200 g根際土壤樣品。所采集的芒屬植物為湖南農業大學培育的‘湘雜芒1號’,于2011年在湖南農業大學芒屬植物實驗基地(27°51′ N,113°10′ E)種植,詳情參考侯維等人前期研究[2]。種植后,每年的11月底至12月初收獲地上部生物質并將其移出。在2012年生長季節后,不進行任何其他田間管理措施。
土壤有機碳礦化培養試驗采用室內恒溫培養,堿液吸收法測定。將經上述處理后的新鮮土樣稱取30.0 g,置于250 mL廣口培養罐底部,用NH4Cl溶液和去離子水設置空白(Control,CK)、低氮(Low nitrogen,LN)、高氮(High nitrogen,HN)三個氮添加水平,分別對應于0,52,208 mg N·kg-1soil,相當于在全國各地水稻目標產量4.5~10.5 t·hm-2的基礎上其大田施氮量為0 kg·hm-2,75 kg·hm-2,300 kg·hm-2[18],且調節全土含水量至田間飽和持水量的70%。每個處理重復4次,密封并置于25℃恒溫培養箱中預培養5 d(遮光)以恢復微生物活性,之后將盛有5 mL 1 mol·L-1NaOH溶液的小玻璃杯放入培養罐中,繼續密封并置于25℃恒溫培養箱中遮光培養。在培養后的第1,3,5,7,14,21,30,40,50 d更換堿液玻璃杯,并對置換出來的杯內堿液進行滴定。取1 mL堿液于小燒杯中,加入1 mL 1 mol·L-1BaCl2溶液,再滴加適量的酚酞指示劑,后用0.2 mol·L-1標準HCl溶液滴定直至紅色消失。根據標準HCl溶液滴定量計算培養期內全土有機碳礦化量(Cumulative mineralization,CM,單位:mg C·kg-1dry soil)。試驗培養周期為60 d。
1.2 土壤理化性質分析
將經礦化培養試驗后的根際土壤樣品進行理化性質分析。采用FiveEasyTMplus臺式pH計-FE28(Mettler Toledo,瑞士)測定土壤pH值。采用重鉻酸鉀氧化法測定總有機碳(Total organic carbon,TOC,單位:g·kg-1)。采用自動凱氏定氮儀K9840(海能,深圳)測定全氮(Total nitrogen,TN,單位:g·kg-1);采用氯仿熏蒸浸提法(TOC總有機碳/總氮分析儀-multi N/C 3100,耶拿,德國)測定微生物生物量(Microbial biomass,MB,單位:mg·kg-1)和微生物生物量氮(Microbial biomass nitrogen,單位:mg·kg-1);在MB和MBN分析中測定未熏蒸樣品中的可溶性有機碳(Dissolved organic carbon,DOC,單位:mg·kg-1)和可溶性有機氮(Dissolved organic nitrogen,DON,單位:mg·kg-1);采用可見分光光度計UV-8000(元析,上海)測定銨態氮(Ammonium nitrogen,NH4+-N,單位:mg·kg-1)和硝態氮(Nitrate-nitrogen,NO3--N,單位:mg·kg-1)。
1.3 數據處理
土壤有機碳礦化量、激發效應、相對激發相應、微生物代謝熵由公式1—4求得。
Cm=CHCl×(V0-V1)×30/m×1000
(1)
PE=Cn-Cc
(2)[14]
RPE=PE/Cc
(3)
qCO2=MR/MB
(4)
式中,Cm為土壤有機碳礦化量,單位:mg C·kg-1dry soil;CHCl為標準鹽酸溶液濃度,單位:mol·L-1;V0為滴定空白的鹽酸消耗量,單位:mL;V1為滴定堿液的鹽酸消耗量,單位:mL;m為根際土壤樣品的重量,單位:g;30為常數;1000為單位轉換系數;PE為激發效應,Priming effect,單位:mg C·kg-1dry soil,若為正值則是正激發效應(即促進土壤有機碳礦化),反之則是負激發效應(即抑制土壤有機碳礦化);Cn為施氮處理礦化量,單位:mg C·kg-1dry soil;Cc為對照礦化量,單位:mg C·kg-1dry soil;RPE為相對激發效應,Relative PE,單位:%;qCO2為微生物代謝熵,The metabolic quotient,單位:mg C·mg-1biomass C·d-1;MR為礦化速率,Mineralization rate,單位:mg C·kg-1·d-1;MB為微生物生物量,Microbial biomass,單位:mg·kg-1。
采用公式5擬合土壤有機碳礦化量速率、激發效應、相對激發效應,采用公式6擬合土壤累積礦化量。擬合值準確性使用均方根誤差和擬合度進行評價(公式7和公式8)。
y=a-bln(x+c)
(5)
y=a(1-e-kx)
(6)
(7)
(8)
式中,a,b,c均為模型擬合系數;RMSE為均方根誤差,root mean square error;R2為擬合度,R-squared;Ct為模擬值,C0為實測值,Cavg為平均值。
試驗數據采用IBM SPSS Statistics 22.0進行夏皮洛-威爾克檢驗(Shapiro-Wilk test)即正態性檢驗,正態性檢驗結果表明,各數據檢驗的P值均大于0.05,說明與正態性沒有顯著差異,成正態性分布(附表1)。在此基礎上,對試驗數據進行了單因素方差分析(one-way ANOVA)和Duncan差異顯著性檢驗(P<0.05)。用OriginLab Origin 2021作圖。
2 結果與分析
2.1 不同施氮量處理對芒草長期定植后的土壤有機碳礦化過程的影響
如圖1A所示,在試驗培養的第1~5 d,高氮處理下的土壤有機碳礦化速率大于低氮處理2.72%~28.59%,但在培養的第7 d開始,高氮處理下的土壤有機碳礦化速率小于低氮處理2.54%~24.76%。總體上,土壤有機碳礦化速率隨著培養時間增加而逐漸下降且下降趨勢趨于平緩,呈現對數曲線關系,施氮處理降低了土壤有機碳礦化速率,且施氮量越高,土壤有機碳礦化速率越低。礦化培養第7 d時,不同施氮量處理下的土壤有機碳礦化速率分別為21.60(CK),22.93(LN),22.35(HN) mg C·kg-1dry soil·d-1,且各處理間不存在顯著差異。從礦化培養的7 d后開始,各處理之間的土壤有機碳礦化速率開始逐漸產生顯著差異(P<0.01),且整體呈現對照>低氮>高氮趨勢。在第60 d時,礦化速率分別降至12.04(CK),7.77(LN),6.57(HN) mg C·kg-1dry soil·d-1,與第7 d相比,降低了44.26%,66.11%,71.95%。和對照相比,60 d后低氮與高氮處理下土壤有機碳礦化速率分別降低了35.47%和45.43%(圖1A)。
不同施氮量處理下的土壤累積礦化量也是以第7 d為分界點:在第7 d前,處理間無明顯差異;在第7 d后,處理間開始產生顯著差異,呈現對照>低氮>高氮(圖1-B)。第60 d與第7 d相比,不同施氮量處理下的土壤累積礦化量分別增加了84.26%(CK),80.01%(LN),75.52%(HN)(圖1-B)。60 d低氮與高氮處理下的土壤有機碳總礦化量較對照組分別降低了19.04%和27.85%,且高氮顯著低于低氮處理下土壤有機碳總礦化量的10.88%(圖2)。
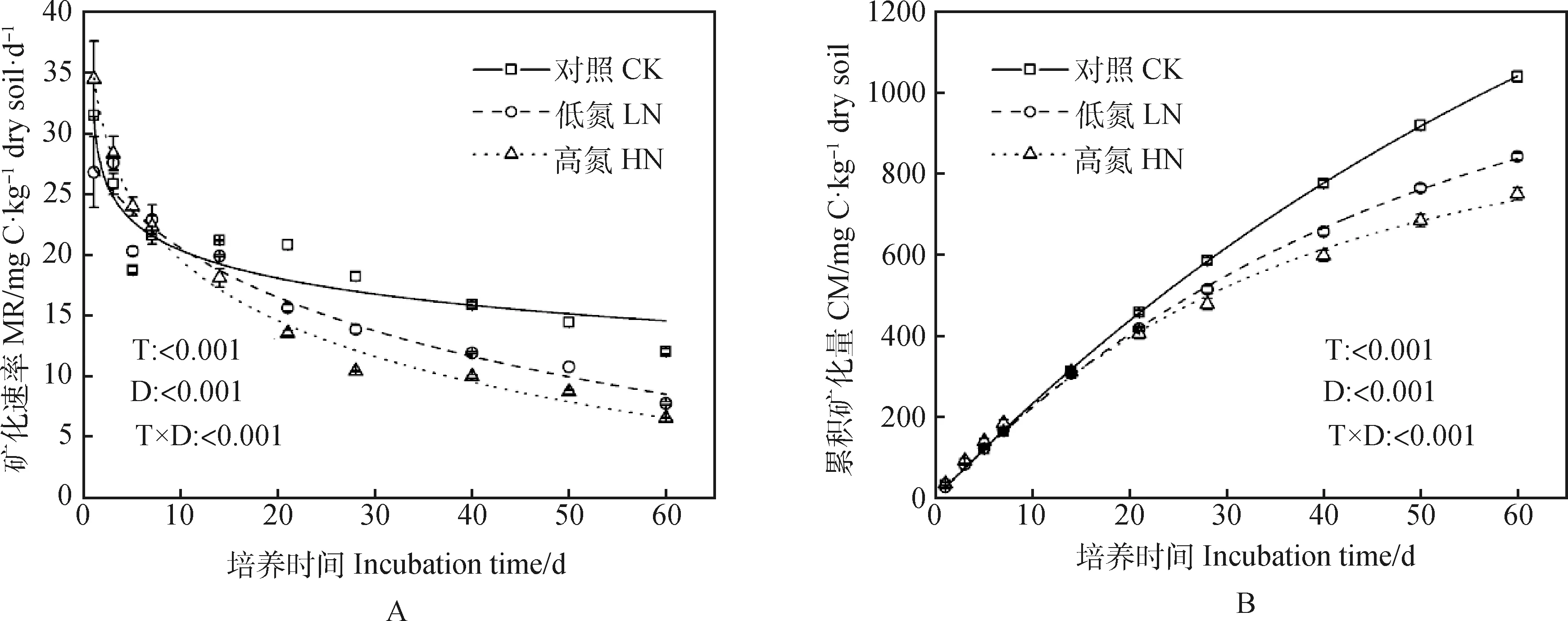
圖1 不同施氮量對芒屬植物長期定植后的根際土壤有機碳礦化過程的影響
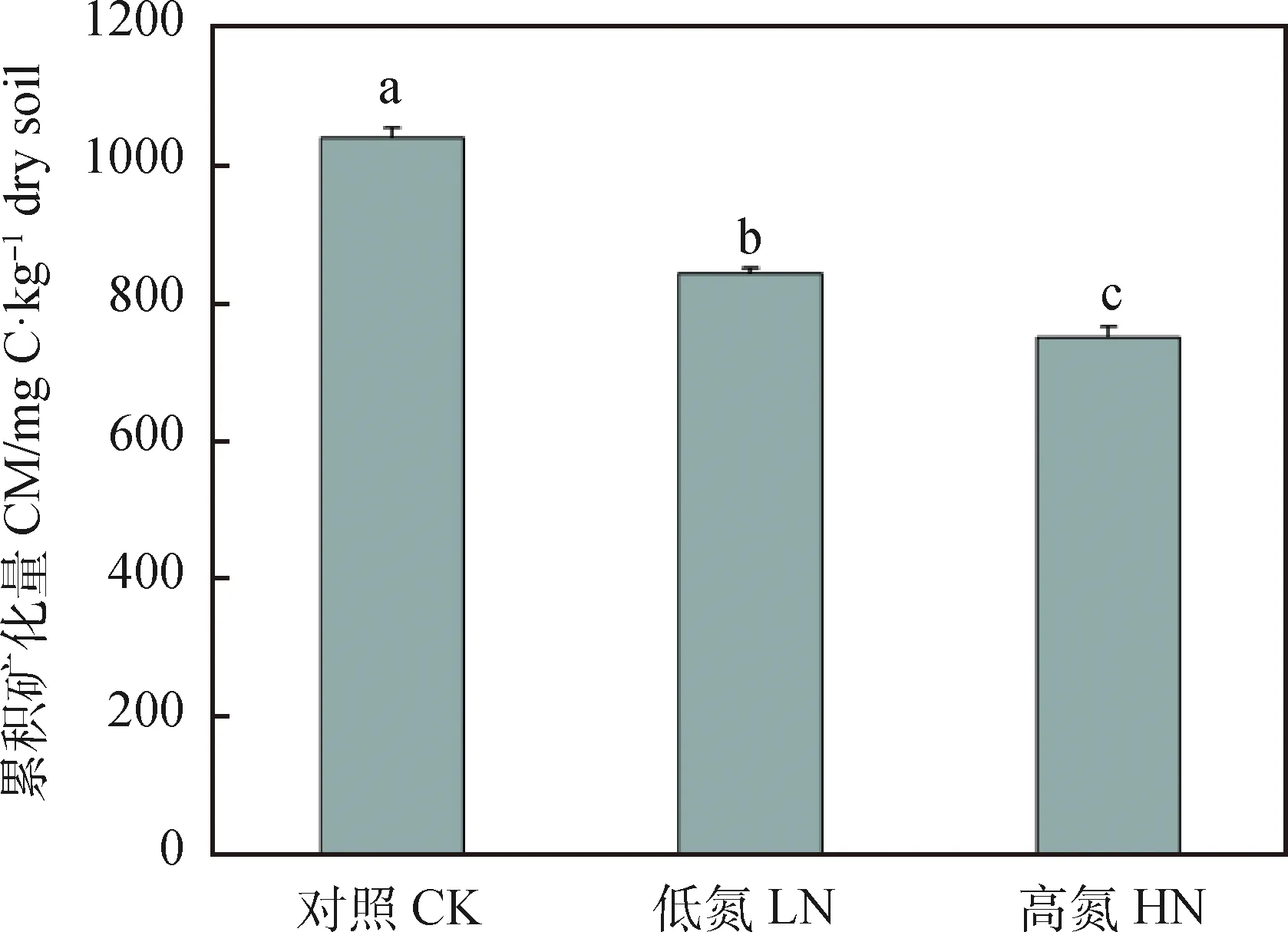
圖2 不同施氮量對芒草長期定植后的土壤礦化培養60 d后根際土壤有機碳總礦化量的影響
在試驗培養的前7 d,施氮處理下的土壤有機碳呈正激發效應,但在培養的第7 d開始,施氮處理下的土壤有機碳礦化呈顯著的負激發效應。大體上施氮對土壤固碳呈正作用,隨著施氮量的增加,激發和相對激發相應均會顯著降低(P<0.01)(圖3)。60 d后低氮與高氮處理下的土壤有機碳激發效應分別降至為-42.67和-54.67 mg C·kg-1dry soil,相對激發效應分別降至-35.44%和-45.40%。其一級反應方程土壤有機碳礦化量速率、累積礦化量、激發效應、相對激發效應的均方根誤差(Root mean square error,RMSE)與擬合度(R-squared,R2)如表1所示。其中,土壤有機碳礦化速率均方根誤差的值為0.752 1~1.950 6,說明該組實測值的離散程度較低;土壤有機碳累積礦化量的R2的值為0.996 2~0.999 8,約近于1,說明一級反應方程對累積礦化量實測值的擬合程度好。
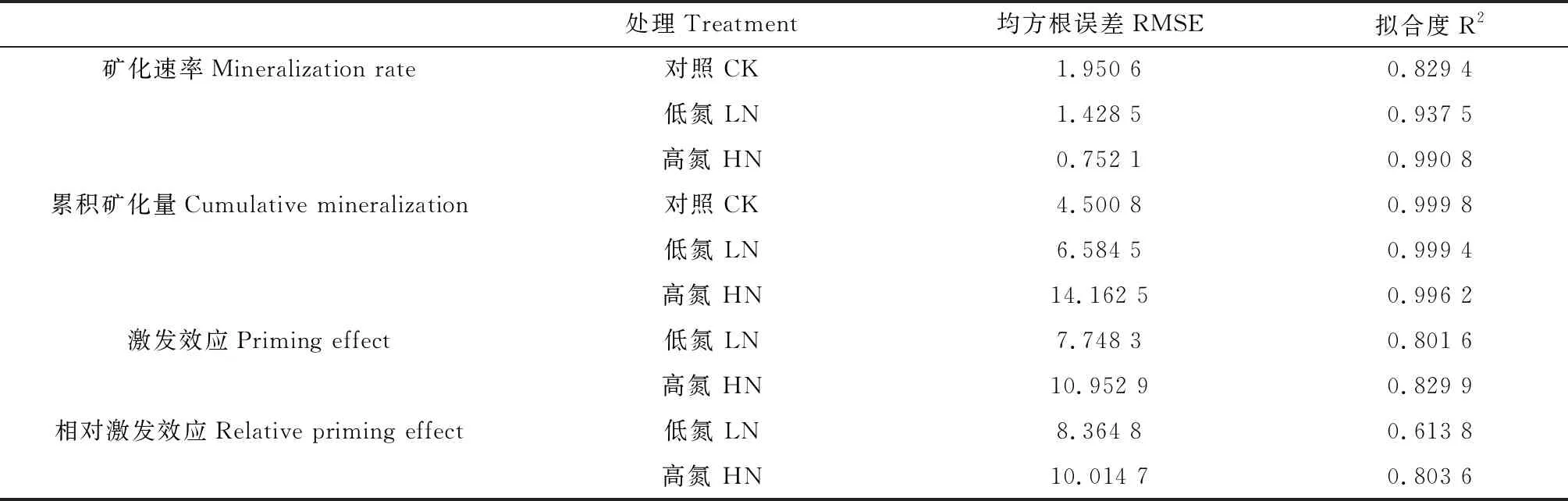
表1 土壤有機碳礦化量速率、累積礦化量、激發效應、相對激發效應擬合方程的均方根誤差與擬合度
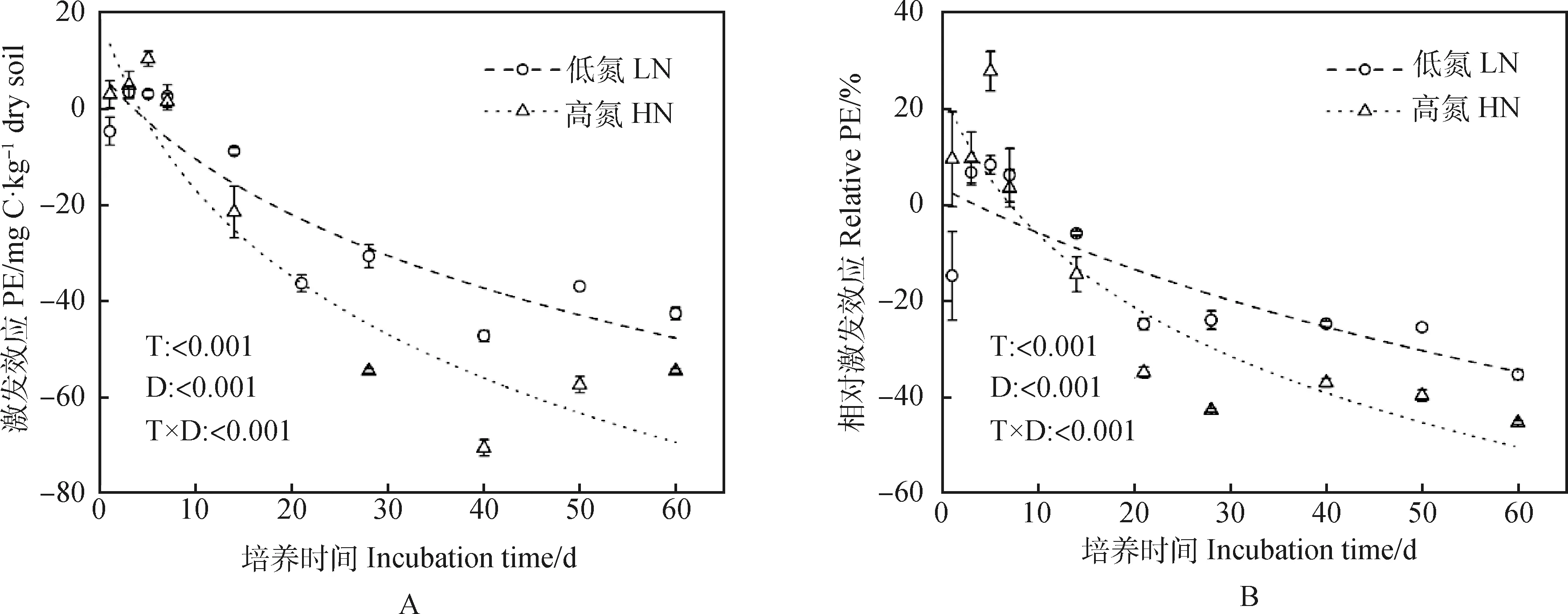
圖3 高氮和低氮處理對芒屬植物長期定植后的根際土壤有機碳礦化過程的影響
2.2 不同施氮量處理對礦化培養土壤理化性質的影響
不同施氮量處理下礦化培養后土壤理化性質差異如表2所示。施氮對土壤微生物生物量與微生物生物量氮的比值(MB/MBN)無顯著影響,但對土壤pH值、總氮(TN)、總有機碳(TOC)、可溶性有機碳(DOC)、可溶性有機氮(DON)、可溶性有機碳與可溶性有機氮的比值(DOC/DON)、微生物生物量(MB)、微生物生物量氮(MBN)、銨態氮(NH4+-N)、硝態氮(NO3--N)以及微生物代謝熵(qCO2)有顯著影響(P<0.05)。隨著施氮量的增加,土壤pH值、DOC、qCO2呈現下降趨勢,減幅分別為10.46%~14.07%,63.00%~68.36%,38.21%~46.44%。土壤TOC在低氮與高氮處理下無顯著差異,但與對照處理下的土壤有顯著差異(P<0.05);土壤TN與DOC/DON在對照與低氮處理下無顯著差異,但與高氮處理下的土壤具顯著差異,其中高氮組TN增加,DOC/DON下降。相較于對照組,土壤DON與NO3--N在低氮處理下顯著降低,高氮處理下顯著上升。不同施氮量處理下土壤MB,MBN與NH4+-N均顯著上升,且在低氮水平達到最高值,分別為272.62 mg·kg-1,42.59 mg·kg-1和33.14 mg·kg-1。
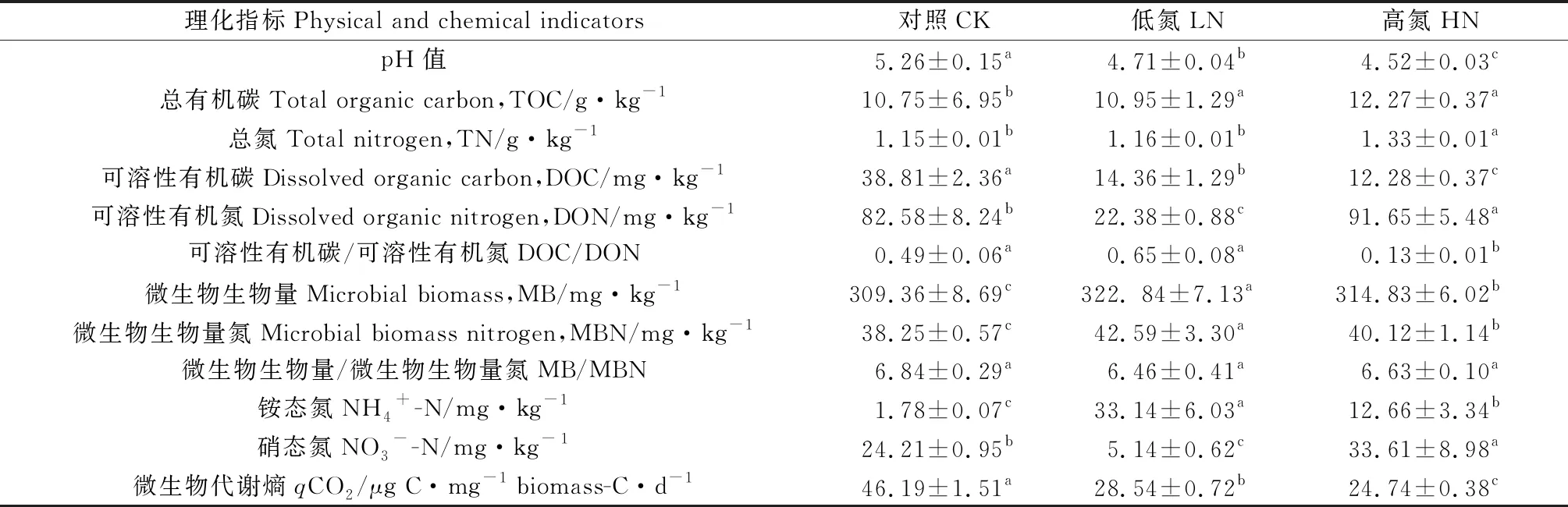
表2 不同施氮量對長期定植芒草根際土壤礦化培養后(60 d)理化性質的影響
分析不同施氮量處理下土壤理化指標及有機碳總礦化量之間的相關性發現(表3),供試土壤有機碳總礦化量(TM)與土壤pH值、總氮(TN)、可溶性有機碳(DOC)、微生物代謝熵(qCO2)之間均存在著極顯著正相關性關系(P<0.01),且作線性擬合得出最佳理論曲線及方程(圖4),擬合度為0.82~0.91;而與可溶性有機氮(DON)、可溶性有機碳與可溶性有機氮的比值(DOC/DON)、微生物生物量(MB)、微生物生物量氮(MBN)、銨態氮(NH4+-N)、硝態氮(NO3--N)之間無顯著相關性關系。土壤NH4+-N與NO3--N之間存在著顯著負相關性關系(P<0.05),而土壤DOC,DON,MBN之間均無顯著相關性關系,其中的土壤NH4+-N與DOC,DON,MBN之間呈現顯著負相關(P<0.05),土壤NO3--N與DON之間呈現顯著負相關(P<0.05)。
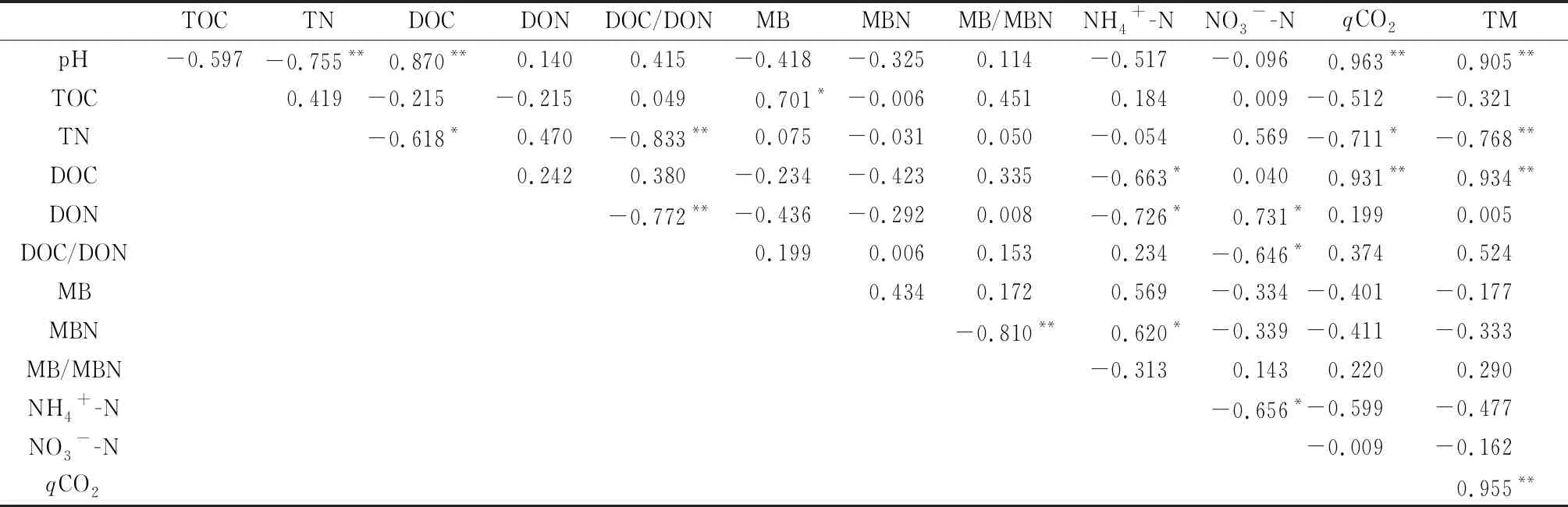
表3 土壤理化性質之間、土壤有機碳總礦化量與土壤理化性質的相關性
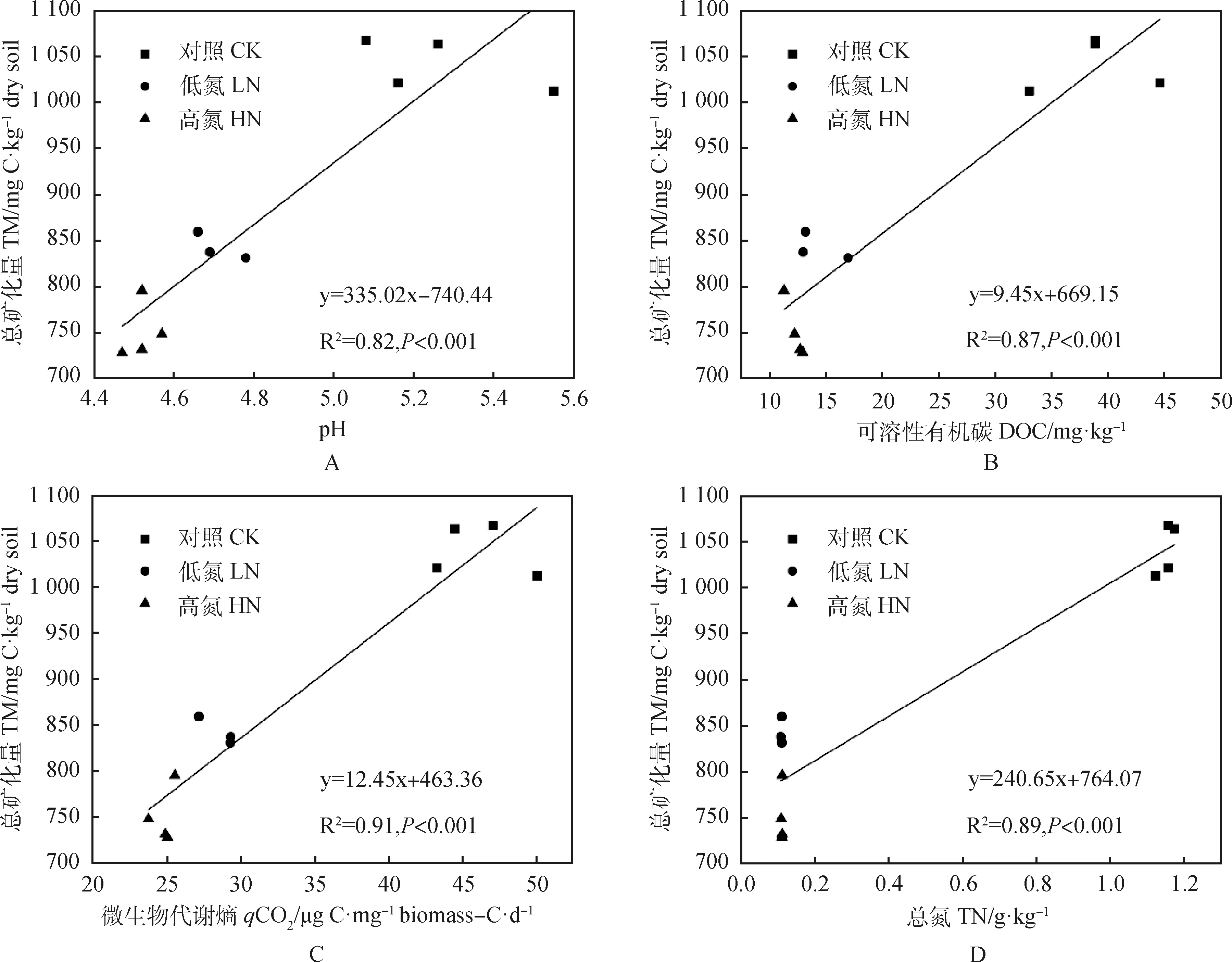
圖4 土壤有機碳總礦化量與土壤pH值、可溶性有機碳、微生物代謝熵、總氮的并置擬合圖
3 討論
本論文研究施氮對芒草修復后的貧瘠紅壤土壤礦化過程的影響,發現在試驗培養第1—5 d,高氮處理下的土壤有機碳礦化速率高于低氮處理2.72%~28.59%,且呈正激發效應,但在培養的第7 d開始,高氮處理下的土壤有機碳礦化速率低于低氮處理2.54%~24.76%,呈顯著的負激發效應。與對照組相比,60 d低氮與高氮處理下土壤有機碳礦化速率分別降低了35.47%和45.43%,土壤有機碳累積礦化量分別降低了19.04%和27.85%。可能是由于供試根際土壤中氮量受限,培養前期氮素處理對此起到緩解的作用,短時間內表現為土壤有機碳礦化速率增加,進而施氮對土壤礦化呈正激發效應。隨著培養時間的延長,土壤中易被利用的碳被大量消耗的同時,高氮與土壤中易被利用的碳反應也變得結構復雜化不易分解[19],兩者共同影響導致土壤中易被利用的碳含量降低,微生物碳源進而受到限制,所以在培養的第7 d后土壤有機碳礦化速率降低,呈現負激發效應。Zang等人對小麥(TriticumaestivumL.)根際土進行不同施氮量處理培養56 d后,土壤有機碳累積礦化量與對照(不加氮)相比下降了27%~42%,和本研究結果趨勢一致[14]。但其他研究也有發現施氮對土壤礦化會出現促進、抑制和無影響三種情況。對此差異,Zang等人分析了13項研究中施氮對土壤激發效應的影響,包括158項不同土壤類型和利用方式的試驗結果,表明大多數研究發現激發效應隨施氮量的升高而呈指數下降[14]。除此之外,也有研究認為施氮或會降低了酸性土壤pH值[20-21]、qCO2,從而改變了土壤理化性質,使土壤微生物呼吸速率降低[22],抑制土壤有機碳的礦化。綜上所述,在芒草改良后的土壤進行農業生產活動時,依然需要嚴格控制施氮量,以維持改良后的土壤質量。
土壤理化性質是體現土壤綜合質量的重要指標[23]。本研究以氯化銨作氮素對土壤進行處理,土壤pH值隨施氮量的增加而降低,這與前人的研究結果一致[24-25]。銨態氮可溶解在土壤溶液中,供植物直接吸收利用;也可被土壤膠體吸附呈交換態,通過硝化作用轉化為硝態氮并釋放出H+。與此同時,植物吸收NH4+的同時釋放H+以維持體內的電荷平衡,從而酸化土壤[26]。可溶性有機碳(DOC)是土壤微生物最容易利用的碳源,微生物代謝熵(qCO2)是指每單位微生物CO2排放速率,兩者均隨施氮量的增加而降低。說明微生物從土壤中吸收的有機碳更多用于其自身的生長發育,而不是轉化為CO2排放[14]。
不同施氮量處理下土壤微生物生物量(MB)、微生物生物量氮(MBN)均顯著上升,且在低氮水平達到最高值,分別為272.62 mg·kg-1,42.59 mg·kg-1,比高氮處理高2.54%,6.16%,而MB/MBN無顯著差異。和對照組相比,低氮處理中的MB,MBN含量上升,結果與前人研究相似[27]。朱靈等[27]認為這是由于在土壤本身氮素虧缺情況下,通過一定量的氮投入,使原本受氮素限制的土壤微生物含量與活性上升,因而使土壤MB,MBN含量在一定范圍內上升。本研究中,高氮處理下MB,MBN含量明顯降低,這是由于土壤中氮含量超過一定范圍后,造成土壤酸化和土壤團聚體結構改變[28-29],進而改變土壤微生物的生長環境,阻礙施氮對土壤MB,MBN的正激發效應。
目前關于施氮對土壤有機碳礦化影響的研究,其設定的最高施氮量為208 mg N·kg-1soil,暫未發現其氮閾值[14]。猜想若施氮量達到閾值的基礎上,再添加施氮量,其土壤有機碳礦化量為一定值,不再隨著施氮量的變化而變化,但仍需要更加詳細的試驗進行驗證。
4 結論
施氮顯著降低了芒草改良后貧瘠紅壤土壤有機碳礦化量且隨著施氮量的升高而降低,呈現負激發效應;施氮通過降低土壤pH值、土壤可溶性有機碳來抑制土壤有機碳礦化過程。隨著人為添加氮素的持續增加,修復后的邊際貧瘠紅壤有機碳的礦化作用會受到抑制,有利于土壤有機碳的穩定與積累。但對于改良修復后的貧瘠紅壤田間管理,施加少量氮肥更能豐富土壤微生物生物量,有利于作物生長;而施加大量氮肥反而導致土壤酸化,不利于耕作。

