大豆籽粒生育酚遺傳位點發(fā)掘及候選基因篩選
秦寧, 李俊茹, 田蕊, 邵振啟, 李喜煥*, 張彩英
(1.河北農(nóng)業(yè)大學農(nóng)學院,華北作物改良與調(diào)控國家重點實驗室,河北 保定 071001;2.河北農(nóng)業(yè)大學生命科學學院,河北 保定 071001)
生育酚(維生素E)是可溶于有機溶劑、粘稠油狀、淡黃色的物質(zhì),一般在大豆油和谷物種子的胚芽油中含量豐富[1-2]。已有研究證實,生育酚在植物體內(nèi)可參與多種生理生化代謝、信號轉(zhuǎn)導、基因表達調(diào)控和抵御多種逆境脅迫,因而在植物正常生長發(fā)育中具有重要功能[3-4]。同時,生育酚還具有較強的抗氧化功能,可有效防止或改善人類多種癌癥、心血管疾病、眼部疾病和神經(jīng)系統(tǒng)疾病等,故而在醫(yī)學、保健等領域具有重要研究價值[5-9]。
人體自身并不能合成生育酚,需從植物油中攝取[10]。據(jù)統(tǒng)計,天然生育酚的年生產(chǎn)量遠不能滿足市場需求,需求量以10%年增長量遞增[3]。油料作物種子的生育酚含量較其他農(nóng)作物高,并以油菜和大豆種子的生育酚含量更為豐富[11]。劉煥成等[12]測定不同大豆品種資源籽粒中的生育酚含量,發(fā)現(xiàn)總生育酚含量在 254 μg·g—1左右,且不同品種間的含量存在較大差異。由此可見,發(fā)掘利用大豆籽粒生育酚對滿足當前國際市場天然生育酚需求至關重要[13]。然而,生育酚屬于多基因控制的數(shù)量性狀,目前僅有少數(shù)學者針對大豆籽粒生育酚含量開展遺傳位點與候選基因發(fā)掘研究,所獲遺傳位點與基因不能滿足分子遺傳改良和遺傳機制解析。
梁慧珍等[14]通過測定大豆重組自交系(recombinant inbred line,RIL)群體γ-生育酚含量獲得9個控制其含量QTLs,位于4、5、7、8、9和18號染色體,表型貢獻率7.29%~29.55%。張紅梅等[3]檢測大豆重組自交系群體δ-、γ-和α-生育酚含量,獲得8個關聯(lián)QTLs,位于1、6、9、10、18和19號染色體,表型貢獻率為2.40%~6.18%。李海燕等[13]對大豆RIL群體進行生育酚含量QTL分析,結(jié)果在1、2、3、6、7、8、18和19號染色體檢測到連鎖QTLs。劉煥成[15]利用大豆RIL群體為材料,獲得66個生育酚及其組分含量相關QTLs,表型貢獻率為2.4%~32.6%,其中包括21個α-生育酚QTLs(10、15、18和19號染色體)、17個γ-生育酚QTLs(9、10、12、15、18和19號染色體)、13個δ-生育酚QTLs(10、12、15和19號染色體)和15個總生育酚QTLs(9、10、12、15、18和19號染色體)。最近,Zhan等[16]通過檢測大豆自然群體生育酚含量,獲得18個關聯(lián)標記,位于10條染色體(1、2、6、8、10、12、13、17、18和19號染色體)。Sui等[17]檢測大豆自然群體和重組自交系群體生育酚含量,分別獲得19個關聯(lián)標記與18個連鎖QTLs,其中包括1個位于2號染色體的關聯(lián)與連鎖分析共同檢測到的遺傳位點。
針對上述大豆生育酚遺傳位點與候選基因嚴重缺乏的問題,本研究利用大豆重組自交系群體,通過鑒定其籽粒總生育酚、α-生育酚及其占比、γ-生育酚及其占比以及δ-生育酚及其占比,明確群體生育酚遺傳變異及其相關性,挖掘其遺傳位點并篩選候選基因,為大豆生育酚含量分子遺傳改良和分子遺傳機制解析提供選擇標記與基因資源。
1 材料與方法
1.1 供試大豆材料
供試RIL群體(ZQ-RIL,F(xiàn)6:7)含283個家系,由河北農(nóng)業(yè)大學大豆遺傳育種團隊提供,于2016年6月種植于河北農(nóng)業(yè)大學作物育種中心,完全隨機區(qū)組試驗設計,行長1.5 m,雙行區(qū),行距0.5 m,3次重復,田間管理參考一般大豆田管理方法[18]。
1.2 試驗方法
1.2.1 大豆籽粒生育酚提取方法 隨機選取供試RIL群體各家系的健康飽滿、均勻一致、無損傷籽粒20~30粒,磨樣機(合肥榮事達小家電有限公司,GR150A)粉碎過60目篩;準確稱取磨粉0.05 g,加入1.5 mL 80%色譜乙醇(天津福晨化學試劑有限公司),振蕩混勻15 s;超聲波萃取15 min,靜置15 min,振蕩混勻20 s;超聲波再次萃取15 min,13 000 r·min—1離心 15 min;吸取上清用0.22 μm濾膜過濾[19]。
1.2.2 供試RIL群體籽粒生育酚測定方法 采用安捷倫1260型高效液相色譜儀[安捷倫科技(中國)有限公司]檢測提取液的 α-、γ-和 δ-生育酚含量[19]。色譜條件:熒光檢測器波長330 nm,流動相為色譜乙腈:色譜甲醇(90:10,天津福晨化學試劑有限公司),流速1 mL·min—1,柱溫40 ℃,進樣量20 μL,檢測時間14 min。
獲得的α-、γ-和δ-生育酚含量總和為總生育酚含量,同時計算各組分含量占總含量的比值[19]。
1.2.3 生育酚QTL定位與候選基因篩選 利用供試RIL群體籽粒α-、γ-和δ-生育酚、總生育酚含量以及α-、γ-和δ-生育酚占比共7個性狀,結(jié)合群體SNP遺傳連鎖圖譜,采用IciMapping V4.2軟件進行QTL定位[20]。
利用鑒定到的籽粒生育酚QTLs,在其區(qū)間范圍內(nèi)尋找候選基因(參考基因組為Williams82 a2v1),結(jié)合 RIL群體親本(鄭92116、齊黃30)籽粒不同發(fā)育時期轉(zhuǎn)錄組數(shù)據(jù),分析候選基因表達量,并依據(jù)基因表達量及其基因注釋,篩選與大豆生育酚含量相關基因。
1.2.4 數(shù)據(jù)分析方法 利用SPSS V21.0統(tǒng)計軟件對供試RIL群體7個性狀進行描述統(tǒng)計、方差分析和相關系數(shù)計算,利用GraphPad Prism 8軟件繪制7個性狀次數(shù)分布圖,利用HemI軟件制作候選基因表達量熱圖。
2 結(jié)果與分析
2.1 大豆RIL群體籽粒生育酚遺傳變異分析
通過分析供試大豆RIL群體各家系籽粒生育酚及其組分(表1)發(fā)現(xiàn),α-、γ-和δ-生育酚及總生育酚含量在不同家系間的差異極顯著;進一步分析各含量遺傳變異(表1)發(fā)現(xiàn),α-、γ-和δ-生育酚及總生育酚平均含量為7.10、127.86、65.65和200.61 μg·g—1,變異系數(shù)分別為 36.62%、9.53%、14.03%和9.24%,以α-生育酚含量的變異系數(shù)最大,說明供試群體生育酚及各組分含量存在豐富的遺傳變異。
同時還發(fā)現(xiàn),α-、γ-和δ-生育酚在總生育酚中的占比分別為3.54%、63.80%和32.66%,變異系數(shù)分別為35.59%、5.05%和8.70%,亦以α-生育酚占比的變異系數(shù)最高。另外,通過分析供試RIL家系籽粒生育酚及其各組分次數(shù)分布以及偏度系數(shù)和峰度系數(shù)(表1,圖1)發(fā)現(xiàn),偏度系數(shù)和峰度系數(shù)均接近0,說明供試RIL群體籽粒生育酚及各組分符合正態(tài)分布,屬于多基因控制數(shù)量性狀。
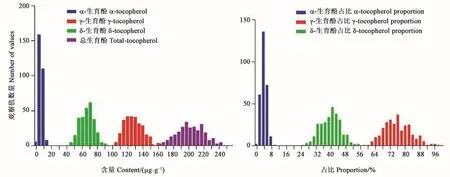
圖1 大豆RIL群體籽粒生育酚及其組分次數(shù)分布Fig.1 Distribution of seed tocopherol and its components in RIL population
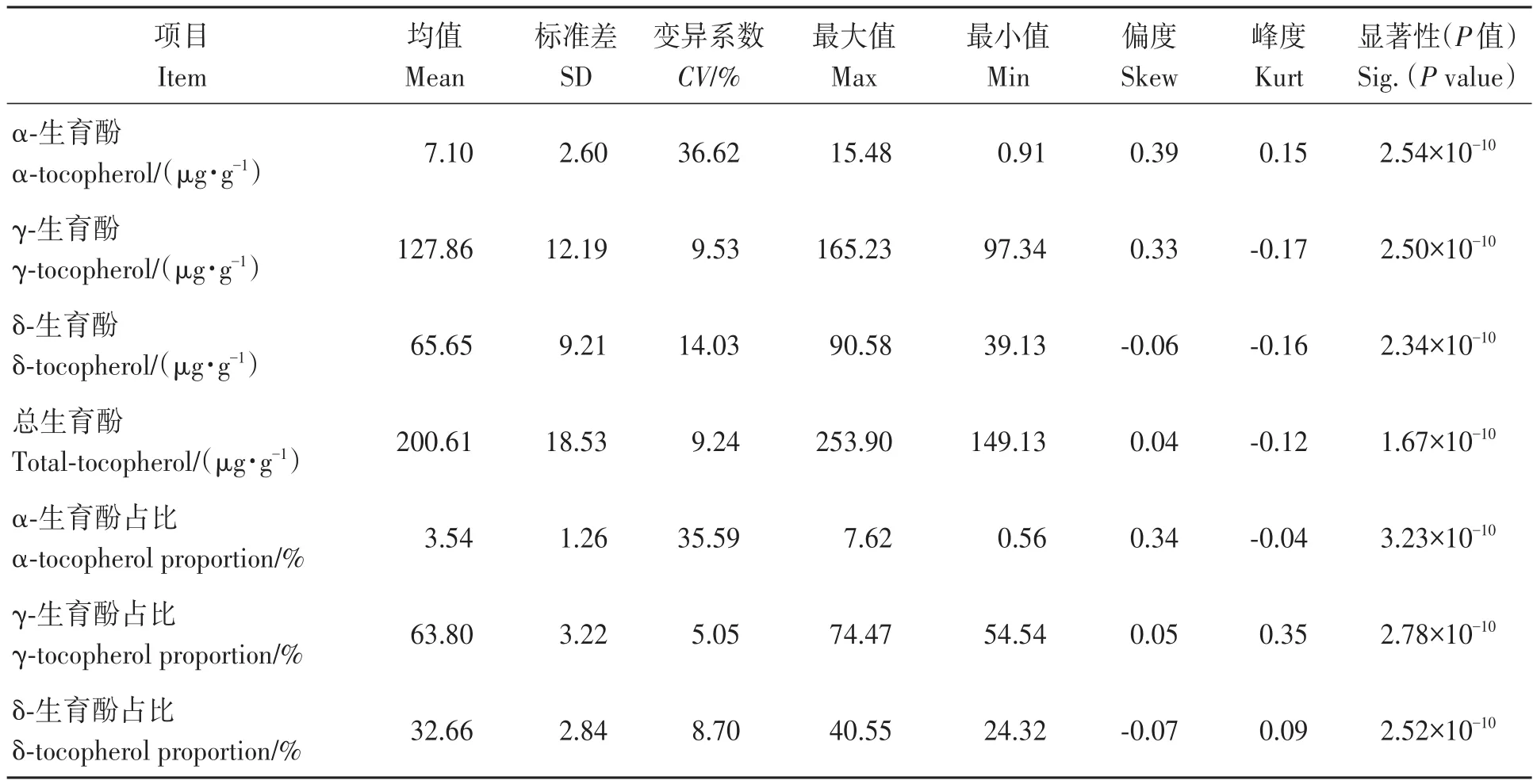
表1 供試大豆RIL群體籽粒生育酚及其組分遺傳變異Table 1 Genetic variations of seed tocopherol and its components in RIL population
2.2 大豆RIL群體生育酚及各組分相關性分析
通過分析供試大豆RIL群體籽粒生育酚及其組分間的相關系數(shù)(表2)發(fā)現(xiàn),總生育酚與3種組分含量間的相關系數(shù)均達到極顯著水平,并以總含量和γ-生育酚的相關系數(shù)最高(r=0.859),其次為總含量和δ-生育酚相關系數(shù)(r=0.803)。同時發(fā)現(xiàn)(表2),δ-生育酚與α-生育酚及γ-生育酚含量間的相關性也極顯著(r=0.256,r=0.410),而α-生育酚與γ-生育酚間的相關系數(shù)未達顯著水平(P>0.05)。
另外還發(fā)現(xiàn)(表2),δ-生育酚占比與γ-生育酚占比、γ-生育酚占比與α-生育酚占比呈現(xiàn)極顯著負相關(r=-0.921,r=-0.479)。同時,總生育酚與δ-生育酚占比、γ-生育酚占比的相關性也極顯著。上述各組分及總量間的相關性暗示供試大豆群體可能存在控制籽粒生育酚及其組分含量一因多效遺傳位點,為今后實現(xiàn)生育酚及其組分含量同步遺傳改良提供一定參考。

表2 供試大豆RIL群體籽粒生育酚及各組分相關系數(shù)Table 2 Correlation coefficients of tocopherol and its components in RIL population
2.3 大豆籽粒生育酚及其組分遺傳位點分析
2.3.1 大豆籽粒生育酚及其組分QTLs發(fā)掘 通過分析供試大豆RIL群體籽粒生育酚及其組分含量QTLs(表3)發(fā)現(xiàn),共檢測到7個一因多效QTLs,分別位于5、7、8、12、13、18和19號染色體,表型貢獻率分布在3.08%~21.92%之間。進一步分析(表3,圖2)發(fā)現(xiàn),位于8號染色體的qTOC-A2(ss715602131~ss715602331)可同時控制 α-生育酚、δ-生育酚、總生育酚含量、α-生育酚占比和γ-生育酚占比共5個相關性狀,表型貢獻率范圍3.85%~6.77%。位于5號染色體的QTL qTOC-A1可同時控制α-生育酚含量及其占比、γ-生育酚含量及其占比以及總生育酚含量共5個性狀,表型貢獻率范圍6.34%~21.92%,其中控制γ-生育酚、總生育酚和α-生育酚占比的貢獻率在10%以上(12.32%~21.92%)。并且還發(fā)現(xiàn),12和13號染色體分別存在1個控制生育酚及其組分一因多效QTL,其中12號染色體qTOC-H(ss715611499~ss7 15613700)可同時控制α-生育酚及其占比以及γ-生育酚占比,13號染色體qTOC-F可同時控制γ-生育酚與總生育酚含量。18號染色體QTL可同時控制δ-生育酚及其占比以及總生育酚含量,19號染色體QTL可同時控制α-生育酚及其占比,而7號染色體QTL可同時控制γ-生育酚與總生育酚含量。
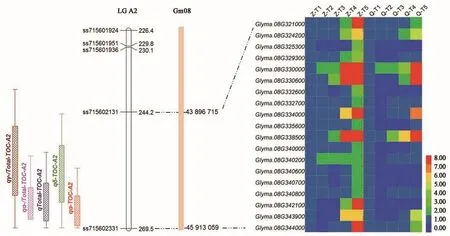
圖2 大豆8號染色體籽粒生育酚一因多效QTL及其候選基因Fig.2 Pleiotropic QTL and candidate gene for soybean seed tocopherol and its components on chromosome 8
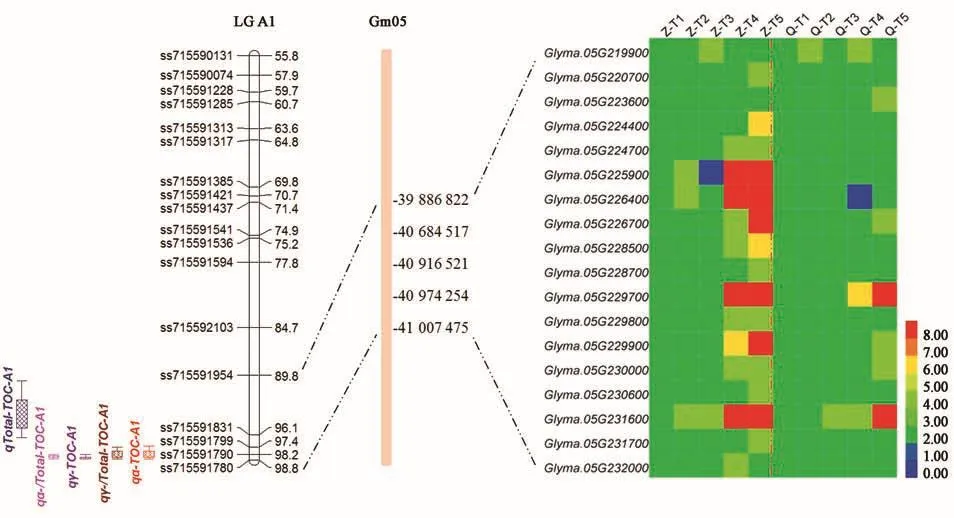
圖3 大豆5號染色體籽粒生育酚一因多效QTL及其候選基因Fig.3 Pleiotropic QTL and candidate gene for soybean seed tocopherol and its components on chromosome 5
2.3.2 大豆籽粒生育酚含量及其占比QTLs的比較 通過比較α-生育酚、γ-生育酚、δ-生育酚含量及其相應占比檢測到的QTLs(表3)發(fā)現(xiàn),各成分含量與相應占比間的定位結(jié)果并不完全一致,如5號染色體qTOC-A1、18號染色體qTOC-G和19號染色體qTOC-L生育酚組分及其占比定位結(jié)果一致,而7號染色體qTOC-M控制γ-生育酚與總生育酚,13號染色體qTOC-F控制γ-生育酚與總生育酚,但并未控制γ-生育酚占比,暗示控制大豆籽粒生育酚組分含量與組分占比的分子遺傳機制并不完全一致。
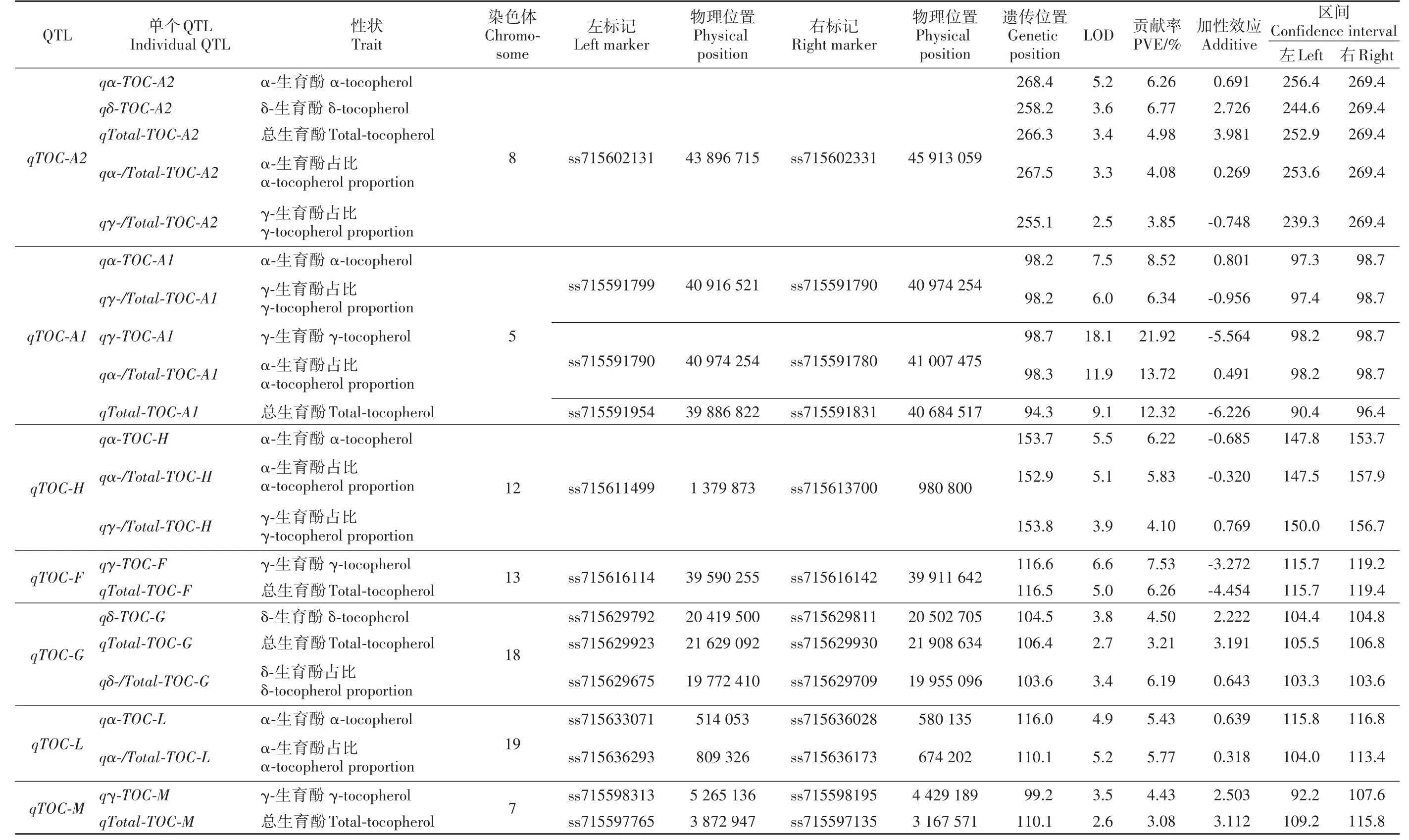
表3 供試大豆RIL群體籽粒生育酚及其各組分一因多效QTLsTable 3 Pleiotropic QTLs of seed tocopherol and its components in soybean RIL population
2.4 大豆籽粒生育酚及其組分候選基因篩選
為進一步篩選與大豆籽粒生育酚及其組分相關基因,本研究利用前期已有供試RIL群體親本“鄭92116”與“齊黃30”籽粒不同發(fā)育時期轉(zhuǎn)錄組數(shù)據(jù),分析上述QTLs區(qū)間候選基因,結(jié)果(圖2~4)表明,在上述QTLs區(qū)間存在多個差異表達基因,這一方面驗證了上述連鎖QTLs可靠性,另一方面為發(fā)掘控制大豆籽粒生育酚功能基因奠定了基礎。
在差異表達基因中(圖4),12號染色體候選基因Glyma.12G014200與Glyma.12G014300分別編碼生育酚o-甲基轉(zhuǎn)移酶與γ-生育酚甲基轉(zhuǎn)移酶,這2種酶均是大豆生育酚合成過程關鍵酶,且2個基因在“鄭92116”與“齊黃30”籽粒不同發(fā)育時期表達量存在差異;進一步分析發(fā)現(xiàn),Glyma.12G014200在“鄭92116”籽粒 T2~T4發(fā)育時期表達量呈現(xiàn)明顯上升趨勢,而在“齊黃30”籽粒發(fā)育不同時期沒有明顯變化,Glyma.12G014300則在“鄭92116”籽粒T5發(fā)育時期表達量呈現(xiàn)明顯上升,而在“齊黃30”籽粒發(fā)育不同時期無明顯變化。可見,Glyma.12G014200與Glyma.12G014300可能在大豆生育酚合成代謝過程中具有重要作用。
18號染色體候選基因Glyma.18G141100編碼尿黑酸茄尼酯轉(zhuǎn)移酶(homogentisate solanesyltransferase,HST),該酶是一種尿黑酸異戊烯基轉(zhuǎn)移酶(homogentisic aicd phytyl transferase,HPT),亦是大豆生育酚合成過程關鍵酶,分析該基因在不同大豆品種中差異表達,其在鄭92116的T3發(fā)育時期存在上升表達,而在齊黃30中沒有明顯變化(圖4),可見,該基因?qū)τ诖蠖股雍铣梢嗑哂兄匾饔谩?/p>
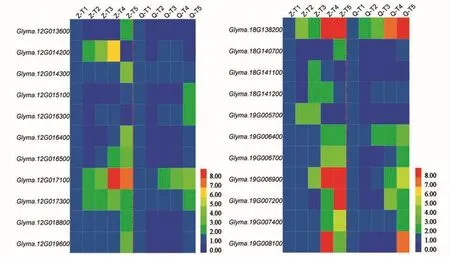
圖4 大豆12號、18號和19號染色體生育酚候選基因Fig.4 Candidate gene for soybean tocopherol on chromosomes 12,18 and 19
除上述候選基因外,本研究還發(fā)現(xiàn)(圖2、3),在大豆5、8號等染色體存在多個差異表達基因,這些基因中有的參與大豆籽粒脂肪合成或分解代謝過程,有的屬于轉(zhuǎn)錄因子。由于大豆生育酚屬于脂溶性維生素,因而其含量與籽粒脂肪含量密切相關,又因轉(zhuǎn)錄因子類基因具有調(diào)控下游一系列相關基因的強大功能,故本研究認為,這些候選基因?qū)τ谔岣叽蠖棺蚜I雍恳簿哂兄匾饬x。
3 討論
已有報道證實,大豆籽粒生育酚含量屬多基因控制數(shù)量性狀,發(fā)掘控制其遺傳位點及相關基因是實現(xiàn)其遺傳改良的重要途徑[13,15]。然而,到目前為止,關于大豆籽粒生育酚含量遺傳位點與候選基因發(fā)掘研究較少[16-17,21-25],挖掘的相關遺傳位點及候選基因遠不能滿足分子遺傳改良需求。鑒于此,本研究利用大豆重組自交系群體,通過鑒定其籽粒生育酚含量,結(jié)合群體SNP遺傳圖譜,開展生育酚組分及其總量遺傳位點發(fā)掘研究,同時結(jié)合團隊已有的RIL群體親本轉(zhuǎn)錄組數(shù)據(jù),篩選相關基因,共檢測到7個QTLs可同時控制多個生育酚組分及其總量,并篩選到多個可參與大豆生育酚合成代謝途徑相關基因,為實現(xiàn)大豆籽粒生育酚含量分子遺傳改良提供了選擇標記及基因資源。
通過比較本研究結(jié)果與前人報道遺傳位點發(fā)現(xiàn),18號染色體QTL qTOC-G的連鎖標記ss715629930(物理位置 21 908 634)與 Sui等[17]發(fā)現(xiàn)的δ-生育酚連鎖標記 Satt303(物理位置21 906 039)僅相距2 595 bp,并且Sui等[17]還發(fā)現(xiàn),Satt303標記與大豆生育酚環(huán)化酶(tocopherol cyclize,TC)連鎖,而該酶是在大豆生育酚合成過程中,將中間前體物質(zhì) MPBQ(2-甲基-6-植基-1,4-苯醌)和DMPBQ(2,3-二甲基-5-植基-1,4-苯醌)經(jīng)環(huán)化反應,催化形成δ-生育酚或γ-生育酚的關鍵酶。由此可見,18號染色體qTOC-G對于提高大豆籽粒δ-生育酚及其占比以及總生育酚含量有重要意義。同時,13號染色體qTOC-F與Sui等[17]報道的大豆總生育酚QTL部分重疊,其中連鎖標記Satt657(物理位置39 735 278)恰好位于本研究定位的qTOC-F區(qū)間內(nèi),與qTOC-F兩端標記物理位置分別相距約145和176 kb。另外,本研究5號染色體QTL qTOC-A1與Shaw等[24]報道的δ-生育酚和總生育酚QTL標記Satt174物理位置相距約947 kb。
除上述與前人研究物理位置相近QTLs外,本研究還定位到4個新QTLs,分別位于7、8、12和19號染色體。其中,8號染色體qTOC-A2物理位置在43.89~45.92 Mb,而前人報道的8號染色體控制大豆生育酚QTLs物理位置分別在0.18[22]、5.18[24]和36.36 Mb[16],與本研究qTOC-A2物理距離較遠。并且,本研究12號染色體qTOC-H物理位置在0.98~1.38 Mb,而前人報道的12號染色體QTLs物理 位 置 分 別 在 13.42~15.14[23]、17.12[16]、32.04~33.41[23]、36.57 Mb等[24],距本研究qTOC-H較遠;而且,本研究還在qTOC-H區(qū)間篩選到編碼大豆生育酚o-甲基轉(zhuǎn)移酶與γ-生育酚甲基轉(zhuǎn)移酶的候選基因Glyma.12G014200與Glyma.12G014300,這 2個基因在供試RIL親本間存在表達差異(圖4)。由此可見,12號染色體qTOC-H及其2個候選基因在大豆生育酚合成過程中發(fā)揮著重要功能。
另外,通過分析前人已獲得的19號染色體大豆生育酚QTLs發(fā)現(xiàn),其物理位置分別在2.27~5.41[23]、8.75 ~20.71[23]、34.35 ~34.76[3]、37.04[16]、45.12 ~47.07 Mb[23],連鎖性狀包括α-生育酚、γ-生育酚、δ-生育酚及總生育酚,而本研究在19號染色體0.51~0.81 Mb區(qū)間定位到1個新的可控制α-生育酚及其占比QTL(qTOC-L),并且在該QTL區(qū)間篩選到多個在RIL群體親本間存在表達量差異的候選基因。綜上,本研究獲得的大豆籽粒生育酚遺傳位點及其候選基因,豐富了現(xiàn)有大豆生育酚控制位點與基因,為進一步開展生育酚遺傳改良與機制解析奠定了重要基礎。

