知母多糖對甲亢熱證大鼠肝臟代謝的影響
趙金椽,南洋,陳平平,劉樹民
(黑龍江中醫藥大學,黑龍江 哈爾濱 150040)
中藥藥性是對中藥發揮療效的物質基礎和對病證治療作用的高度概括[1]。但由于中藥成分具有多途徑、多靶點協同作用的復雜性,很難通過常規研究來詮釋中藥整體寒、熱藥性的科學內涵,這成為中藥藥性理論研究工作中的難點[2]。而借助現代科學技術手段,中藥的藥性歸屬有望通過動物實驗以及系統生物學等方法予以科學闡釋[3]。現代研究表明,寒性中藥對機體基礎代謝率有抑制作用,對神經系統、免疫系統、物質能量代謝系統、內分泌系統和生殖系統均可產生不同程度的影響[4]。同時,現代生物學研究認為,熱證的本質是由于中樞興奮性神經細胞的激活,啟動了神經系統網絡,使內分泌、免疫等系統的物質能量代謝發生不同程度的提升[5]。由于熱證模型與物質能量代謝息息相關,因此通過觀察寒性藥物對熱證模型代謝產物的干預效果,可以完善中醫證候物質基礎和寒性中藥藥性的評價方法,進一步豐富和詮釋中藥性味理論的科學內涵[6]。
知母是臨床常用的寒性藥,其藥性歸屬已從神經、內分泌調節和物質能量代謝干預等方面被證實[7],然而其藥效發揮的具體作用機制與藥性表征的核心物質基礎仍有待研究。多糖是細胞表面信號識別、抗原抗體反應、細胞間信息的傳遞和感受的關鍵因子,對于具有生物活性的多糖的研究日益受到重視[8]。知母多糖(Rhizoma Anemarrhenae polysaccharide,RAPS)是知母的主要活性成分之一[9]。藥理學研究顯示,RAPS 具有抗病毒、抗腫瘤、抗氧化、調節免疫、降血糖等多種作用[10]。為進一步總結知母的藥性歸屬并深入研究其藥理作用,筆者觀察了RAPS 對典型熱證模型[11]大鼠肝臟代謝的干預作用,以期從物質能量代謝角度揭示中醫熱證的實質和RAPS 及知母對機體作用的內在機制。
1 材料與方法
1.1 實驗動物
雄性SD 大鼠24 只,由黑龍江中醫藥大學實驗動物中心提供,SPF 級,體質量(220 ± 20)g,生產許可證編號:SCXK(黑)3013-004,使用許可證號:SYXK(黑)2013-012。飼養環境溫度(22 ± 2)℃,相對濕度55%~65%,9 時—21 時人工燈光照明,標準大鼠飼料喂養,自由飲水,適應性喂養1 周后用于實驗。實驗動物的飼養和使用經院內動物保護委員會許可。
1.2 實驗藥物、制備及主要試劑
知母生藥材購自世一堂中藥材有限公司,產地為河北安國,批號:130916;優甲樂左甲狀腺素鈉片(優甲樂,德國默克公司);乙腈(色譜級,Dikma 科技公司);甲酸(色譜級,Dikma 科技公司);亮氨酸-腦啡肽(美國Sigma-Aldrich公司)。
RAPS 提取參照知母拆分組分制備方法[12],將知母生藥材與純化水按照體積比1∶10 浸泡12 h 后,95 ℃回流浸提3 次,每次1 h,合并藥液后,用80%乙醇過夜沉淀3 次,取上清液,旋轉蒸發得浸膏,過D101 大孔樹脂,經水洗脫得RAPS 水溶液,總提取率2.3%,凍干粉于4 ℃存放;用研缽將優甲樂研成細粉,純凈水溶解混勻,配成濃度為12 mg/mL 的優甲樂混懸溶液。
1.3 實驗儀器
AL204 電子天平(Mettler Toledo 儀器上海有限公司);AcquityTMUPLC 超高液相色譜儀、Premier LCT XE 型TOF-MS 質譜儀(美國Waters 公司)。
1.4 實驗方法
1.4.1 分組、造模、給藥
將24只大鼠隨機分為3組:對照組(K 組)、模型組(M 組)和RAPS 給藥組(D 組),每組8 只。于每日9 時給予M 組和D 組大鼠優甲樂混懸液進行造模,優甲樂給藥劑量為120 mg/kg,K 組給予等體積蒸餾水;同時于每日17 時給予D 組大鼠RAPS 24.8 mg/kg,相當于生藥1 080 mg/kg(2020 版《中華人民共和國藥典》中記載的臨床最高日劑量生藥量),K 組和M 組給予等體積蒸餾水,連續15 d。
1.4.2 肝臟樣品采集
末次給藥后禁食12 h,用20%烏拉坦將大鼠麻醉,于相同部位取各組大鼠肝臟,迅速置于液氮中冷凍,用預冷生理鹽水制成10%肝組織勻漿。
1.4.3 代謝物分析
1.4.3.1 色譜柱
BEHC18 色譜柱(2.1 mm × 100 mm,1.7 μm,Waters),流動相:A 為乙腈(0.1%甲酸),B 為水(0.1%甲酸),柱溫:40 ℃,進樣量:2.00 μL;梯度洗脫條件見表1。
式中,Mijk為存儲在第k排貨架,第i列、第j行貨位的貨物的質量;h為貨位高度;xijk為判斷貨位是否為空的決策變量。
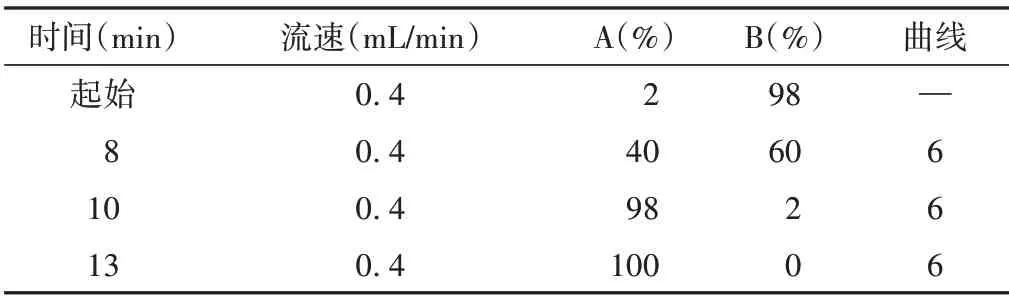
表1 UPLC洗脫條件
1.4.3.2 質譜條件
質譜條件見表2。準確質量校正采用亮氨酸-腦啡肽([M + H]+= 556.277 1,[M - H]-= 554.261 5),校正溶液進樣速度為100 μL/min,校正頻率為15 s,采集范圍為m/z 50~1 500 Da。

表2 質譜條件
1.4.3.3 代謝組數據分析
本研究采用Progenesis QI 軟件,導入代謝組數據后,對各組數據進行非監督主成分分析(PCA)和監督型主成分分析(OPLS-DA),然后選取各組變量重要性投影(VIP)>1,組間差異P<0.05 的代謝物。經HMDB 數據庫比對,對各組所得差異代謝物進行定性,并運用MetaboAnalyst 5.0 平臺[13]對代謝通路分析。
2 結果
2.1 代謝物分析
三組PCA分析結果見圖1。正、負離子模式下均可見各組間明顯分離,各組內高度聚集,表明各組代謝物主成分差異顯著。分別將M組與K組(M/K組)、D組與M組進行比對(D/M組),得到M組與D組的顯著差異代謝物,經與HMDB數據庫比對后鑒定得到M/K組差異代謝物共11個,D/M組共10個,兩組共有6個。見表3。

表3 組間比對差異代謝物
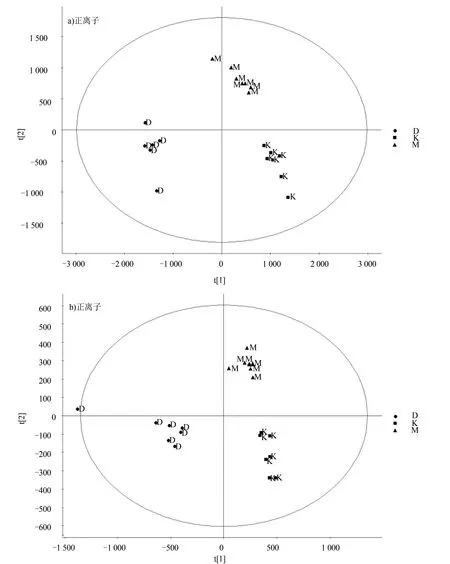
圖1 三組PCA結果圖
2.2 代謝通路分析
將M/K組和D/M 組差異代謝物分別進行代謝通路顯著性分析,選擇數據庫代表物種為大鼠,富集分析運用超幾何分布檢驗,拓撲學分析運用中介中心算法。代謝通路顯著性分析結果見圖2。兩組結果均顯示甘油磷脂代謝(glycerophospholipid metabolism)最為顯著(P<0.001),且磷脂酰膽堿(PC)、磷脂酰乙醇胺(PE)、磷脂酸(PA)同時參與此途徑。進一步分析發現,M/K組結果中M 組PC 下調,PE 和PA 上調;同時,D/M 組結果中D 組PC 上調,PE 和PA 下調。可見其所引起的主要代謝通路變化為互逆過程。此外,由PC參與的亞油酸代謝(linoleic acid)在兩組變化均具有統計學意義(P<0.05)。
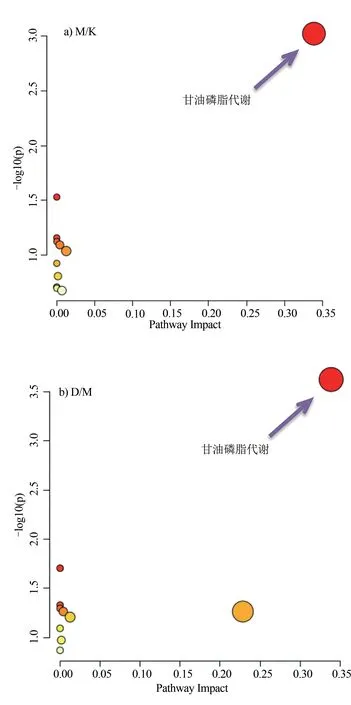
圖2 差異代謝物通路顯著性分析氣泡圖
3 討論
PC、PE與PA皆為甘油磷脂代謝的核心節點,且三者可通過不同途徑互相轉化[14]。甘油磷脂是機體內含量最多的一類磷脂,與許多代謝類疾病相關,其異常變化是肝臟代謝異常的特征之一[15]。在肝臟,脂質通過與膽堿親合,促進脂肪以磷脂的形式由肝臟通過血液向外輸送,并增強脂肪酸在肝臟的利用,這是熱證機體物質能量代謝提升的一大表現[16]。由實驗結果可知,熱證模型大鼠肝臟中PC 下調,PE 和PA 上調,表明PC的利用增強,向PE和PA發生了轉化,并由此引發甘油磷脂代謝的異常,這也是熱證的一種特征表現[2,16-17];而給予RAPS 的大鼠PC 上調,PE 和PA 下調,逆轉了此代謝通路的變化,是RAPS 藥效發揮與寒性藥性在代謝層面的具體體現;此外,由PC 表達量變化引起的亞油酸代謝的顯著改變可知,PC 是整個代謝通路的關鍵節點。見圖3。
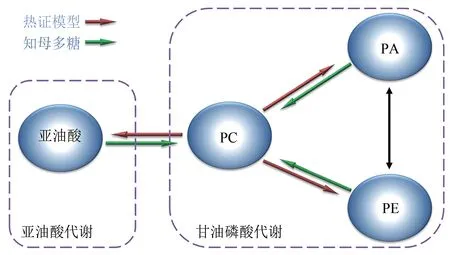
圖3 知母多糖對模型甘油磷脂代謝調節示意圖

