三維熒光光譜結合二階校正算法對兩種植物病原菌快速定性定量分析
蔡魯寧,劉雪茹,陳 磊,李 欣,2,3, ,古紹彬,
(1.河南科技大學食品與生物工程學院,河南 洛陽 471023;2.河南科技大學微生物資源開發與利用校級重點實驗室,河南 洛陽 471023;3.河南省食品微生物工程技術研究中心,河南 洛陽 471023)
傳統的微生物鑒定方法主要是通過形態學觀察并輔以生化實驗對微生物種屬進行判斷[1],存在操作復雜繁瑣,耗時費力,準確率不高等缺點。分子生物學鑒定方法雖然能夠實現準確分類,但需要專業的機構和人員且操作成本高。使用熒光檢測儀器快速獲得微生物樣本的數據信息,并依據微生物獨特的信息表達實現微生物的快速分類和定量,是一種新穎的研究角度。三維熒光光譜技術具有選擇性好、靈敏度高、測試快速等優點。二階校正可以在干擾存在的情況下對組分進行定性定量分析,這一特點也被稱為二階優勢[2]。三維熒光光譜結合二階校正算法目前已在農藥檢測[3]、食用植物油真偽鑒別[4]、酚類物質檢測[5]、原油檢測[6?7]、水環境[8?9]、醫藥[10]等眾多領域中廣泛應用。
熒光光譜分析技術在微生物鑒別方面已有研究,例如,通過紫外線激發的固有熒光可實現細菌和酵母物種的區分[11],KANG等[12]使用三維熒光光譜實現口腔中7種不同細菌的鑒定。此外,內源熒光法作為一種更便捷、靈敏的研究方法,在細菌鑒別方面受到廣泛關注[13]。目前,利用三維熒光光譜技術對單一體系下的純種微生物進行檢測鑒定的研究較多。然而,在對含有多種微生物的復雜體系中目標微生物的定性和定量分析鮮有研究。黃瓜細菌性角斑病與霜霉病癥狀表現類似,給黃瓜細菌性角斑病的診斷和預防增加了難度,黃瓜細菌性角斑病與霜霉病的區分是諸多學者研究黃瓜病害的熱門話題[14],黃瓜細菌性角斑病的病原菌是丁香假單胞菌黃瓜致病變種(Pseudomonas syringaepv. Lachrymans,PSL),它的檢測通常依據形態學、生理生化檢驗和分子生物學鑒定等方法實現[15],三維熒光光譜分析技術能否成為PSL的檢測方法仍值得探究;小麥赤霉病是由多種鐮孢菌侵染所引起的小麥病害,禾谷鐮孢菌(Fusarium graminearum)是其中之一[16],赤霉病能夠使小麥種子發芽生長受阻[17],病麥中含有多種真菌毒素包括脫氧雪腐鐮刀菌烯醇(DON)和玉米赤霉烯酮(ZEN)等[18?19],能導致人畜中毒,因此,探尋快捷而又經濟的病原菌檢測方法對于小麥赤霉病的預防具有重大意義。
本文以黃瓜細菌性角斑病病原菌丁香假單胞菌黃瓜致病變種(Pseudomonas syringaepv.Lachrymans-8,PSL-8)[20?21]和小麥赤霉病病原菌禾谷鐮孢菌(Fusarium graminearum-ACCC37687)[22?23]為研究對象,運用三維熒光光譜分析技術快速鑒別植物真菌病害和細菌病害的病原微生物,探索三維熒光光譜分析技術快速識別植物真菌細菌病害的可行性。通過收集梯度混合菌液樣本的三維熒光光譜數據,探究二階校正算法對三維熒光光譜數據進行解析、提取特征激發和特征發射波長的能力,對特征波長熒光強度數據和菌液在600 nm波長下的吸光度(OD600)進行多元線性回歸從而建立濃度預測模型,使用留一法交叉驗證(Leave-One-Out Cross Validation,LOOCV)衡量模型預測性能,進而實現復雜的菌液混合體系下對單組分的定性定量分析。
1 材料與方法
1.1 材料與儀器
LB液體培養基:酵母浸粉5 g、胰蛋白胨10 g、氯化鈉10 g 北京奧博星生物技術有限責任公司;PDA斜面培養基 青島海博生物技術有限公司;丁香假單胞菌PSL-8 中科院植保所趙廷昌教授惠贈;禾谷鐮孢菌 中國農業微生物菌種保藏管理中心,菌株編號:ACCC37687。
Smart Fluo-Pro Flex One型三維熒光光譜儀北京卓立漢光儀器有限公司; LDZX-30KBS型立式壓力蒸汽滅菌鍋 上海申安醫療器械廠;SW-CJ-1FD型潔凈工作臺 蘇州安泰空氣技術有限公司;H1650-W型醫用離心機 湖南湘儀實驗室儀器有限公司;THZ-92C臺式恒溫振蕩器 上海躍進醫療器械有限公司;DNP-9022型電熱恒溫培養箱 北京市永光明醫療儀器廠;722s可見分光光度計 上海精密科學儀器有限公司。
1.2 實驗方法
1.2.1 單菌液制備
1.2.1.1 丁香假單胞菌菌液制備 將活化后的丁香假單胞菌菌液按百分之一接種量接種到LB液體培養基,28 ℃、220 r/min振蕩培養15 h,菌液離心7000 r/min,10 min,棄上清,用無菌雙蒸水制成菌懸液,檢測吸光度OD600,用無菌雙蒸水將OD600調整到0.5[24]。
1.2.1.2 禾谷鐮孢菌孢子懸液制備 在超凈工作臺中挑取小塊禾谷鐮孢菌菌塊接種到滅菌的PDA斜面培養基上,28 ℃培養3~5 d,將培養好的禾谷鐮孢菌菌種斜面,倒入5 mL無菌水,輕輕將PDA培養基表面的孢子刮下,將孢子懸液置于已滅菌的50 mL三角瓶內,瓶內預先放置數粒無菌玻璃球,采用充分振蕩后滅菌的紗布(180 r/min,10 min,28 ℃,八層紗布)進行過濾,即得孢子懸浮液。一組實驗需要9~10個禾谷鐮孢菌菌種斜面。檢測孢子懸浮液吸光度OD600,用無菌雙蒸水將OD600調整到0.5[25]。
1.2.2 混合菌液制備 將制備得到的丁香假單胞菌菌液(OD600=0.5)和禾谷鐮孢菌孢子懸液(OD600=0.5)梯度混合,每個樣本期望OD600如表1所示共11個梯度。后續建立濃度預測模型需要擴大樣本量,為了擴大樣本量同時驗證低濃度下混合菌液熒光的規律性,建模時混合菌液OD600從0.5調整到0.2,括號內為建模時每個樣本的期望OD600,收集40組混合菌液樣本三維熒光光譜信息用于建模。設置激發波長范圍為200~450 nm,步長為5 nm,共51個激發波長;發射波長范圍為260~800 nm,步長0.4 nm,共1351個激發波長,積分時間是1 s。按照以上設置掃描三維熒光光譜,每一組光譜數據量為11×51×1351,將光譜數據輸入MATLAB軟件進行預處理、數據解析和建模。
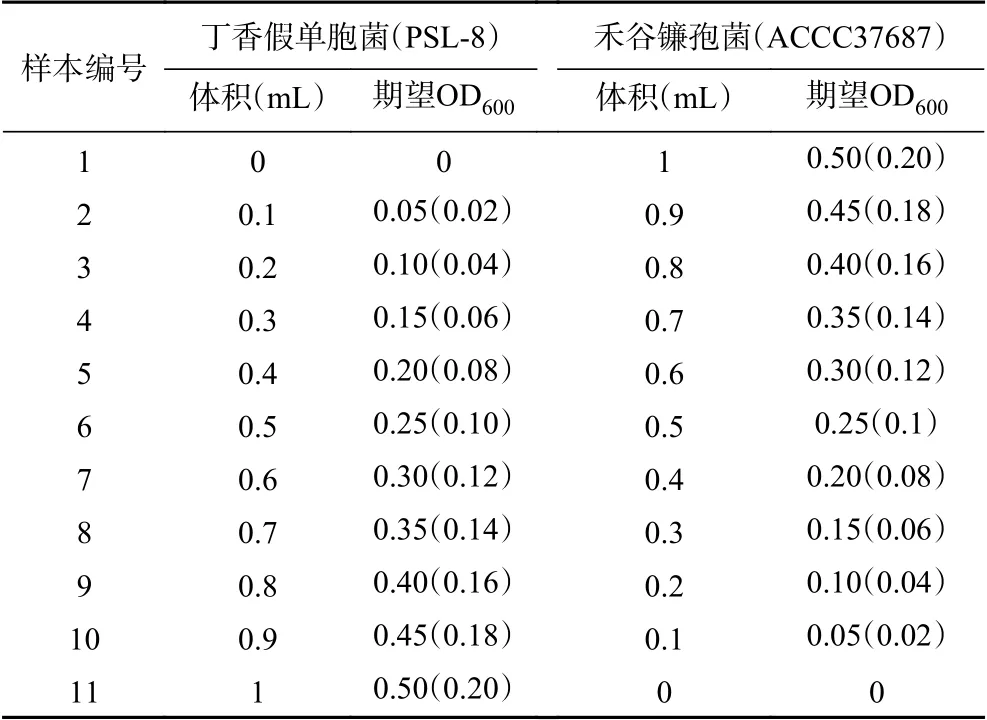
表1 混合菌液濃度梯度設置及期望OD600 Table 1 Concentration gradient setting and expected OD600 of mixed bacteria solution
1.3 數據處理
1.3.1 熒光數據預處理 對采集到的熒光光譜數據進行預處理來消除瑞麗散射的干擾。瑞麗散射一般在發射波長等于1倍或2倍激發波長區域及其臨近區域(±10~15 nm左右)[7]。先將瑞麗散射區域數據扣除,采用Delaunay三次多項式插值方法,以瑞麗散射相鄰區域的數據為基準進行三次多項式插值。然后使用(Savizkg-Golag,SG)多項式曲面平滑[26]來消除圖譜中的噪音毛刺,并將預處理后的三維熒光光譜數據用于后續分析。
1.3.2 核心一致性診斷(CORCONDIA) 正確的組分數對于平行因子分析(Parallel Factor Analysis,PARAFAC)算法提取正確的特征波長起到關鍵的作用,CORCONDIA法[27]通過計算Tucker3模型中的超對角矩陣與最小二乘擬合陣之間的相近程度來估算組分數,相近程度用核心一致值來衡量。核心一致函數計算公式如下:
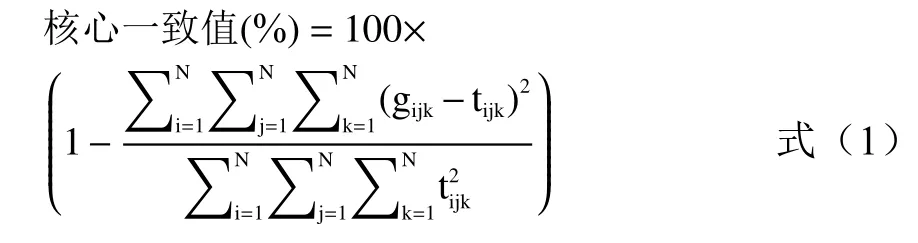
式中,gijk是Tucker3模型超對角矩陣元素;tijk為單位超對角矩陣;N是模型組分數;i、j、k分別表示三維熒光數據陣對應的第i個激發波長、第j個發射波長和第k個混合菌液樣本。
當預測組分數N小于等于正確組分數時,計算得到的核心一致值越接近100%,此時模型符合三線性;N大于正確組分數時,計算得到的核心一致值接近0,模型偏離三線性。當組分數取到N時核心一致值大于60%,此時N-1就是正確組分數[2]。
1.3.3 三線性模型 將菌種熒光實驗設定為I個激發波長和J個發射波長,對梯度濃度下的K個樣本進行三維熒光光譜數據收集,得到大小為I×J×K的三維數據陣X[3]。三維數據陣的元素(i,j,k)設置為Xijk,則Xijk的表達式如下:

式中,ain是相對激發矩陣A(I×N)中的元素,bjn是相對發射矩陣B(J×N)中的元素,ckn是相對濃度陣C(K×N)中的元素。eijk是相對殘差數陣E(I×J×K)中的元素。N是對樣品體系中貢獻響應信號的所有組分數,包括感興趣組分、儀器噪聲干擾組分和樣品溶液雜質干擾組分[28]。
1.3.4 平行因子分析(PARAFAC) Harshman在1970年提出了平行因子分析(Parallel Factor Analysis,PARAFAC)算法[29],通過對以下目標函數的最小化求解相對激發矩陣A、相對發射矩陣B、相對濃度陣C:
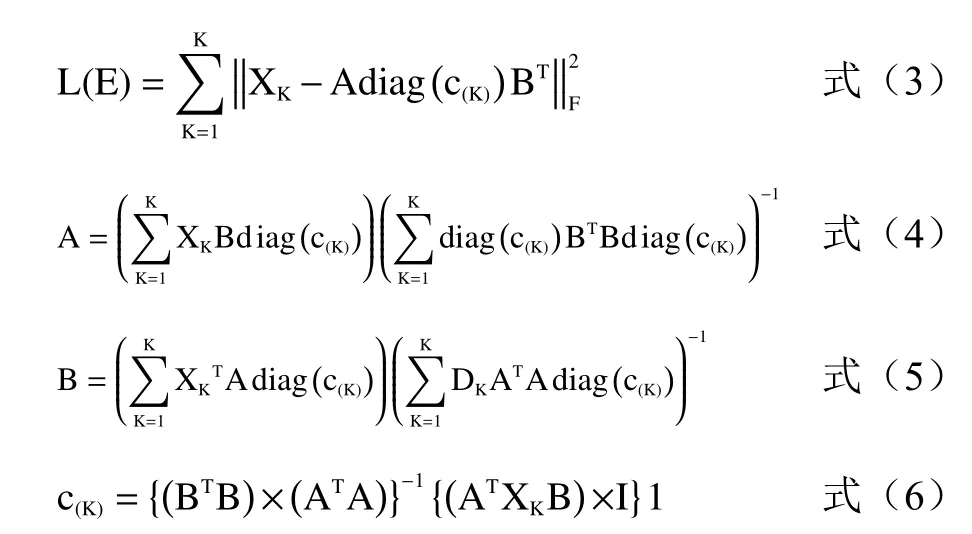
PARAFAC算法同時進行的另外一個過程是將三維數據陣展開成二維數據陣,分別沿三個方向進行交替分解[30]:
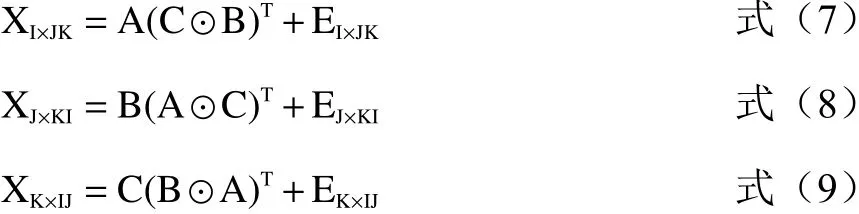
以上公式最小化可得:
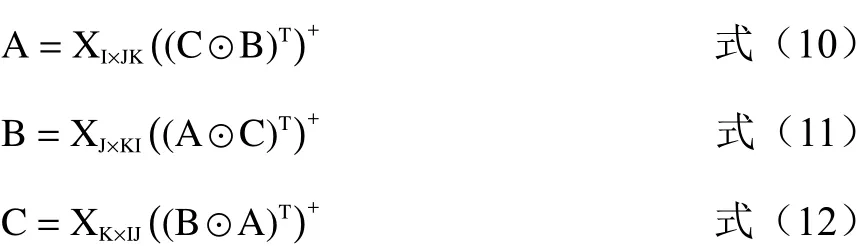
迭代計算過程如下:
第一步:確定樣本體系的組分數N;第二步:相對激發矩陣A和相對發射矩陣B的初始化;第三步:根據相對激發矩陣A和相對發射矩陣B計算相對濃度陣C;第四步:根據對相對發射矩陣B和相對濃度陣C計算相對激發矩陣A,并且將相對激發矩陣A歸一化;第五步:根據相對激發矩陣A和相對濃度陣C計算相對發射矩陣B,并且將相對發射矩陣B歸一化;第六步:根據相對激發矩陣A和相對發射矩陣B計算相對濃度陣C,重復第4~6步,直到(SSRE(m)?SSRE(m?1))/SSRE(m?1)≤1×10?6
1.3.5 交替三線性分解(ATLD) 吳海龍在1998年提出了交替三線性分解(Alternating Trilinear Decomposition,ATLD)算法[31],相比于PARAFAC算法,ATLD提出了切片矩陣和廣義逆運算的思想,將三維數據陣沿三個方向的切片矩陣為單位對相對激發矩陣A、相對發射矩陣B、相對濃度陣C進行分解解析,如下:

1.3.6 自加權交替三線性分解(SWATLD) 自加權交替三線性分解(Self-weighted Alternating Trilinear Decomposition,SWATLD)是在ATLD基礎上進行了改進,將每個矩陣的迭代更新公式優化[7],例如對相對激發矩陣A的更新如下:

SWATLD與ATLD思路一致,因此具有ATLD具有的對組分不敏感,收斂快的優點,同時緩解了ATLD對背景噪聲信號敏感的缺點。
1.3.7 交替懲罰三線性分解(APTLD) 交替懲罰三線性分解(Alternating Penalty Trilinear Decomposition,APTLD)是將平行因子分析(PARAFAC)和自加權三線性分解(SWATLD)兩種算法進行組合優化[4],在三線性模型目標函數中引入約束條件,將求解問題轉變為約束條件下的最優解問題,同時引入懲罰項將有約束問題變成無約束問題[32]。以相對激發矩陣A為例:
矩陣A元素殘差平方和定義為:
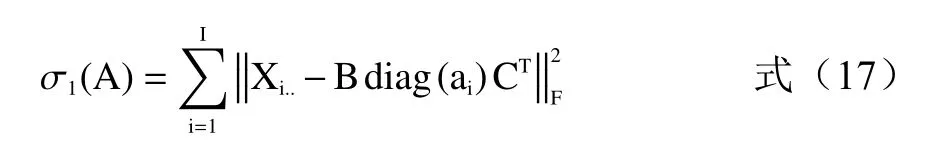
式中:F為三維數據陣X中的主因子數;A是相對激發矩陣、B是相對發射矩陣、C是相對濃度陣;Xi..、為三維數據陣X的第i個水平矩陣(J×K);ai為載荷陣A的第i行矩陣;diag(ai)、為ai對應的U×U階對角矩陣;U是所有對熒光做出貢獻的組分數。
相對激發矩陣A定義為:
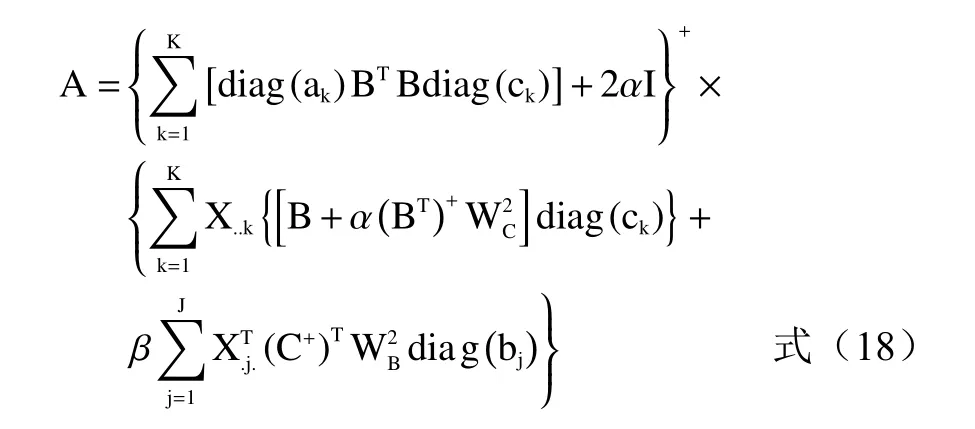
式中:A+、B+、C+分別為A、B、C的Moore-Penose廣義逆矩陣,上標+為廣義逆;WA、WB、WC為權重矩陣;α、β為平行因子分析(PARAFAC)與自加權三線性分解(SWATLD)的權重。
1.3.8 偏最小二乘回歸系數法(PLS) 偏最小二乘回歸系數法(Partial Least Squares,PLS)分別對混合菌液樣本特征激發和特征發射波長進行提取[33?34]。偏最小二乘回歸系數法是通過分別構建禾谷鐮孢菌和丁香假單胞菌混合菌液下梯度上升和梯度下降的濃度值對激發光譜和發射光譜的回歸模型,波長的回歸系數代表該波長的貢獻比重,回歸系數的絕對值越大,代表該波長對回歸模型預測性能的影響程度越大。
1.3.9 留一法交叉驗證(LOOCV) 留一法交叉驗證(Leave-One-Out Cross Validation,LOOCV)可以驗證混合菌液濃度預測模型的性能,每次只留下一個樣本做測試集,其它樣本做訓練集,直至所有樣本均充當過測試集和驗證集,模型預測能力由相關系數R、交叉驗證決定系數R2cv、預測均方根誤差RMSEP來衡量[35]。相關系數R和交叉驗證決定系數R2cv越接近1、預測均方根誤差RMSEP越小,表明濃度預測模型的性能越好,準確率越高,模型得到的預測值越接近真實值。
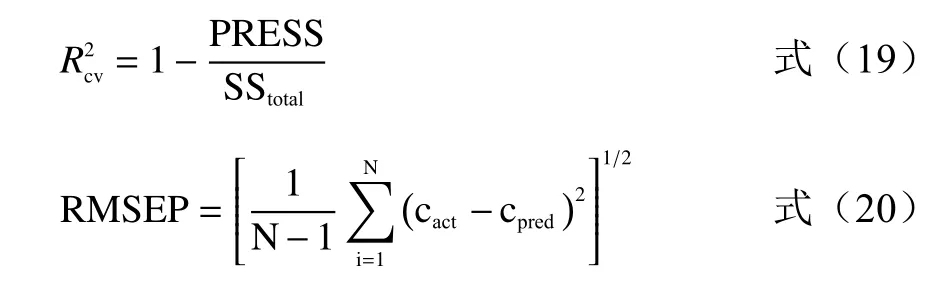
式中PRESS是預測殘差平方和,SStotal是總平方和,cact和cpred分別是實際樣本濃度和預測樣本濃度。
2 結果與分析
2.1 熒光數據預處理結果
圖1(A)是OD600=0.5的丁香假單胞菌和禾谷鐮孢菌混合菌液的原始三維熒光光譜圖,圖1(B)是去除瑞麗散射再經過SG平滑處理后的三維熒光光譜圖。通過前后對比發現,采集混合菌液的三維熒光數據時出現的瑞麗散射強度非常高以至于產生瑞麗墻,位于等高線圖的右下方,原始三維熒光光譜的特征信息受到瑞麗散射形成的背景墻的干擾而難以凸顯真實的三維熒光光譜信息。由圖1(B)可以發現,去除瑞麗散射再經過SG平滑處理后,右下方的瑞麗散射墻被消除,混合菌液的特征峰位置信息得以呈現,完整保留熒光信息的同時能夠有效消除瑞麗散射帶來的不良影響,為后續特征信息的提取工作打下良好的基礎。
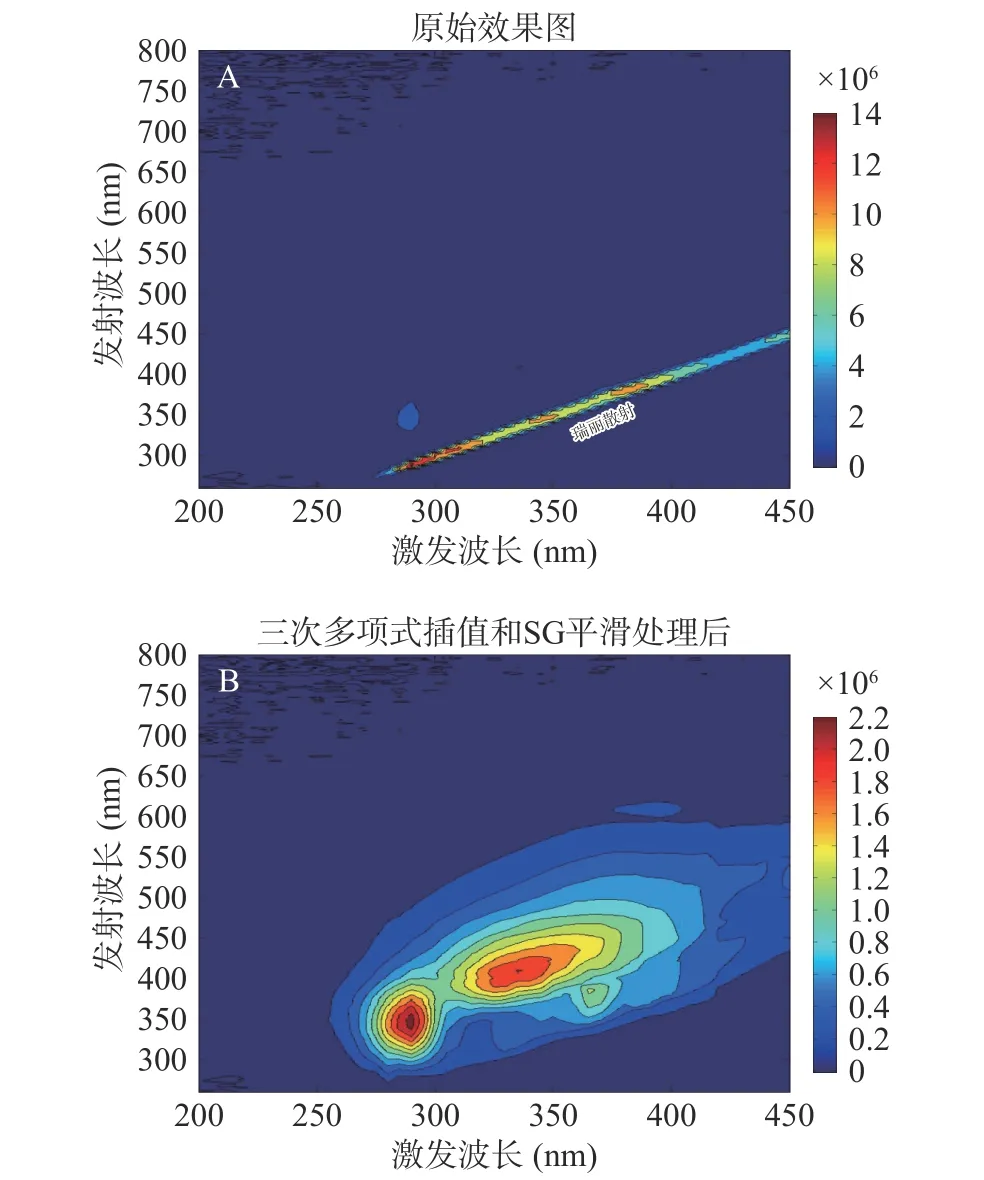
圖1 混合菌液SG平滑處理前和SG平滑處理后的光譜等高線圖Fig.1 Spectral contour map of mixed bacterial solution before and after SG smoothing treatment
2.2 單一菌種的三維熒光光譜圖
圖2(A)是OD600=0.5的丁香假單胞菌經過SG平滑處理后的光譜圖,圖2(B)是OD600=0.5的禾谷鐮孢菌經過SG平滑處理后的光譜圖。丁香假單胞菌和禾谷鐮孢菌的波峰位置和熒光強度清晰可見,差異明顯,說明丁香假單胞菌和禾谷鐮孢菌在混合菌液定性分析時相互干擾較小。丁香假單胞菌波峰位置為激發/發射(Ex/Em)=285~290 nm/336~360 nm,禾谷鐮孢菌波峰位置為激發/發射(Ex/Em)=340~390 nm/410~470 nm。為實現混合菌種定量分析,需確定單一菌種所對應出峰位置,并與各類方法分解光譜圖數據得到的每一組分出峰位置做出比較,依此判斷每一組分所對應的菌種類別。
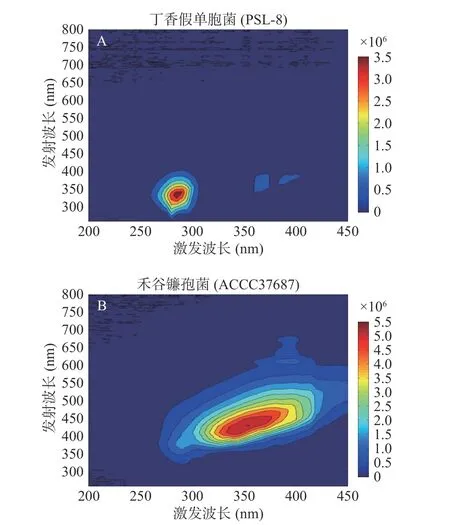
圖2 丁香假單胞菌(PSL-8)和禾谷鐮孢菌(ACCC37687)使用SG平滑處理后的光譜等高線圖Fig.2 Spectral contour map of Pseudomonas syringae pv.Lachrymans-8 and Fusarium graminearum- ACCC37687 smoothed by SG
2.3 組分數確定
在進行三線性模型分解解析時,組分數的確定是分解過程中極為關鍵的一環,尤其是在使用平行因子分析時,需要找到合理的組分數[36]。雖然交替三線性分解對組分數不敏感,但是過高或者過低的組分數都會導致計算模型的誤差[5],合適的組分數會使結果更加準確。故用核心一致性診斷(CORCONDIA)對預處理后的三維熒光光譜進行組分數的確定。圖3反映了OD600=0.5混合菌液不同組分數所對應的核心一致值。
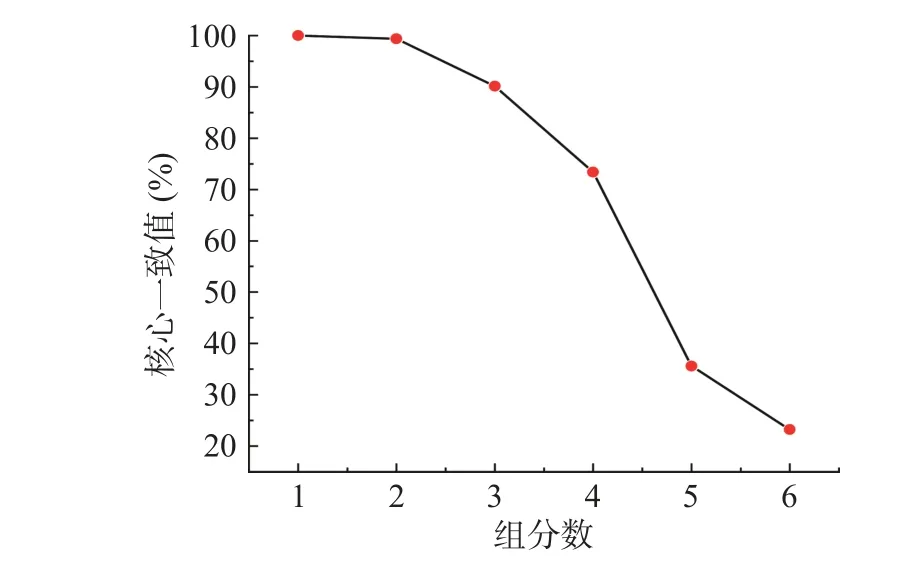
圖3 不同組分數對應的核心一致值Fig.3 Core consistent values of different component scores
隨著組分數的增加,核心一致值逐漸降低,1~4組分時核心一致值大于60%,當組分數大于4的時候核心一致值小于60%,故混合菌液的最佳組分數應是4。
2.4 使用二階校正算法對混合菌液樣品進行分析
將最佳組分數設定為4,分別使用交替三線性分解(ATLD)、平行因子分析(PARAFAC)、自加權三線性分解(SWATLD)、交替懲罰三線性分解(APTLD)對OD600=0.5混合菌液樣品三維熒光光譜進行分解解析。會得到每一組分的相對激發強度光譜、相對發射強度光譜和組分相對濃度。四種組分的激發波長出峰位置清晰可見并且相互獨立,未出現出峰位置交疊的情況,組分之間無相互干擾。分析激發發射光譜數據可以得到各個組分所對應的熒光峰出峰位置,匯總結果至表2。
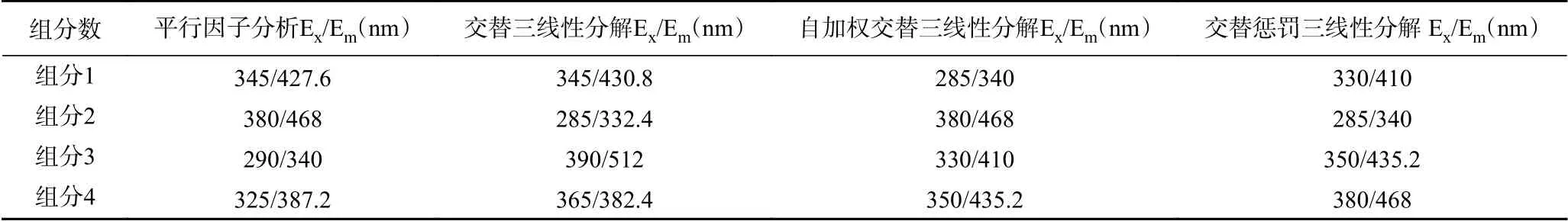
表2 在4組分下用二階校正算法分解出的每一組分出峰位置Table 2 Peak position of each component decomposed by second-order correction algorithm under 4 components
將二階校正算法分解光譜得到的各個組分的激發光譜發射光譜波峰位置與單一丁香假單胞菌和禾谷鐮孢菌激發光譜發射光譜波峰位置相比較,對比每一組分波峰位置下的熒光強度變化趨勢,結合菌種濃度變化規律,把既滿足組分波峰位置和菌種波峰位置一致,又滿足波峰位置熒光強度變化規律和菌種濃度變化規律一致的組分視為該菌種的特征組分,特征組分的波峰位置視為該菌種的特征波長。可以看出每一算法都能分解出一個符合丁香假單胞菌波峰位置和一個符合禾谷鐮孢菌波峰位置的組分。由于采集三維熒光光譜時激發波長Ex的步長設置為5 nm,可以看出每種方法提取出的丁香假單胞菌的特征組分波峰位置只相差1~2個步長,波峰位置具有高度相似性,提取出的禾谷鐮孢菌特征組分波峰位置也有相同的規律。將四種二階校正算法提取出的丁香假單胞菌和禾谷鐮孢菌相對激發光譜圖(A)、相對發射光譜圖(B)和組分相對濃度圖(C)匯總進行對比,如圖4。
由圖4(A)和圖4(B)可以看出四種二階方法所提取出來的丁香假單胞菌的相對激發光譜峰形相似,相對發射光譜也具有高度一致性,出峰位置激發/發射(Ex/Em)=285(290)/332.4(340) nm。禾谷鐮孢菌激發光譜和發射光譜峰形亦是如此,具有高度一致性,出峰位置激發/發射(Ex/Em)=380(390)/468(512) nm。由圖4(C)可以看出,四種二階方法預測濃度曲線趨勢大致相同,可以分解出上升趨勢和下降趨勢兩種曲線,符合實驗設計的丁香假單胞菌濃度逐漸升高、禾谷鐮孢濃度逐漸降低的規律。使用交替三線性分解(ATLD)、自加權交替三線性分解(SWATLD)、交替懲罰三線性分解(APTLD)獲得的濃度曲線規律更明顯,而平行因子分析(PARAFAC)在相同的熒光數據下的獲得的濃度曲線在2號樣品和8號樣品出現異常浮動。

圖4 二階校正算法獲得的OD600=0.5混合菌液丁香假單胞菌和禾谷鐮孢菌相對激發強度光譜圖(A)、相對發射強度光譜圖(B)和組分相對濃度圖(C)(N=4)Fig.4 Relative excitation intensity spectrum (A), relative emission intensity spectrum (B) and component relative concentration diagram (C) (N=4) of Pseudomonas syringae pv.Lachrymans-8 and Fusarium graminearum-ACCC37687 in mixed bacterial solution with OD600=0.5 obtained by the secondorder correction algorithm method
2.5 使用偏最小二乘回歸系數法(PLS)對混合菌液樣品進行分析
用偏最小二乘回歸系數法(PLS)提取OD600=0.5混合菌液的特征激發波長和特征發射波長,得到混合菌液的前三組分權重系數圖。分別按濃度逐漸上升和濃度逐漸下降對混合菌液三維熒光光譜數據使用PLS方法,結果如圖5所示。
每個波長所對應回歸系數絕對值的大小代表該波長對預測模型性能影響的程度[37]。由圖5可知,第1組分和第2組分不同波長所對應的回歸系數波動范圍較小,不能較好的體現不同樣本之間的差異。因此選取波動幅度更大、能更好的體現樣本差異的第3組分作為特征組分,該組分回歸系數的波峰波谷對應的波長為特征波長。由圖5(A)可得,按濃度上升使用PLS得到的特征激發波長分別為270、280、295、315、320、345、415 nm。由圖5(B)可得特征發射波長分別為361.6、416、515.6 nm。由圖5(C)可得,按濃度下降使用PLS得到的特征激發波長分別為285、295、315、320、340、415 nm。由圖5(D)可得特征發射波長為360.8、415.2、511.2 nm。
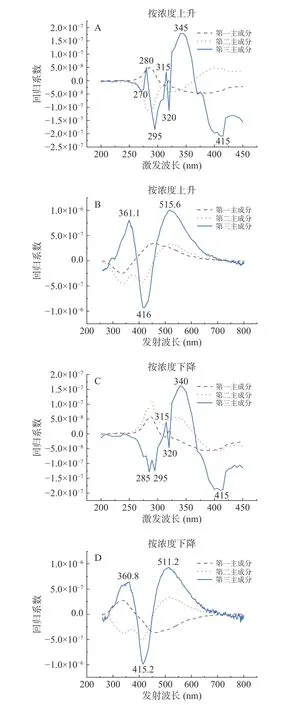
圖5 激發波長權重系數圖和發射波長權重系數圖Fig.5 Excitation wavelength weight coefficient diagram and emission wavelength weight coefficient diagram
先將篩選出來的特征波長與單一丁香假單胞菌和禾谷鐮孢菌波峰位置進行比對,再通過對比各特征波長下熒光強度變化趨勢,結合菌種濃度變化規律,把既滿足特征波長位置和菌種波峰位置一致,又滿足該波長下熒光強度變化規律和菌種濃度變化規律一致的波長叫做該菌種的特征波長,篩選得出激發/發射(Ex/Em)=280 nm/361.6 nm和激發/發射(Ex/Em)=295 nm/361.6 nm是丁香假單胞菌的特征激發發射波長位置。激發/發射(Ex/Em)=340 nm/511.2 nm和激發/發射(Ex/Em)=415 nm/511.2 nm是禾谷鐮孢菌的特征激發發射波長位置。PLS提取得到的特征波長用于后續混合菌液的定量分析。
2.6 光譜擬合定性分析
為了驗證上述判斷,并且考察各個算法定性分析能力,將每個算法分解得到的特征激發光譜和特征發射光譜與單一丁香假單胞菌和單一禾谷鐮孢菌的真實光譜,歸一化后進行擬合。
圖6、圖7分別是各個算法分解混合菌液三維熒光數據陣得到的激發光譜和發射光譜與單一丁香假單胞菌和禾谷鐮孢菌的真實激發發射光譜兩者擬合得到的。可以看出,平行因子分析(PARAFAC)、交替三線性分解(ATLD)、自加權交替三線性分解(SWATLD)、交替懲罰三線性分解(APTLD)對丁香假單胞菌都具有良好的定性效果,不論激發光譜還是發射光譜都可以分解出一個和丁香假單胞菌光譜形狀高度一致的組分,驗證了前面的推論。
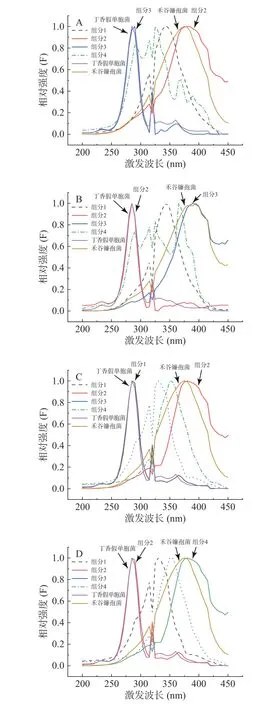
圖6 平行因子分析(A)、交替三線性分解(B)、自加權交替三線性分解(C)、交替懲罰三線性分解(D)方法獲得的激發光譜和丁香假單胞菌(PSL-8)、禾谷鐮孢菌(ACCC37687)的真實激發光譜Fig.6 The excitation spectra obtained by PARAFAC (A),ATLD (B), SWATLD (C), APTLD (D) and the real excitation spectra of Pseudomonas syringae pv. Lachrymans-8 and Fusarium graminearum-ACCC37687
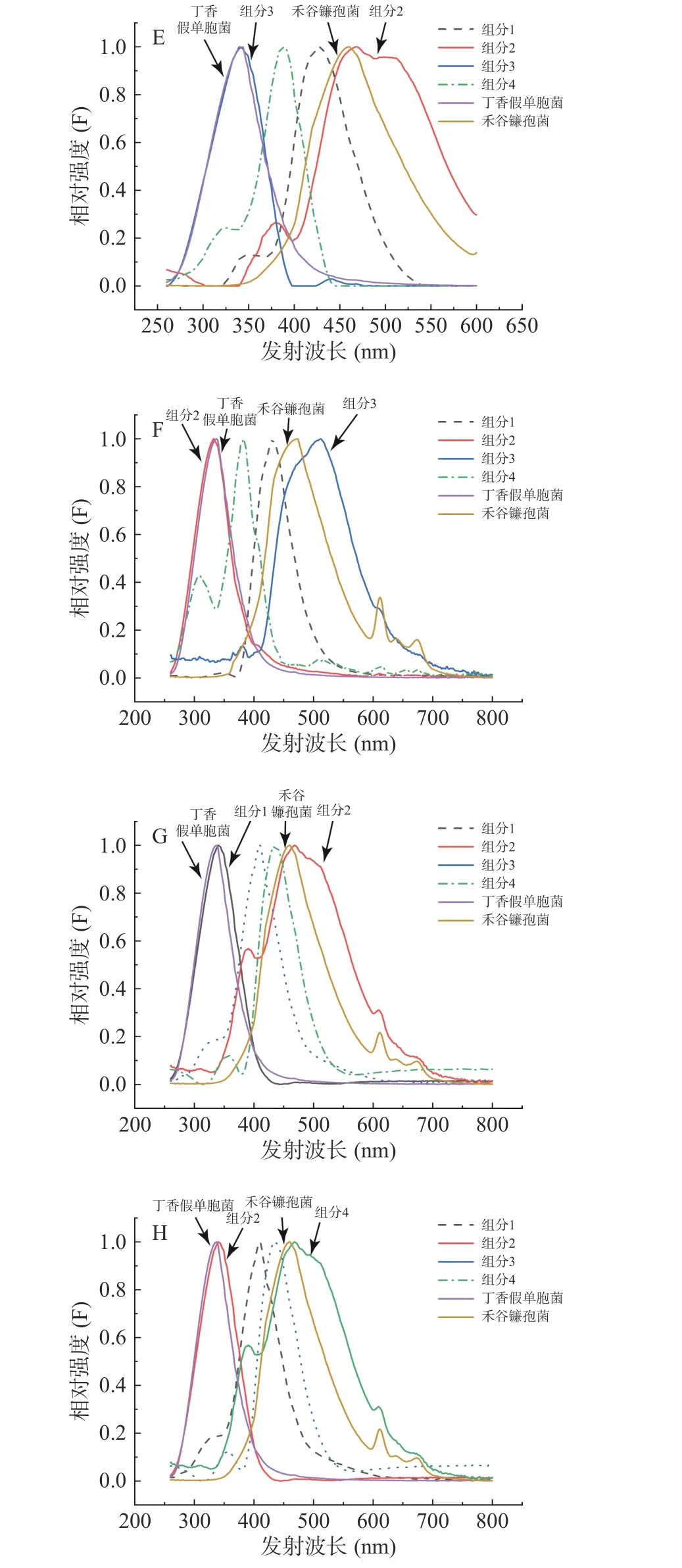
圖7 平行因子分析(E)、交替三線性分解(F)、自加權交替三線性分解(G)、交替懲罰三線性分解(H)方法獲得的發射光譜和丁香假單胞菌(PSL-8)、禾谷鐮孢菌(ACCC37687)的真實發射光譜Fig.7 The emission spectra obtained by PARAFAC (E), ATLD(F), SWATLD (G), APTLD (H) and the real emission spectra of Pseudomonas syringae pv. Lachrymans-8 and Fusarium graminearum- ACCC37687
平行因子分析(PARAFAC)、交替三線性分解(ATLD)、自加權交替三線性分解(SWATLD)、交替懲罰三線性分解(APTLD)對禾谷鐮孢菌的鑒定效果較差,無峰形完全一致的組分與之對應。自加權交替三線性分解(SWATLD)、交替懲罰三線性分解(APTLD)有部分與禾谷鐮孢菌真實光譜高度重疊的波形,因此效果優于平行因子分析(PARAFAC)、交替三線性分解(ATLD)。與禾谷鐮孢菌真實光譜相比,四種二階校正算法分解出來的禾谷鐮孢菌對應組分的光譜峰形均發生后移。將單一禾谷鐮孢菌特征激發波長和特征發射波長處的光譜與混合菌液下禾谷鐮孢相同波長處的光譜進行擬合,發現菌液混合后禾谷鐮孢菌峰形確實發生變化。有文獻表明峰形后移的原因可能有多種,色氨酸與配體結合,或蛋白質與蛋白質結合以后發射波長會發生位移[13],峰形后移的原因需要進一步探索驗證。同時每種算法都會有兩種未知干擾組分,推測是兩種菌共同擁有的熒光基團或者是出峰位置相近的熒光基團。
2.7 留一法交叉驗證(LOOCV)多元線性回歸構建濃度預測模型
濃度預測模型的構建需要大批量實驗作為測試集和驗證集,故將混合菌液OD600變更為0.2,同時也能驗證高濃度樣本提取出來的特征波長在樣品濃度降低時是否依舊有規律。總共做了40組混合菌液樣本,每組11個濃度梯度樣本,總共440個樣本三維光譜數據。應用交替懲罰三線性分解(APTLD)、自加權交替三線性分解(SWATLD)、平行因子分析(PARAFAC)、交替三線性分解(ATLD)、偏最小二乘回歸系數法(PLS)提取出來的丁香假單胞菌主熒光峰位置的激發波長和發射波長分別是激發/發射(Ex/Em)=285 nm/340 nm、290 nm/340 nm、285 nm/332.4 nm、280 nm/361.6 nm、295 nm/361.6 nm。提取出來的禾谷鐮孢菌主熒光峰位置激發波長和發射波長分別是激發/發射(Ex/Em)=380 nm/468 nm、
390 nm/512 nm、340 nm/511.2 nm、415 nm/511.2 nm。使用多元線性回歸函數對樣本OD600和篩選得到的菌種對應特征波長處的熒光強度構建回歸模型,將混合菌液每種菌種的期望OD600值作為因變量Y,將各類方法挑選出的特征波長的熒光強度作為自變量X,分別得到丁香假單胞菌和禾谷鐮孢菌兩種菌的濃度預測模型, 再使用留一法交叉驗證(LOOCV)濃度預測模型的準確性,分別計算單一方法和綜合方法下模型的相關系數R、交叉驗證決定系數R2cv、預測均方根誤差RMSEP,依此選出最佳的模型方案,結果匯總見表3,最佳預測模型下,兩種菌濃度預測結果見表4。
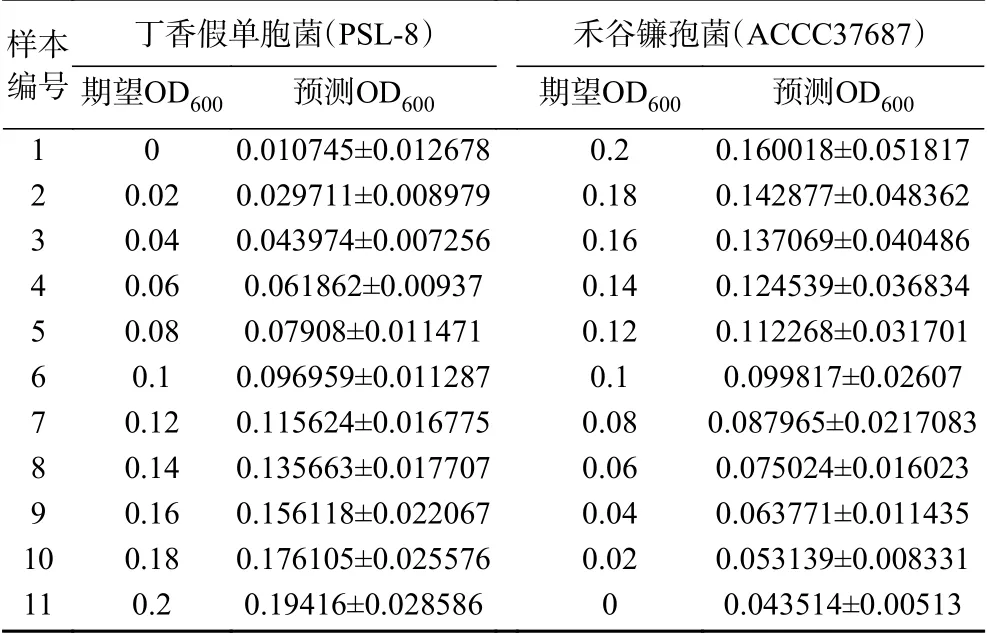
表4 兩種菌的濃度預測結果Table 4 Predicted results of two bacterial concentrations
由表3可知,使用單一方法建立濃度預測模型時,交替三線性分解(ATLD)建立的丁香假單胞菌濃度預測模型效果最好,自加權交替三線性分解(SWATLD)、交替懲罰三線性分解(APTLD)的濃度預測效果次之,平行因子分析(PARAFAC)和偏最小二乘回歸系數法(PLS)效果最差。偏最小二乘回歸系數法(PLS)建立的禾谷鐮孢菌濃度預測模型效果最好,交替三線性分解(ATLD)的濃度預測效果次之,平行因子分析(PARAFAC)、自加權交替三線性分解(SWATLD)、交替懲罰三線性分解(APTLD)的效果最差。將所有方法提取的特征波長綜合應用從而建立的丁香假單胞菌和禾谷鐮孢菌濃度預測模型效果最好。丁香假單胞菌和禾谷鐮孢濃度預測模型如下:
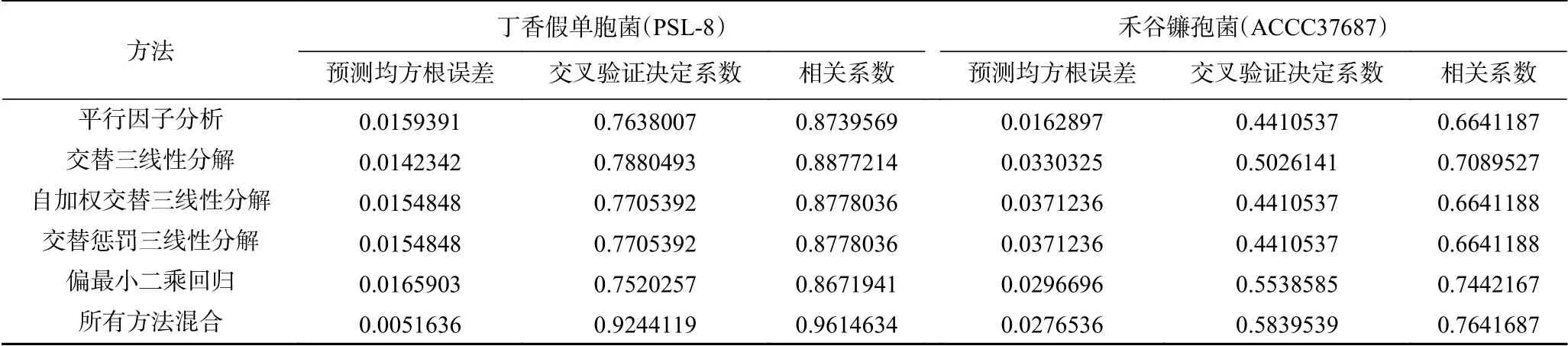
表3 模型穩定性參數匯總Table 3 Summary of model stability parameters
混合菌液丁香假單胞菌濃度預測模型:

式中:YPSL-8是丁香假單胞菌的OD600預測值;X1是ATLD篩選出來的組分2特征波長處的熒光強度;X2是PARAFAC篩選出來的組分3特征波長處的熒光強度;X3和X4是PLS按菌液濃度線性上升篩選出來的兩個特征波長處的熒光強度。APTLD、SWATLD篩選得到的丁香假單胞菌特征波長相同,X5是APTLD(SWATLD)篩選出來的特征波長處的熒光強度。
混合菌液禾谷鐮孢菌濃度預測模型:

式中:Y禾谷鐮孢是禾谷鐮孢菌的OD600預測值;X6是ATLD篩選出來的組分3特征波長處的熒光強度;X7是PARAFAC篩選出來的組分2特征波長處的熒光強度;APTLD、SWATLD篩選得到的禾谷鐮孢菌特征波長與PARAFAC篩選出來的特征波長相同;X8和X9是PLS按菌液濃度線性下降篩選出來的兩個特征波長處的熒光強度。
使用留一法交叉驗證(LOOCV)濃度預測模型的準確性,得到混合菌液下丁香假單胞菌濃度預測模型的交叉驗證決定系數R2cv=0.92441191,預測均方根誤差RMSEP=0.005163633,相關系數R=0.961463421。混合菌液下禾谷鐮孢菌濃度預測模型的交叉驗證決定系數R2cv=0.583953931,預測均方根誤差RMSEP=0.027653679,相關系數R=0.764168784。兩者比較可以看出丁香假單胞菌濃度預測模型的預測效果明顯好于禾谷鐮孢菌濃度預測模型。推測禾谷鐮孢菌濃度預測模型預測效果不佳的原因可能在于真菌本身不適用于比濁法來衡量真菌孢子濃度,當使用OD600作為真菌孢子濃度衡量標準時,實驗操作本身帶來的操作誤差較大,不同樣本相同OD600下的真菌孢子懸液的孢子濃度可能有所不同,這樣極大的影響了熒光的規律性。
3 結論
本文采集丁香假單胞菌和禾谷鐮孢菌梯度混合菌液的三維熒光光譜數據,結合二階校正算法及一階校正算法篩選出菌種特征波長, 通過對特征波長熒光強度數據和菌液在600 nn波長下的吸光度(OD600)進行多元線性回歸從而建立濃度預測模型。實驗表明,通過多元線性歸建回立的丁香假單胞菌濃度預測模 型(R2cv=0.92441191,RMSEP=0.005163633,R=0.961463421)比禾谷鐮孢菌濃度預測模型(R2cv=0.583953931,RMSEP=0.027653679,R=0.764168784)效果更佳,定性定量分析結果符合預期。而利用熒光光譜技術對真菌的定量分析可能存在一定的局限性,禾谷鐮孢菌濃度預測模型對禾谷鐮孢菌的濃度預測誤差明顯,梯度混合菌類別太少,這進一步限制了該方法的普適性和推廣。所得實驗結果對該研究的價值與預期有所差別,但實驗方法對研究利用熒光光譜技術對真菌的定量分析提供了利用價值。

