高中化學解題技巧分析
陳藝君
(江蘇省揚州南師大第二附屬高級中學 211400)
1 高中化學的常用解題方法
1.1 守恒法
在高中化學學科中經常出現守恒這個詞匯,作為化學的核心思想,守恒也是高中學生最主要的解題方法和策略.守恒主要包括原子守恒、質量守恒、電子守恒等.一般情況來說,在化學計算中多用質量守恒,因為化學變化前后具有相同的總質量,所以質量守恒還能夠幫助學生驗證解題結果是否正確;在復雜的化學方程式計算、連步反應計算以及有機物分子組成計算中多用原子守恒;電子守恒則多用于氧化還原反應中.
1.2 化學方程式法
在分析和計算化學題時,化學方程式可以讓復雜的題目簡單化,因此高中生必須對化學方程式進行熟練掌握.在化學學科中有很多問題都涉及到化合反應和分解反應,所以高中生可以利用化學方程式掌握其中一種關系,再結合題意設置未知數,利用化學方程式設置方程組,這也是高中化學最常用的解題策略之一.
2 高中化學解題技巧分析
例題1(2020年廣東高考化學改編)H2O2是一種綠色氧化還原試劑,在化學研究中應用廣泛.
(1)某小組擬在同濃度Fe3+的催化下,探究H2O2濃度對H2O2分解反應速率的影響.限選試劑與儀器:30%的H2O2、0.1 mol/L的Fe2(SO4)3、蒸餾水、錐形瓶、雙孔塞、水槽、膠管、玻璃導管、量筒、秒表、恒溫水浴槽、注射器.
①寫出本實驗H2O2的分解反應化學方程式,并標明電子轉移的方向和數目____.
②設計實驗方案:在不同H2O2濃度下,測定____.(要求所測得的數據能直接體現反應速率大小).
③參照表1格式,擬定實驗表格,完整體現實驗方案(列出所選試劑體積、需記錄的待測物理量和所擬定的數據,數據用字母表示).

表1
(2)利用圖1和圖2中的信息,按圖3裝置(連接的A、B瓶中已充有NO2氣體)進行實驗.可觀察到B瓶中氣體顏色比A瓶中的____(填“深”或“淺”),其原因是____.
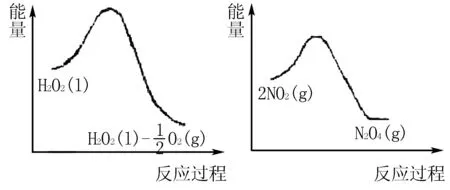
圖1 圖2
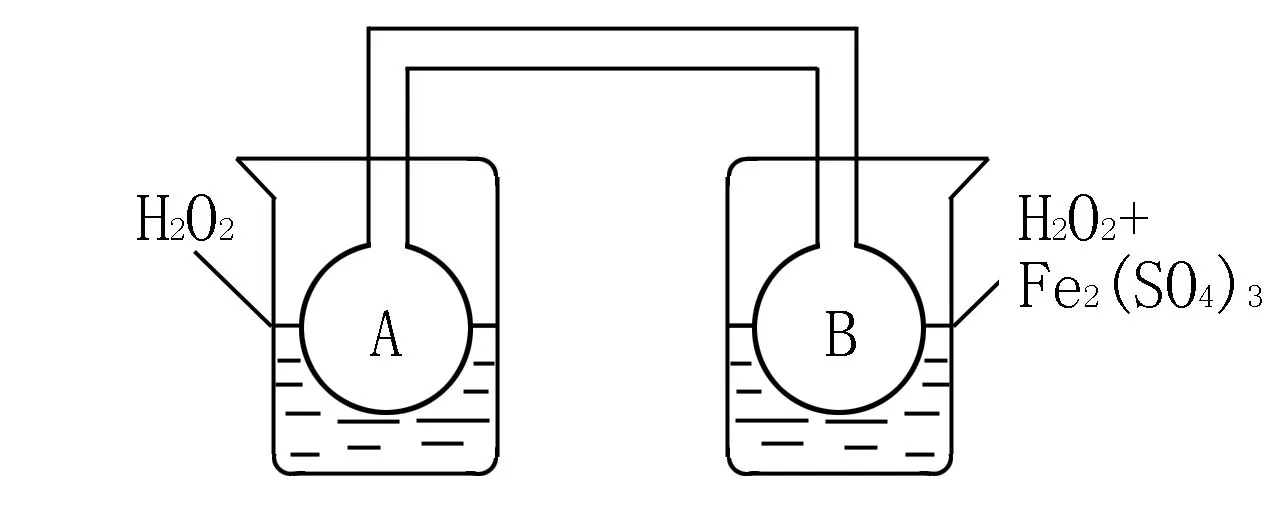
圖3
試題解析(1)①先寫出H2O2在Fe3+的催化下分解的化學方程式,在根據電子得出情況用雙線橋法標出.
②收集相同體積的氧氣所需時間或者相同時間所收集氧氣的體積.
③解法一:不同濃度的H2O2分解在相同時間內產出的氣體體積.
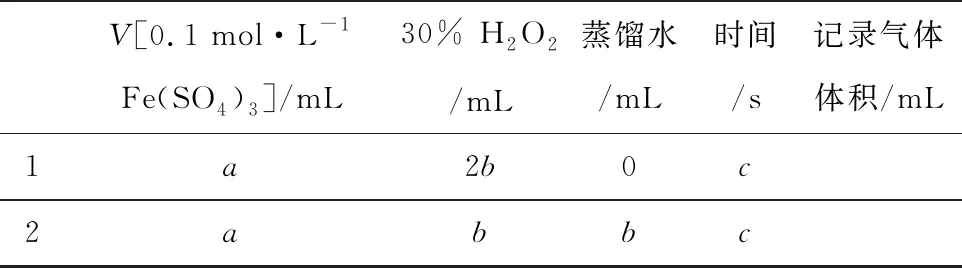
V[0.1 mol·L-1Fe(SO4)3]/mL30% H2O2/mL蒸餾水/mL時間/s記錄氣體體積/mL1a2b0c2abbc
解法二:不同濃度的H2O2分解產生的相同氣體的體積所需要的時間.
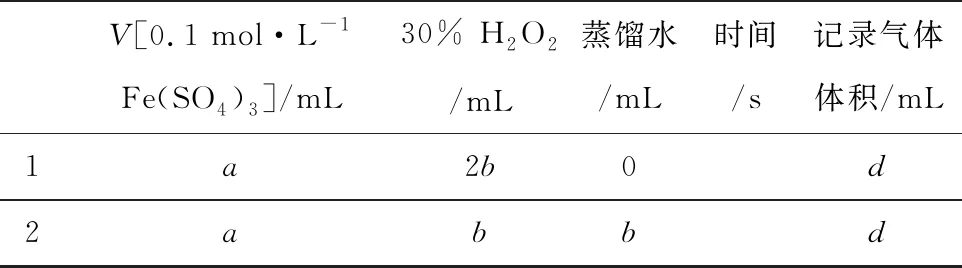
V[0.1 mol·L-1Fe(SO4)3]/mL30% H2O2/mL蒸餾水/mL時間/s記錄氣體體積/mL1a2b0d2abbd
(2)答案為深.原因是2NO2(紅棕色)與N2O4(無色)之間的反應,ΔH<0是放熱反應,且雙氧水的分解反應也是放熱反應.當右邊雙氧水分解時放出的熱量會使B瓶升溫,使瓶中反應朝逆反應方向移動,即向生成NO2移動,故B瓶顏色更深.
這道高考題的主要目的是考察學生的主觀表達能力和實驗設計能力,對學生理論掌握和實驗設計能力要求較高.這也說明高中學生在學習化學知識時必須要回歸教材,能夠對基礎知識進行深刻把握并透徹理解,對于教材中所演示的實驗也要要求學生進行自主探究,強化他們的實踐動手能力和思考能力.
例題2(2019年全國卷第27題節選)環戊二烯可用于制備二茂鐵Fe(C5H5)2,后者廣泛應用于航天、化工等領域中.二茂鐵的電化學制備原理如圖4所示,其中電解液為溶解有浪化鈉(電解質)和環戊二烯的DMF溶液(DMF為惰性有機溶劑).
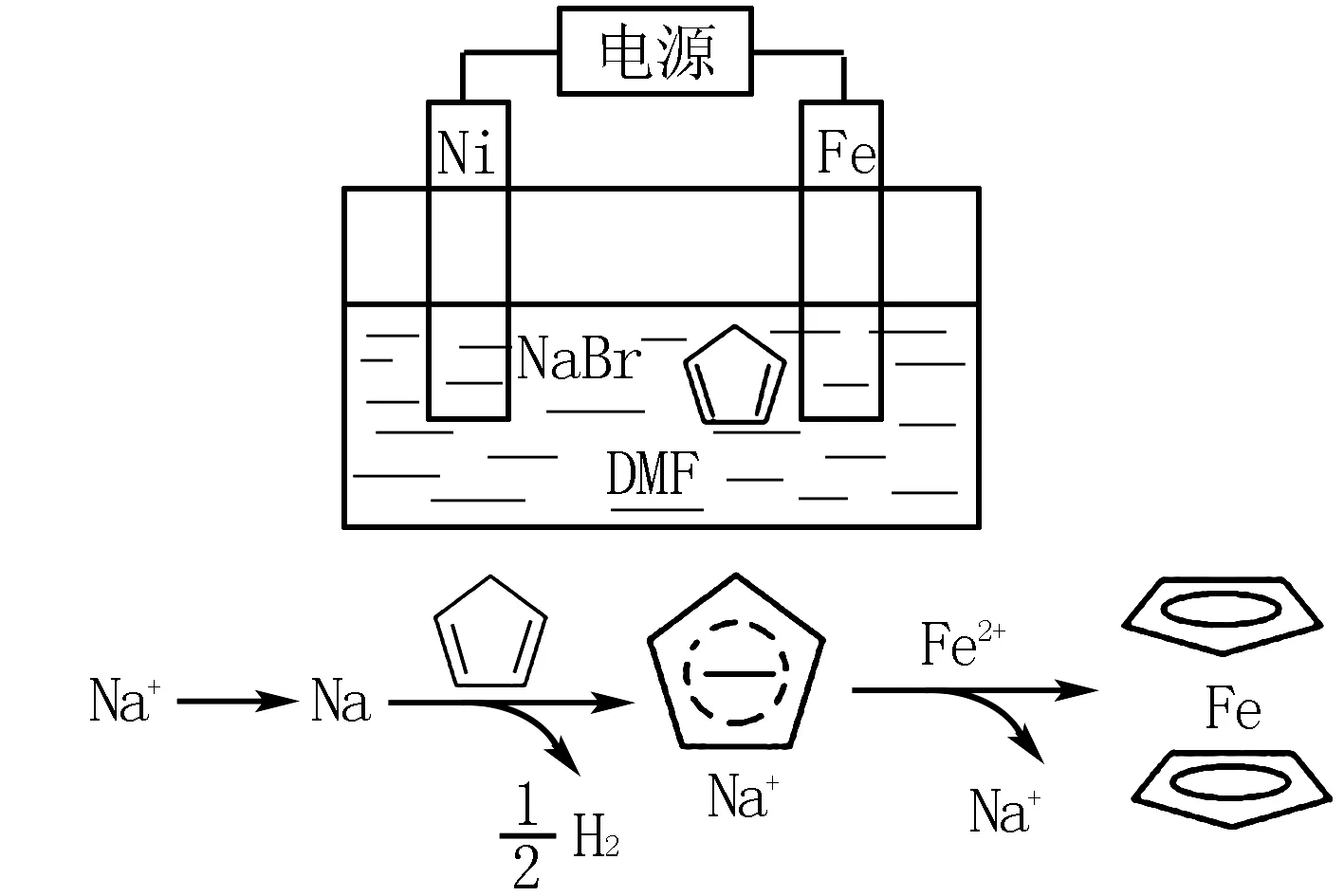
圖4
請同學們回答:該電解池的陽極為____,總反應為電解制備需要在無水條件下進行,原因是____.
答案分別為:
Fe電極;因為化學方程式為

水會阻礙中間物Na的生成;水會電解生成OH-進一步與Fe2+反應生成Fe(OH)2.


電解必須在無水條件下進行,因為中間產物Na會與水反應生成NaOH和H2,Fe2+與OH-結合生成Fe(OH)2.此題需要學生根據得失電子判斷電解池兩極,再根據題中信息找準反應物與產物,最后配平電極反應式.
總結:本題所主要考察的就是電極反應式的書寫,學生一定要明確電解池具有陰極和陽極兩個電極,陽極在反應過程中失去電子、陰極在反應過程中得到電子,然后需要結合題干信息確定電極反應的反應物和生成物.此時可以用到質量守恒和電荷守恒定律,也就是在電極反應式兩端的原子個數和電荷數量必須相等,以此來驗證反應式是否正確.
例題3(2019年全國卷第13題)為提升電池循環效率和穩定性,科學家近期利用三維多孔海綿狀Zn(3D-Zn)可以高效沉積ZnO的特點,設計了采用強堿性電解質的3D-Zn-NiOOH二次電池,結構如圖5所示.電池反應為
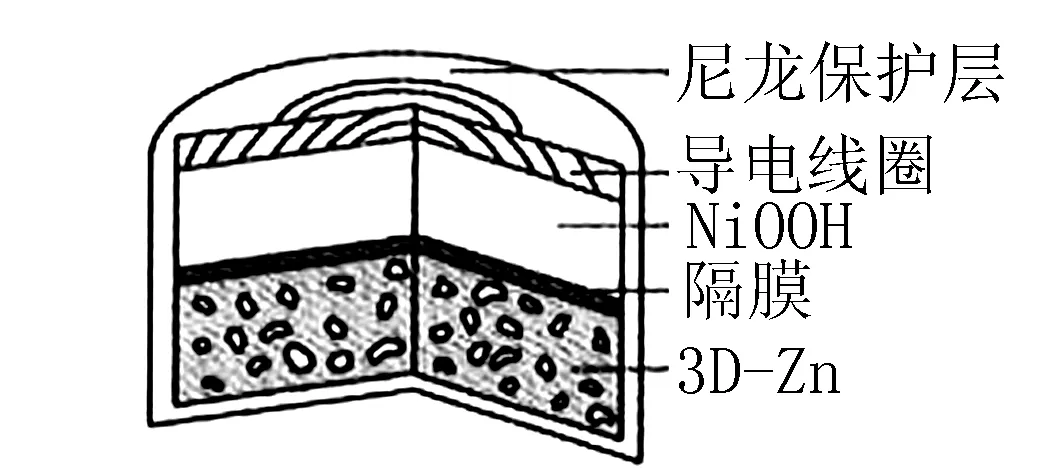
圖5

ZnO(s)+2Ni(OH)2(s)
下列說法錯誤的是( ).
A.三維多孔海綿狀Zn具有較高的表面積,所沉積的ZnO分散度高
B.充電時陽極反應為

C.放電時負極反應為

D.放電過程中OH-通過隔膜從負極區移向正極區
答案:D.
解析根據題目中提示“利用三維多孔海綿狀Zn(3D-Zn)可以高效沉積ZnO的特點”可知,三維多孔海綿狀Zn具有較高的表面積,所沉積的ZnO分散度高,所以A正確;充電相當于是電解池,陽極發生失去電子的氧化反應,根據總反應式可知陽極是Ni(OH)2失去電子轉化為NiOOH,電極反應式為

NiOOH(s)+H2O(l)
B正確;放電時相當于是原電池,負極發生失去電子的氧化反應,Zn作負極反應生成ZnO,根據總反應式可知負極的極反應式為

C正確;放電時,負極上失電子,電子通過導線到達正極,溶液中OH-陰離子通過隔膜從正極區移向負極區,故D錯誤.
總結:這道高考題主要考察學生對原電池和電解池工作原理的掌握,原電池的負極失電子,電子通過導線到達正極,形成電流.而在電解質溶液中,離子的定向移動形成電流,陽離子向正極移動,陰離子向負極移動;電解池的陽極失電子,電子通過導線到達陰極,形成電流,在電解質溶液中,陽離子向陰極移動,陰離子向陽極移動.
綜上所述,在高中化學學科的學習中,有很多高效的學習方法和解題技巧,需要學生在學習過程中進行總結,但是這必須以高中生能夠對化學基礎知識進行扎實掌握為基礎,只有高中學生做到對化學基礎知識的深入理解和記憶,才能夠在解題過程中做到知識的靈活運用,才能幫助學生擁有更加清晰的解題思路,明確題目的考察意圖,最終不斷提高解題速度和解題正確率.

