3D口腔粘膜模型的構(gòu)建及其在口腔護理產(chǎn)品的抗炎功效中的應(yīng)用
陳敏珊 王真史 李 平 陶 麗
(廣州薇美姿實業(yè)有限公司,廣東廣州 510665)
引言
根據(jù)2017年公布的第四次全國口腔健康流行病學(xué)調(diào)查結(jié)果顯示,我國中年人牙石和牙齦出血檢出水平較高,與10年前相比牙齦出血檢出率上升了10.1個百分點,牙周健康狀況有待提高[1]。口腔炎癥被認為是宿主對入侵病原體保護作用的不良結(jié)果,口腔炎癥性疾病如牙齦炎、牙周炎等,不僅危害口腔健康而且與全身疾病有著密切關(guān)系,嚴重時可引起全身炎癥反應(yīng)。牙周局部炎癥會破壞上皮的完整性,導(dǎo)致致病菌擴散到循環(huán)系統(tǒng)。同時牙周袋內(nèi)含有大量的炎癥介質(zhì),尤其是與慢性炎癥相關(guān)的炎癥介質(zhì),如白細胞介素、腫瘤壞死因子α、以及前列腺素均會由牙周袋進入血液循環(huán)系統(tǒng)從而引起系統(tǒng)性炎癥反應(yīng)。口腔炎癥與全身系統(tǒng)性疾病,包括心血管系統(tǒng)、內(nèi)分泌系統(tǒng)、呼吸系統(tǒng)、免疫系統(tǒng)、神經(jīng)系統(tǒng)等疾病的發(fā)生發(fā)展密切相關(guān)[2-3]。口腔護理用品作為一類日常必需品,在預(yù)防與減緩初期口腔炎癥有著重要的作用。因此如何研制出療效快、顯效好的抗炎功效成分并應(yīng)用、開發(fā)出具有預(yù)防與減緩初期口腔炎癥的口腔護理產(chǎn)品是現(xiàn)階段口腔護齦領(lǐng)域的研究熱點。口腔護理產(chǎn)品的抗炎驗證方法一直是行業(yè)中所面臨的難點。2009年3月,歐盟要求禁止對化妝品成分進行動物實驗,并且禁止對成品或者成分進行過局部/急性動物實驗的化妝品銷售。歐洲、美國、日本等地區(qū)或國家已成立動物實驗替代機構(gòu)旨在積極推動替代方法進行更為系統(tǒng)而深入的研究,目前已順利完成相關(guān)技術(shù)儲備,并通過立法程序建立起相應(yīng)的技術(shù)性貿(mào)易措施體系。我國現(xiàn)也已有和國際接軌的相關(guān)法律法規(guī),以體外替代試驗方法取代傳統(tǒng)的動物試驗[4]。《醫(yī)療器械生物學(xué)評價第1部分:評價與試驗(GB/T16886-1)》提到:只要科學(xué)上證明能獲得與動物試驗同樣的信息,建議優(yōu)先采用體外模式。前期我司已經(jīng)建立采用單層細胞建立了用于口腔護理產(chǎn)品的體外抗炎、修復(fù)損傷功效模型,即2D模型。在大量的應(yīng)用數(shù)據(jù)中發(fā)現(xiàn),經(jīng)過2D模型測試的功效產(chǎn)品直接用動物模型或臨床實驗?zāi)P瓦M行功效評價,結(jié)果存在著一定的局限性。本研究以正常的人體口腔黏膜生理結(jié)構(gòu)和功能為基礎(chǔ),構(gòu)建了口腔黏膜體外三維細胞模型,即3D口腔模型。同時,立足于含救必應(yīng)提取物的口腔護理產(chǎn)品的抗炎功效測試,對比2D模型、3D口腔模型、動物實驗和臨床實驗的相關(guān)性,探討了口腔黏膜體外三維細胞模型應(yīng)用在口腔護理產(chǎn)品功效驗證中的可行性。一方面,可以尋找并建立更加快捷可靠的抗炎評價方法;另一方面,也是為口腔護理行業(yè)動物替代實驗進行探索,最終旨在為口腔護理產(chǎn)品開發(fā)及功效驗證提供一個新思路。
1 3D口腔粘膜模型介紹
1.1 口腔黏膜的結(jié)構(gòu)與功能[5]
口腔黏膜覆蓋于口腔表面,正常的人體口腔黏膜生理結(jié)構(gòu)包括固有層和上皮層。其中,上皮層為復(fù)層鱗狀上皮,主要由角質(zhì)細胞構(gòu)成,此外還有少數(shù)非角質(zhì)細胞。固有層由致密的結(jié)締組織組成。固有層的基本細胞成分是成纖維細胞,有合成和更新纖維及基質(zhì)的功能。固有層的纖維主要是Ⅰ型膠原纖維。口腔黏膜根據(jù)所在的部位和功能不同可分為三類,即咀嚼黏膜、被覆黏膜和特殊黏膜。
口腔黏膜具有的保護性功能主要體現(xiàn)在抵抗機械刺激和限制微生物和毒性物質(zhì)的侵入。咀嚼期間口腔黏膜常常承受壓力、切力、牽拉力和磨擦力,黏膜的結(jié)構(gòu)適應(yīng)于承受這些力。例如硬腭和附著齦黏膜有角化層以抵抗磨擦,并且緊密附著于其下方的骨組織以抵抗切力和壓力;頰黏膜易于活動并富有彈性利于組織的擴展,從而可緩解牽拉力。口腔內(nèi)有大量的微生物以及它們的毒性產(chǎn)物和其他潛在的有害物質(zhì),口腔黏膜上皮是限制它們進入機體的主要屏障。
口腔黏膜還有感覺功能,可對疼痛、觸動和溫度做出反應(yīng),還有特殊的感覺系統(tǒng)即味覺。在某些方面,感覺功能具有保護性,因為口腔黏膜的感受器能啟動吞咽、惡心和流涎等反射。因此口腔黏膜還與唾液的分泌以及某些藥物的滲透性吸收有關(guān)。
1.2 口腔炎癥
口腔炎癥是口腔疾病發(fā)病的早期征兆,最常見的口腔炎癥表現(xiàn)為牙齦發(fā)紅、腫脹、易出血,嚴重時牙齦緣可有潰瘍和假膜形成,并伴有疼痛感。細菌感染、外物刺激以及食物嵌塞是引起口腔炎癥的主要原因,其中最常見的是細菌感染。口腔是人體最復(fù)雜的生態(tài)微環(huán)境之一,約有700多種微生物。口腔微生物與宿主之間存在共生、競爭、拮抗及相互制約的特殊關(guān)系。一旦這種關(guān)系失調(diào),特異性致病菌數(shù)量增多,細菌及其毒性產(chǎn)物就可啟動牙周的初期炎癥過程。即細菌及其毒性產(chǎn)物刺激上皮細胞通過受體介導(dǎo)產(chǎn)生細胞因子,同時釋放神經(jīng)肽,引發(fā)局部血管舒張[6]。釋放的趨化因子引發(fā)第一道防線:免疫細胞離開血管,遷移到微生物入侵的地方,清除入侵的細菌,產(chǎn)生細胞因子和趨化因子,激活淋巴細胞介導(dǎo)的適應(yīng)性免疫反應(yīng)。在此階段口腔炎癥的臨床癥狀表現(xiàn)為出血、腫脹和牙齦發(fā)紅,即為牙齦炎[7]。若宿主防御功能旺盛并得到適當治療,初期口腔炎癥會被免疫細胞控制或清除。當宿主的防御功能與修復(fù)能力低下,無法抵御細菌微生物的侵襲時,細菌及其毒性產(chǎn)物會激活宿主的防御細胞產(chǎn)生并釋放更多的炎癥因子,使口腔炎癥進一步擴大及惡化(圖1)。當炎癥過程延長和轉(zhuǎn)化為慢性炎癥時,炎癥引發(fā)組織創(chuàng)傷,導(dǎo)致口腔軟、硬組織包括牙槽骨被破壞,臨床上表現(xiàn)為不可逆轉(zhuǎn)的牙周炎。目前,研究表明引發(fā)牙齦炎癥的致病菌多為G-厭氧菌,主要有牙齦卟啉單胞菌(P.g)、放線共生放線桿菌(A. a)、福賽斯類桿菌(B. f)[8,9]。

圖1 口腔炎癥的發(fā)生機理
1.3 口腔的體外模型
體外口腔模型有二維(2D)貼壁培養(yǎng)和三維(3D)培養(yǎng)兩類。
目前常用于評價口腔原料或口腔護理產(chǎn)品的2D炎癥模型有:脂多糖(LPS)誘導(dǎo)單核/巨噬細胞RAW264.7細胞的炎癥模型,脂多糖(LPS)誘導(dǎo)牙齦成纖維細胞(HGFs)的炎癥模型,或者牙齦卟啉單胞菌(P.g)誘導(dǎo)牙齦成纖維細胞(HGFs)的炎癥模型[10, 11]。二維細胞培養(yǎng),即單一細胞系貼附于培養(yǎng)器皿表面或懸浮于培養(yǎng)液中生長,細胞分裂、繁殖、細胞數(shù)量増加的過程。2D培養(yǎng)過程簡單高效,為人類在科學(xué)研究方面提供了巨大的便利。然而,2D培養(yǎng)方法將生長于極復(fù)雜的生物體內(nèi)的細胞離體并進行簡單化、均一化培養(yǎng),因此2D細胞的生長環(huán)境與體內(nèi)環(huán)境存在巨大差距,從而導(dǎo)致細胞生物學(xué)特征及細胞行為發(fā)生了巨大改變,進而造成2D細胞對產(chǎn)品的應(yīng)答模式與體內(nèi)存在顯著差距,這不利于產(chǎn)品的評價與開發(fā)[12]。
體外細胞培養(yǎng)的一個重要原則是需模擬體內(nèi)細胞生長環(huán)境, 該模擬系統(tǒng)中最重要的核心因素是細胞與培養(yǎng)環(huán)境之間的相互作用。不同于傳統(tǒng)的二維化單層細胞培養(yǎng), 三維細胞培養(yǎng)技術(shù)(3D) 是指將具有三維結(jié)構(gòu)不同材料的載體與各種不同種類的細胞在體外共同培養(yǎng), 使細胞能夠在載體的三維立體空間結(jié)構(gòu)中遷移、生長, 構(gòu)成三維的細胞-載體復(fù)合物。三維細胞培養(yǎng)是將細胞培植在一定的細胞外基質(zhì)中, 細胞外基質(zhì)( Extracellularmatrix, ECM) 蛋白充當生長支架, 使得細胞能夠分化產(chǎn)生一定的三維組織特異性結(jié)構(gòu), 所創(chuàng)建的細胞生長環(huán)境, 則最大程度地模擬體內(nèi)環(huán)境。3D作為體外無細胞系統(tǒng)及單層細胞系統(tǒng)的研究與組織器官及整體研究的橋梁,顯示了它既能保留體內(nèi)細胞微環(huán)境的物質(zhì)及結(jié)構(gòu)基礎(chǔ),又能展現(xiàn)細胞培養(yǎng)的直觀性及條件可控性的優(yōu)勢。近幾年三維細胞培養(yǎng)技術(shù)在組織形成、血管發(fā)育和器官再造等發(fā)育生物學(xué)的分支領(lǐng)域得到了廣泛的應(yīng)用;同時在篩選新藥的療效分析和毒理實驗方面, 利用三維培養(yǎng)獲得了和二維單層培養(yǎng)完全不同的結(jié)果, 引起了藥物學(xué)家的極大興趣[13, 14]。現(xiàn)階段,國內(nèi)外報道的三維(3D)培養(yǎng)技術(shù)應(yīng)用于口腔炎癥的模型比較少,國內(nèi)已報道的口腔黏膜模型只構(gòu)建了口腔黏膜上皮層,并且以口腔黏膜鱗狀癌細胞為種子細胞,不能很好地反映人天然口腔黏膜結(jié)構(gòu)。因此本研究旨在構(gòu)建一種與人體口腔黏膜上皮組織的結(jié)構(gòu)及功能高度相似的體外口腔黏膜上皮模型,探討其在口腔護理產(chǎn)品的抗炎功效的應(yīng)用,填補我國在口腔黏膜體外三維細胞模型及在口腔護理產(chǎn)品中應(yīng)用的空白。
2 用于口腔護理產(chǎn)品抗炎功效驗證的3D口腔粘膜模型建立
2.1 實驗材料和方法
2.1.1 試劑與儀器
人白介素6 ELISA試劑盒、人介素1β Elisa試劑盒(中國,武漢華美生物工程有限公司),細胞毒性檢測試劑盒說明書(中國,Beyotime),DMEM高糖培養(yǎng)基(美國,Gibco),CO2培養(yǎng)箱(美國,Thermo),Tecan Infinite M200 Pro酶標儀(瑞士,Tecan)。
2.1.2 細胞培養(yǎng)
人牙齦成纖維細胞株HGF-1(ATCC? CRL-2014TM, Rockville, MD, USA)細胞培養(yǎng)于含有20%牛血清的DMEM高糖培養(yǎng)基,添加100 U/mL的青霉素和100μg/mL的鏈霉素(美國Hyclone公司),37℃,5% CO2飽和濕度的培養(yǎng)箱內(nèi)。人口腔角質(zhì)HOKs細胞 (ScienCell Research Laboratories, Carlsbad, CA)用特殊的培養(yǎng)基培養(yǎng),具體培養(yǎng)方法根據(jù)說明書。
2.1.3 菌株培養(yǎng)
在含有0.001%的氯高鐵血紅素和0.0001%的維生素K (THB-HK)的Todd Hewitt肉湯(BBL Microbiology Systems, Cockeysville, MD, USA)中厭氧培養(yǎng)牙齦卟啉單胞菌P.g (P.gingivalis ATCC 33,277)。
2.1.4 人口腔黏膜體外三維細胞模型的建立[15, 16]
將HOKs細胞種植在膠原包埋人齦成纖維細胞收縮而成的真皮層上,待HOKs細胞長至多層,氣提培養(yǎng)7 d,分成含基質(zhì)層、棘層、肉芽層、角質(zhì)層的人工皮膚。基底層的配置:取Collagen I、DMEM培養(yǎng)基、FBS(牛血清)按照1∶2∶1比例混合,置于PET膜上,于25℃條件下靜置1 h,再移至37℃培養(yǎng)箱靜置1 h。固有層的配置:取Collagen I、DMEM培養(yǎng)基、FBS(牛血清)按照1∶2∶1比例混合,將混合液重懸HGF-1細胞,使其密度為1.5×105個/mL,置于基底層上,于25℃條件下靜置1 h,再移至37℃培養(yǎng)箱靜置1h。固化后,加入培養(yǎng)液Ⅱ浸泡固化后的固有層,于37℃二氧化碳培養(yǎng)箱中培養(yǎng)4~7天,得固有層。上皮層的配置:舍棄部分固有層培養(yǎng)基,使固有層表面沒有液體,以便于表皮細胞均勻附著在真皮層;取HOKs細胞(1.5×105個/mL)平鋪于所述固有層,于37℃孵育2 h使HOKs細胞完全附著在固有層上,加入口腔角質(zhì)細胞的擴增培養(yǎng)培養(yǎng)液,于37℃二氧化碳培養(yǎng)箱培養(yǎng)2天;之后進行氣液界面培養(yǎng),于37℃二氧化碳培養(yǎng)箱培養(yǎng)2~3天后。將上皮培養(yǎng)基舍棄,加分化培養(yǎng)基進行氣液界面培養(yǎng)7天得成熟的全層3D口腔黏膜。
2.1.5 組織學(xué)切片[17]
2.1.5.1 取材:新鮮組織用固定液固定24 h以上。將組織從固定液取出在通風櫥內(nèi)用手術(shù)刀將目的部位組織修平整,將修切好的組織和對應(yīng)的標簽放于脫水盒內(nèi)。
2.1.5.2 脫水浸蠟:將脫水盒放進吊籃里于脫水機內(nèi)依次梯度酒精進行脫水。脫水處理的步驟具體如下:
a)采用濃度為75%的酒精脫水處理4 h;
b)采用85%酒精脫水處理2 h;
c)采用90%的酒精脫水處理2 h;
d)采用95%的酒精處理1 h;
e)使用無水乙醇處理30min;
f)使用無水乙醇處理30min;
g)使用醇苯處理5-10min;
h)使用二甲苯處理5-10min;
i)使用二甲苯處理5-10min;
j)使用溫度為65℃的融化石蠟處理1 h;
k)使用65℃的融化石蠟處理1 h;
l)使用65℃的融化石蠟處理1 h。
2.1.5.3 包埋:將浸好蠟的組織于包埋機內(nèi)進行包埋。先將融化的蠟放入包埋框,待蠟?zāi)讨皩⒔M織從脫水盒內(nèi)取出按照包埋面的要求放入包埋框并貼上對應(yīng)的標簽。于-20℃凍臺冷卻,蠟?zāi)毯髮⑾瀴K從包埋框中取出并修整蠟塊。
2.1.5.4 切片:將修整好的蠟塊置于石蠟切片機切片,厚4 μm。切片漂浮于攤片機40℃溫水上將組織展平,載玻片將組織撈起,在烘箱內(nèi)60℃的溫度下烤片。水烤干蠟烤化后取出常溫保存?zhèn)溆谩?/p>
2.1.5.5 B.HE染色
a)石蠟切片脫蠟至水:依次將切片放入二甲苯Ⅰ中20min、二甲苯Ⅱ中20min、無水乙醇Ⅰ中5min、無水乙醇Ⅱ中5min、75%酒精中5min,最后用自來水洗。
b)蘇木素染色:將上述切片置于蘇木素染液中染3~5min,用自來水清洗,采用分化液分化,再次清洗,返藍液返藍,最后用流水沖洗。
c)拍攝:正置光學(xué)顯微(日本尼康,Nikon Eclipse E100)在不同倍鏡下拍照。
2.1.6 體外2D模型評估產(chǎn)品的抗炎性能[18]
HGF-1細胞(5×104個/孔)接種于24孔板中暴露于稀釋后的口腔護理產(chǎn)品后用P.g(1.6×106CFU/mL)刺激。24h后, 收集離心上清液。取120μL上層清液進行細胞毒性檢測,操作根據(jù)細胞毒性檢測試劑盒說明書(Beyotime, Beijing, China),如2.1.8。同時再取120μL上層清液進行抗炎檢測,白介素(IL)-6和IL-1β蛋白質(zhì)分泌的含量檢測操作根據(jù)ELISA試劑盒說明書,如2.1.9。
2.1.7 體外3D模型評估產(chǎn)品的抗炎性能
將成熟的全層3D口腔黏膜連同Transwell小室轉(zhuǎn)移到裝有1.5mL培養(yǎng)基的6孔板中,將稀釋后的口腔護理產(chǎn)品和P.g(1.6×106CFU/mL)涂抹于口腔黏膜的上皮層上,孵育24h后,收集離心上清液。取120μL上層清液進行步驟2.1.8細胞毒性測試,再取120μL上層清液進行步驟2.1.9酶聯(lián)免疫吸附實驗。
2.1.8 細胞毒性測試
細胞毒性測試操作根據(jù)乳酸脫氫酶細胞毒性檢測劑盒說明書。
細胞毒性(%) =(受試組OD值-溶劑對照組OD值)/(細胞最大酶活性O(shè)D值-溶劑對照組OD值)×100
2.1.9 酶聯(lián)免疫吸附實驗(ELISA)
IL-1β和IL-6是牙周炎癥中最突出的兩個炎癥因子,它可以調(diào)節(jié)其他細胞因子的作用,在發(fā)生炎癥時其表達水平增加。可通過ELISA方法檢測待測樣品對這些炎癥相關(guān)因子的影響從而了解其抗炎作用的機理。IL-1β和IL-6的含量檢測操作根據(jù)ELISA試劑盒說明書。
炎癥因子抑制率(%) =(模型組炎癥因子含量-受試組炎癥因子含量)/(模型組炎癥因子含量-溶劑對照組炎癥因子含量)×100
2.1.10 小鼠耳腫脹TPA致炎模型評估產(chǎn)品的抗炎性能[19]
取雄性昆明種小鼠,體重18~22g,小鼠適應(yīng)性喂養(yǎng)3 d后,根據(jù)樣品數(shù)量隨機平均分組,每組4只,即TPA模型對照組、丁硼乳膏組(陽性對照組)、含復(fù)合物牙膏組。含復(fù)合物牙膏組每只動物的右耳里外兩面分別涂布適量膏體,每天早晚各1次,連續(xù)3天,該動物的左耳作為自身空白對照。陽性對照組處理方式同含復(fù)合物牙膏組,施加樣品為丁硼乳膏。末次涂含復(fù)合物牙膏及丁硼乳膏10min后,將小鼠右耳內(nèi)外兩側(cè)涂10 uL TPA(25 μg/mL),模型組同樣方式進行處理,6 h之后,脫臼處死動物,擦凈耳部所涂的膏體(左耳同樣進行擦洗操作),沿耳廓基線剪下兩耳,用6.5 mm打孔器沖下左右兩耳同一部位的圓片,稱重(精確到0.0001g),同一只動物左右耳的重量差即為腫脹度。
腫脹率(%) =(TPA組腫脹度—受試組腫脹度)/TPA組腫脹度×100
2.1.11 臨床測試評估產(chǎn)品的減輕牙齦炎癥性能[20]
進行隨機、雙盲、對照、平行的臨床研究。納入標準:
a)全身健康狀況良好、無全身系統(tǒng)性疾病、有20顆以上的完好牙齒;
b)年齡在18~70周歲;
c)如果為女性,不得處于妊娠期和哺乳期內(nèi);
d)改良Quigley-Hein菌斑指數(shù)≥1.5;
e)Loe-Silness齦炎指數(shù)≥1.0;
f)沒有同時參加其他類似試驗研究;
g)簽署知情同意書,能按要求完成臨床試驗。
排除標準:
a)戴正畸器具;
b)有部分義齒;
c)軟硬組織有腫瘤;
d)嚴重牙齦炎;
e)1個月內(nèi)使用抗生素;
f)參加其他臨床試驗;
g)吸毒及酗酒。
共100名研究對象參加了臨床研究,隨機分為含復(fù)合物牙膏組(試驗組)與不含復(fù)合物牙膏組(對照組),對全部實驗對象進行潔牙。給受試者統(tǒng)一發(fā)放各自相應(yīng)的牙膏和軟質(zhì)牙刷,要求受試者按規(guī)定一日刷牙2次(早、晚),每次時間至少1min。要求實驗過程中不使用任何其他口腔衛(wèi)生用品。對飲食和抽煙不作限制。6周時補充實驗的牙膏和牙刷。在使用牙膏牙刷6周和12周時,對受試者牙菌斑和牙齦炎狀況按照基線檢查的程序進行再評估。
檢查指標(第三磨牙除外):
菌斑指數(shù)(Quigley-Hein改良Turesky菌斑指數(shù),PI):檢查每個牙頰面及舌的近中,中及遠中面。
齦炎指數(shù)(改良Loe-Silness齦炎指數(shù),GI):檢查每個牙頰面及舌的近中,中及遠中面。
PI和GI由2位已經(jīng)過自身校正合格的醫(yī)師檢查。在基線檢查PI后,所有牙面的菌斑用橡皮環(huán)和拋光膏去除。
2.1.12 數(shù)據(jù)統(tǒng)計與分析
每個實驗至少獨立重復(fù)3次,數(shù)據(jù)以均數(shù)±標準差(M±SD)表示,采用GraphPad計算機軟件對所得數(shù)據(jù)進行分析,組間比較采用ANOVA統(tǒng)計學(xué)分析,運用Newman-Keuls方法計算顯著性差異,P<0.05表示差異有統(tǒng)計學(xué)意義。
2.2 實驗結(jié)果
2.2.1 3D口腔粘膜模型的構(gòu)建過程和組織學(xué)切片
口腔黏膜體外三維細胞模型的構(gòu)建過程如圖2所示。人體口腔黏膜模型的制備方法模擬人體口腔黏膜的生長發(fā)育過程,制備周期短,方法簡易,可控性強,原料易于獲取,可實現(xiàn)大規(guī)模產(chǎn)業(yè)化生產(chǎn),保證維持口腔黏膜各層細胞生長的微環(huán)境,制備的全層口腔黏膜更接近于正常人體口腔黏膜結(jié)構(gòu),并具備相應(yīng)的功能性,在體外條件下其功能和活性維持時間,能夠滿足相關(guān)口腔黏膜生物學(xué)檢測的需求。既彌補了傳統(tǒng)的使用單層黏膜組織模型的方法的缺陷,在縮短構(gòu)建時間、降低成本的同時,又保證了模型的安全性與功效性。
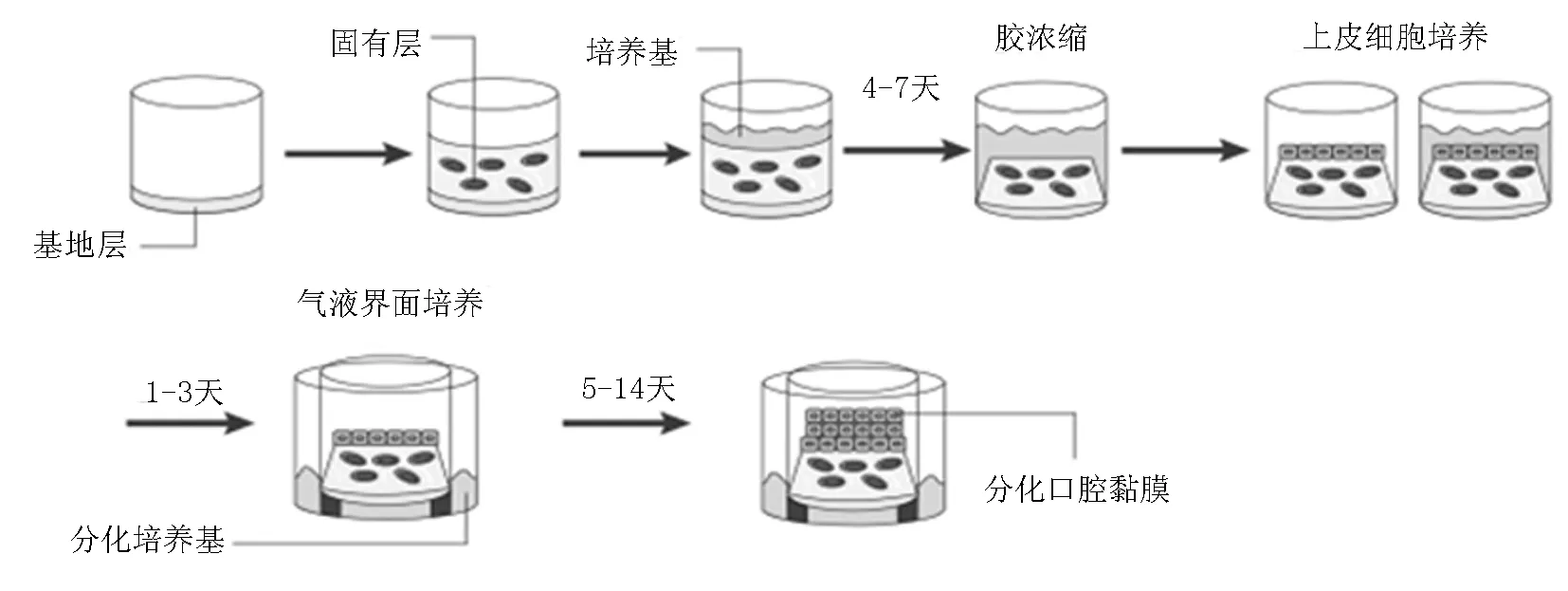
圖2 口腔黏膜體外三維細胞構(gòu)建的簡圖
為了能夠直觀地觀測到所得的人體口腔黏膜模型的結(jié)構(gòu),采用組織學(xué)切片分析方法,并將所構(gòu)建的人體口腔黏膜模型置于光學(xué)顯微鏡下觀測。結(jié)果顯示,該3D口腔黏膜自上而下分別為由上皮細胞生發(fā)復(fù)層分化組成的上皮層,由成纖維細胞及其胞外基質(zhì)組成的固有層組合(圖3),表明該模型構(gòu)建的有效性。
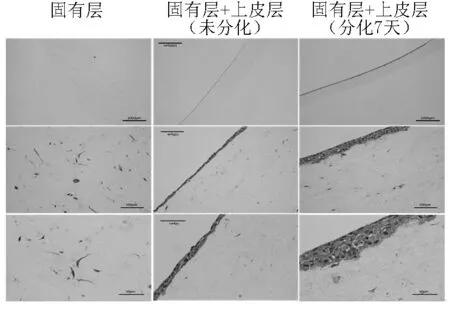
圖3 對構(gòu)建的口腔黏膜體外三維細胞模型行組織學(xué)切片
2.2.2 牙齦卟啉單胞菌誘導(dǎo)3D口腔粘膜的炎癥模型的構(gòu)建
評價牙齦卟啉單胞菌對細胞的毒性,采用LDH分析方法。結(jié)果顯示,P.g在濃度為1.6×103-1.6×106CFU/mL時無細胞毒性(表1)。將安全劑量范圍內(nèi)的P.g涂抹于口腔黏膜的上皮層上,分別孵育;在P.g對3D口腔黏膜無毒性劑量范圍內(nèi),本研究檢測了它誘導(dǎo)3D口腔黏膜8、14和24小時后產(chǎn)生IL-1β和IL-6量。實驗結(jié)果如圖4所示,與空白對照組相比,1.6×104-1.6×106CFU/mL的P.g在8h和24h時能顯著地誘導(dǎo)3D口腔黏膜分泌IL-1β和IL-6量。并且濃度為1.6×106CFU/mL的P.g誘導(dǎo)3D口腔黏膜24h后,3D口腔黏膜分泌的IL-1β和IL-6量最多,所以選在P.g濃度為1.6×106CFU/mL,誘導(dǎo)時間為24h進行后續(xù)抑制炎癥的實驗。
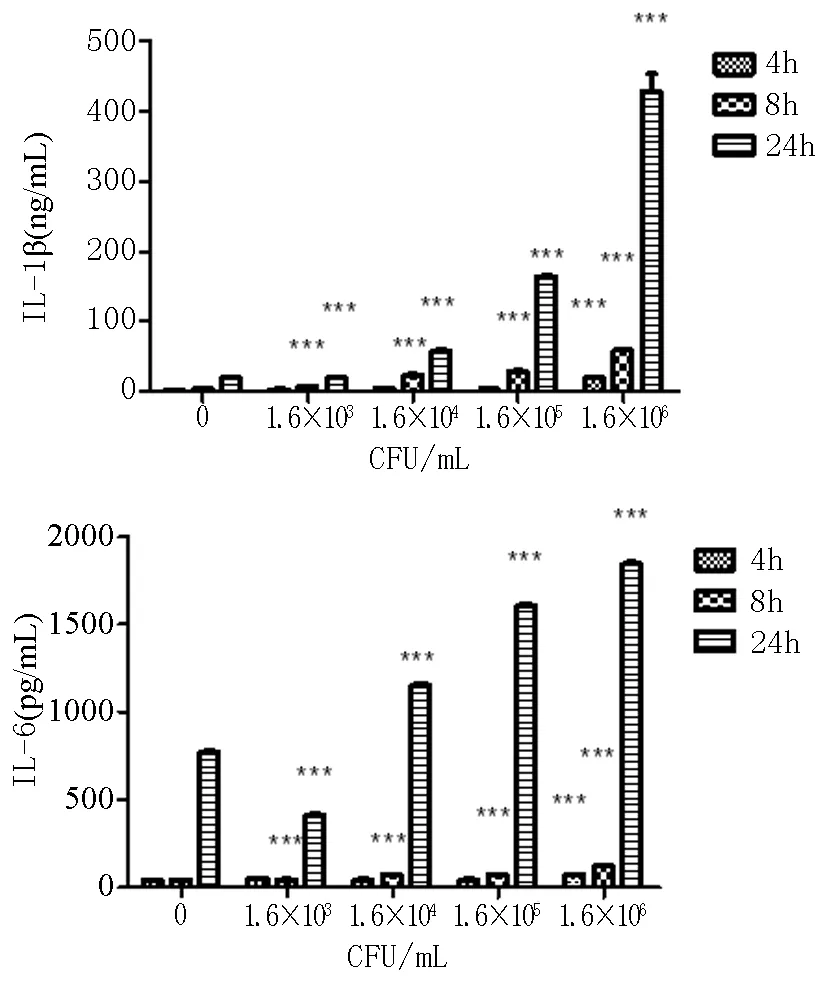
圖4 P.g刺激3D口腔黏膜分泌IL-1β和IL-6量

表1 不同濃度的牙齦卟啉單胞菌的細胞毒性
數(shù)據(jù)以3個不同實驗的平均值±標準差表示。
不同濃度牙齦卟啉單胞菌(1.6×103-1.6×106CFU/mL)對誘導(dǎo)3D口腔黏膜炎癥的影響。每個實驗至少獨立重復(fù)3次,數(shù)據(jù)以均數(shù)±標準差(M±SD)表示。(*** P<0.001 vs. controlgroup)
2.2.3 口腔護理產(chǎn)品對卟啉單胞菌誘導(dǎo)的2D口腔細胞釋放IL-6和IL-1β的抑制作用
首先采用LDH分析方法評價口腔護理產(chǎn)品對HGF-1細胞的毒性。結(jié)果顯示在200ug/mL時,空白牙膏對照組、含救必應(yīng)牙膏組和丁硼乳膏組顯示未有細胞毒性(表2)。因此在安全劑量下,采用ELISA分析方法檢測,其對P.g誘導(dǎo)的HGF-1細胞的IL-6和IL-1β的抑制作用。圖5顯示,空白牙膏對照組對IL-6和IL-1β的抑制率達到了57.2%和56.76%,與含救必應(yīng)牙膏組和丁硼乳膏組未有顯著性差別。可見未加功效物的牙膏也有抗炎作用,提示此2D口腔細胞不適合應(yīng)用于產(chǎn)品的抗炎功效評價。

圖5 口腔護理產(chǎn)品刺激2D口腔細胞分泌IL-1β和IL-6量
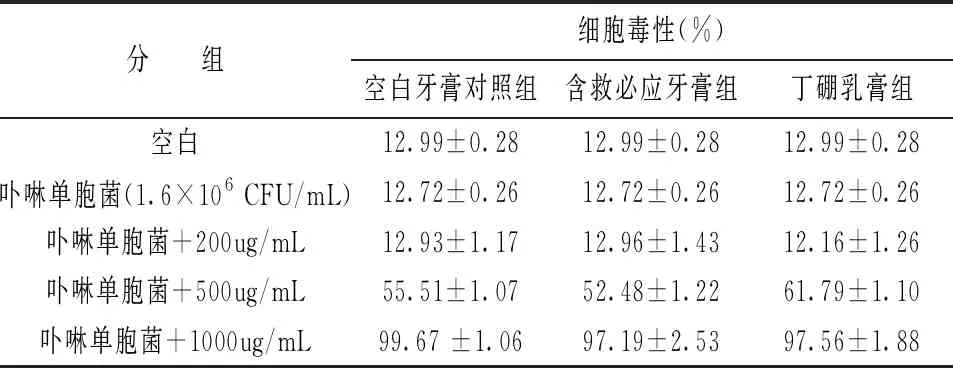
表2 口腔護理產(chǎn)品對卟啉單胞菌誘導(dǎo)2D口腔細胞的細胞毒性
數(shù)據(jù)以3個不同實驗的平均值±標準差表示。
200ug/mL空白牙膏、含救必應(yīng)牙膏和丁硼乳膏對P.g (1.6×106 CFU/mL) 刺激細胞24h后,IL-6和IL-1β產(chǎn)量的影響。每個實驗至少獨立重復(fù)3次,數(shù)據(jù)以均數(shù)±標準差(M±SD)表示。
2.2.4 口腔護理產(chǎn)品對卟啉單胞菌誘導(dǎo)的3D口腔黏膜釋放IL-6和IL-1β的抑制作用
采用LDH分析方法評價口腔護理產(chǎn)品對3D口腔黏膜的毒性。如表3所示,在20-1000ug/mL的濃度下,空白牙膏對照組、含救必應(yīng)牙膏組和丁硼乳膏組顯示未有細胞毒性。并且如圖5顯示,空白牙膏對照組對IL-6和IL-1β未有抑制作用。在安全劑量下,相比于空白牙膏對照組,含救必應(yīng)牙膏組和丁硼乳膏組對P.g誘導(dǎo)的3D口腔黏膜分泌的IL-6和IL-1β有顯著的抑制作用。500ug/mL的含救必應(yīng)牙膏組和丁硼乳膏組對IL-1β的抑制率到達56.02%和84.96%,對IL-6的抑制率到達78.52%和90.86%。提示,此3D口腔黏膜模型可能適用于產(chǎn)品的抗炎功效評價。
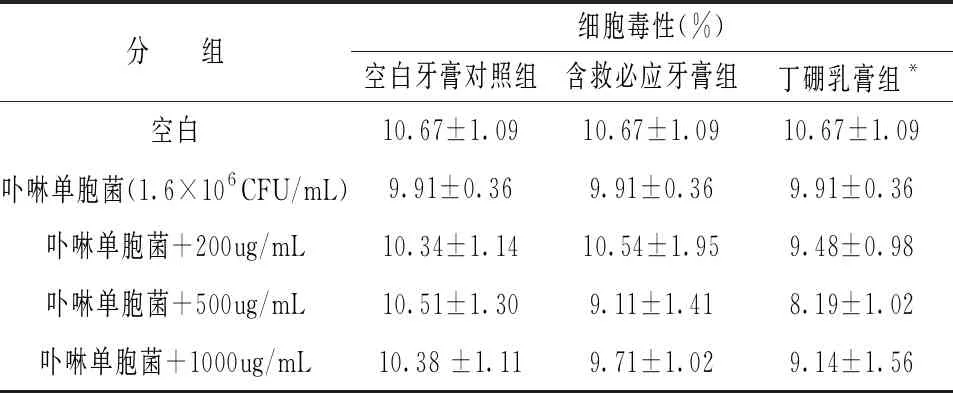
表3 口腔護理產(chǎn)品對卟啉單胞菌誘導(dǎo)3D口腔細胞的細胞毒性
不同濃度空白牙膏對照組(200μg/mL~1000μg/mL)、含救必應(yīng)牙膏組(200μg/mL~1000μg/mL)、丁硼乳膏組(200μg/mL~1000μg/mL)對卟啉單胞菌(1.6×106CFU/mL)刺激3D口腔黏膜24h后,IL-6和IL-1β產(chǎn)量的影響。每個實驗至少獨立重復(fù)3次,數(shù)據(jù)以均數(shù)±標準差(M±SD)表示。(# P<0.05 vs. controlgroup; * P<0.05; ** P<0.01; ***P<0.001 vs. LPSgroup)
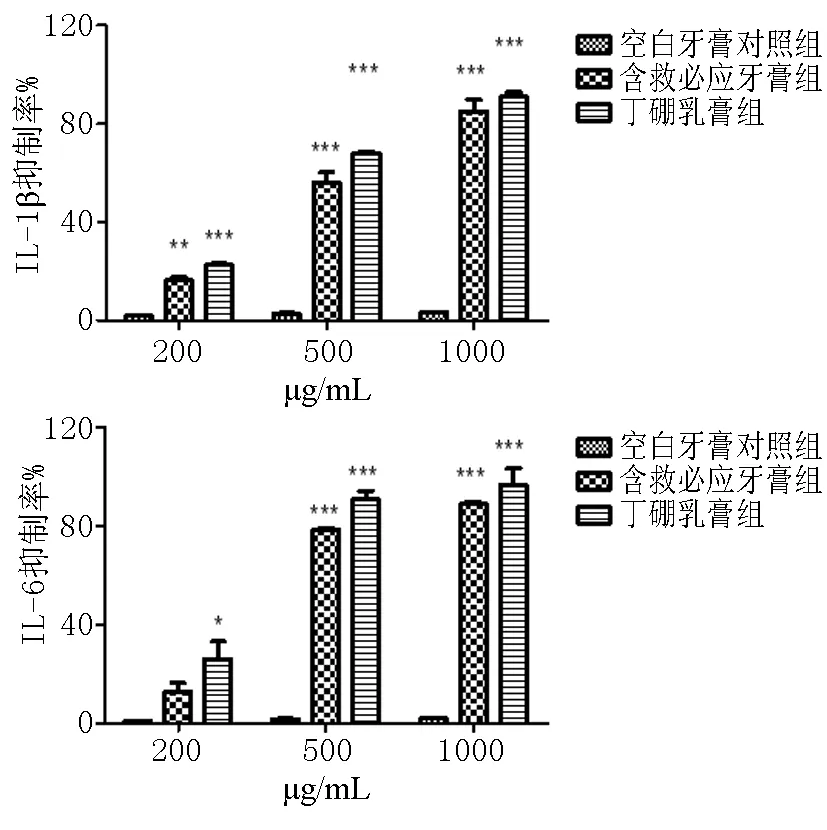
圖6 口腔護理產(chǎn)品對卟啉單胞菌刺激3D口腔黏膜釋放IL-6和IL-1β抑制率的影響
2.2.5 口腔護理產(chǎn)品對小鼠耳腫脹TPA致炎模型的抗炎性能作用
為了驗證3D口腔黏膜模型對口腔護理產(chǎn)品的抗炎功效評價的有效性,本項目又進行了小鼠耳腫脹試驗。由表4中的數(shù)據(jù)可知,含救必應(yīng)牙膏組和丁硼乳膏組對耳腫脹的抑制率分別達到36%和35%,且無顯著差異,兩款口腔護理產(chǎn)品具有較好的抗炎效果,同3D口腔黏膜模型驗證效果一致。

表4 小鼠耳腫脹TPA致炎模型評估含救必應(yīng)提取物的口腔護理產(chǎn)品的抗炎性能
2.2.6 含救必應(yīng)提取物的口腔護理產(chǎn)品的臨床測試
為更進一步驗證3D口腔黏膜模型對口腔護理產(chǎn)品的減輕牙齦炎癥的效果的準確性,本項目進行了臨床試驗。在100名受試者的測試中,86例受試者(實驗組43例,對照組43例)完成試驗。失訪的14例是因為個人和家庭原因,非試驗牙膏的不良反應(yīng)。兩組在基線時的各項指標基本類似(表5)。
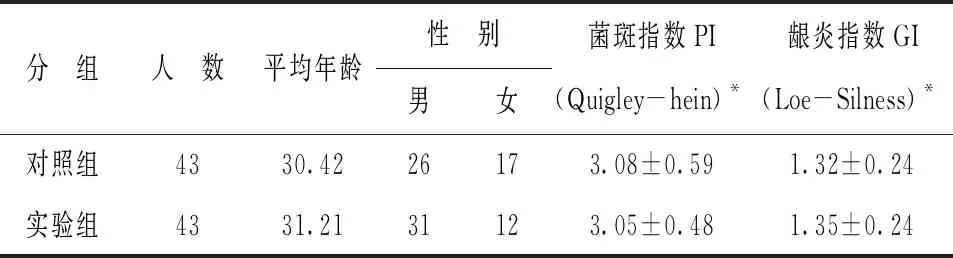
表5 完成研究人群的基線檢查結(jié)果
兩組試驗結(jié)果分別見表6。6周檢查結(jié)果:使用試驗牙膏與對照組比較,6周減少齦上菌斑和齦炎指數(shù)分別為1.97%與6.24%。組間均未顯示統(tǒng)計學(xué)意義的差異(P>0.05)。12周檢查結(jié)果:使用含復(fù)合物牙膏組(實驗組)較使用不含復(fù)合物牙膏組(對照組)減少齦上菌斑13.95%、含復(fù)合物牙膏組(實驗組)較不含復(fù)合物牙膏組(對照組)的齦炎指數(shù)減少13.77%。PI和GI在組間均顯示統(tǒng)計學(xué)意義的差異(P<0.01)。
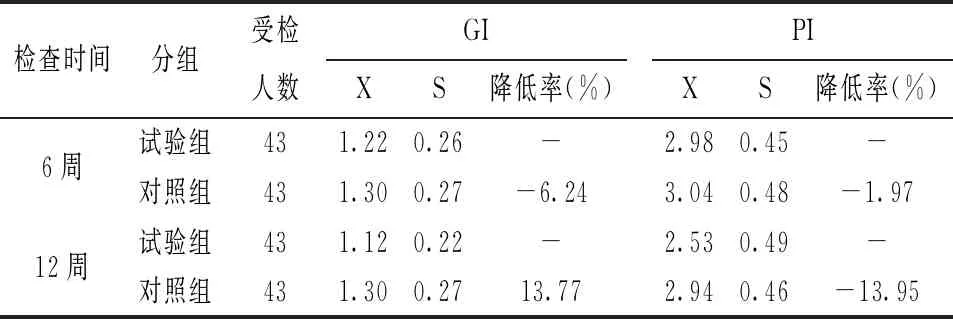
表6 試驗前后受試者牙齦指數(shù)與菌斑指數(shù)變化情況
臨床研究表明,使用含復(fù)合物牙膏與使用不含復(fù)合物牙膏相比,具有控制牙菌斑、抑制牙菌斑的形成,降低齦炎指數(shù),減輕牙齦炎的趨勢,具有改善牙齦健康的作用。12周組間具有統(tǒng)計學(xué)顯著性差異(P<0.05),12周臨床研究未觀察到該牙膏的副作用。
3 討論與分析
本研究以正常的人體口腔黏膜生理結(jié)構(gòu)和功能為基礎(chǔ),成功開發(fā)了3D口腔黏膜模型。研究構(gòu)建的3D口腔黏膜模型包括基底層以及固有層之外,還包括上皮層,從而高度接近人體口腔黏膜的上皮組織的結(jié)構(gòu)。由于將成纖維細胞復(fù)合于生物支架材料內(nèi)部,使生物支架材料模擬細胞外基質(zhì)的作用,在細胞之間形成適宜的空間分布和細胞聯(lián)系,并且使上皮細胞在固有層表面接種,通過氣液面培養(yǎng)法使上皮細胞復(fù)層化,使該模型接近人體口腔黏膜的上皮組織的結(jié)構(gòu)和功能。該3D口腔黏膜模型制備周期短,方法簡易,可控性強,原料易于獲取,可實現(xiàn)大規(guī)模產(chǎn)業(yè)化生產(chǎn),保證維持口腔黏膜各層細胞生長的微環(huán)境,制備的全層口腔黏膜更接近于正常人體口腔黏膜結(jié)構(gòu),并具備相應(yīng)的功能性。
為驗證所構(gòu)建3D口腔黏膜模型能夠滿足相關(guān)口腔黏膜生物學(xué)檢測的需求,本研究立足于含救必應(yīng)提取物的口腔護理產(chǎn)品的抗炎功效測試,對比2D模型、3D口腔模型、動物實驗和臨床實驗的相關(guān)性,探討了口腔黏膜體外三維細胞模型相對應(yīng)用在口腔護理產(chǎn)品功效驗證中的可行性。一方面,可以尋找并建立更加快捷可靠的抗炎評價方法;另一方面,也是為口腔護理行業(yè)動物替代實驗進行探索,最終旨在為口腔護理產(chǎn)品開發(fā)及功效驗證提供一個新思路。研究結(jié)果發(fā)現(xiàn),3D口腔模型相較于2D模型在口腔護理產(chǎn)品的抗炎功效評估過程中更具有可靠性和準確性。既彌補了傳統(tǒng)的使用單層黏膜組織模型的方法的缺陷,在縮短構(gòu)建時間、降低成本的同時,又保證了模型的安全性與功效性。未來,3D口腔黏膜模型將成為首選的口腔體外抗炎評價工具。

