EGFL6對骨血管生成的調控機制研究進展*
廖世杰,宋方茗,陳凱,唐生平,徐家科△
(1.廣西醫科大學第一附屬醫院 廣西再生醫學研究中心,南寧 530021;2.廣西醫科大學 廣西再生醫學重點實驗室,南寧 530021;3.西澳大利亞大學 生物醫學與科學學院,珀斯澳大利亞 6009)
骨具有高度的再生性,其生長和重塑過程經由無數的細胞活動密切協調。除成骨細胞和破骨細胞起主要作用外[1-2],內皮細胞參與的血管生成也是維持機體骨穩態動態平衡的重要一環[3]。骨組織中廣泛存在的血管網絡能運輸成骨細胞和破骨細胞前體、生長因子及營養物質以滿足骨骼的生長、代謝需求[4-5],血管內皮細胞還能產生多種成骨特性的內分泌因子調控機體骨穩態[6]。一些細胞因子如血管內皮生長因子A(VEGF-A)、缺氧誘導因子1α(HIF-1α)在骨血管生成過程中的作用已被研究證實[7-8],積極探索新的血管生成因子及其作用機制尤為重要。
表皮生長因子樣結構域6(epidermal growth factor-like domain,EGFL6)是由成骨細胞特異性分泌的促血管生成因子,能在骨修復過程中偶聯血管生成與成骨。明確EGFL6調控骨血管生成的機制,有望為骨愈合受損、骨質疏松、骨壞死等臨床難題提供新思路。
1 EGFL6 的分子特征
EGFL基因家族因能編碼包含單個或多個EGFL的蛋白而得名,能激活絲裂原活化蛋白激酶(MAPK)、細胞外信號調節激酶(ERK)、核因子-?B(NF-?B)及Notch等重要信號傳導通路介導如細胞遷移、黏附、增殖、分化[9]及胚胎發育、腫瘤發生、血管生成[10]等廣泛的生物學活動。
EGFL家族成員包括EGFL2、EGFL3、EGFL5、EGFL6、EGFL7、EGFL8和EGFL9等,其中EGFL6、EGFL7可編碼生長因子參與血管生成的調節,是目前研究的熱點。EGFL7在成骨細胞、破骨細胞、軟骨細胞和血管內皮細胞均有表達,能促進骨局部環境及某些腫瘤的內皮細胞遷移、血管生成[9,11]。EGFL6也被稱為MAEG,位于人的Xp22染色體上,由Yeung等[12]在1999年通過DNA分子雜交高通量篩選而發現。EGFL6蛋白分子結構包括1個N端信號肽結構域、1個整合素結合位點(RGD)、5個EGF樣重復結構域和1個C端MAM結構域[13]。EGFL6蛋白中位于N端的信號肽區提示其可能是一種分泌蛋白[12];RGD基序可與整合素受體結合誘導細胞增殖、分化[14-16];EGFL樣重復結構域包含30~40個氨基酸殘基,與表皮生長因子(EGF)有著顯著同源性,可通過蛋白質間的相互作用發揮生物學功能[5];位于C端的MAM結構域被認為能夠發揮黏附功能[17]。此外,EGFL6還有2個潛在的N-糖基化位點和1個潛在的酪氨酸磷酸化位點,提示EGFL6可能作為一種激酶底物,通過磷酸化來調節表達或調節功能[12]。
EGFL6最初發現主要作用于胎兒的早期發育,隨后在成熟脂肪細胞、毛囊、軀干真皮組織、顱面區間質及某些腫瘤中也發現其存在[18-21]。骨骼系統與EGFL6的聯系最早由Chim等[20]的研究所揭示,筆者發現EGFL6能在成骨細胞中特異性地表達,且與內皮細胞的遷移、血管形成關系密切。近年來學者們不斷深入對EGFL6的研究,展示其在成骨細胞與血管內皮細胞的交互中發揮著重要作用。
2 EGFL6 調控骨血管生成的相關機制
作為富含血管的組織,骨的形成過程并非孤立,而是與骨血管的生成緊密聯系且相互促進,二者在時間、空間上的關系稱為“血管生成-成骨偶聯”作用[22]。高表達CD31和內皮黏蛋白(EMCN)的H型血管在骨修復中地位重要,H型內皮細胞能分泌許多刺激骨祖細胞增殖和分化的因子來調節成骨,可作為評估局部骨血管生長狀況及成骨能力強弱的標志[22-24]。目前認為,骨重塑發生在一個稱為骨重塑室的特殊血管結構中,其內包含的成骨細胞、破骨細胞、骨細胞以及內皮細胞、周細胞等細胞能緊密協作,調控復雜而有序的骨修復活動[5,25-26]。
骨重塑室中,內皮細胞可分泌骨形態發生蛋白(BMP)、成纖維細胞生長因子(FGF)和胰島素樣生長因子(IGF)等成骨因子影響骨的生長和重塑[6];而成骨細胞能旁分泌EGFL6作用于臨近的血管內皮細胞,促進內皮細胞增殖、遷移及管狀結構形成,同時能增強內皮細胞VEGF-A的表達,誘導H型血管生成。骨愈合受損、骨壞死等由于局部血運的缺乏是目前臨床治療的難題,促進血管生成和血供恢復是治療的關鍵。EGFL6經由多種途徑調控血管生成(圖1),了解其作用機制,有助于加深對骨修復、骨血管重建的認識。
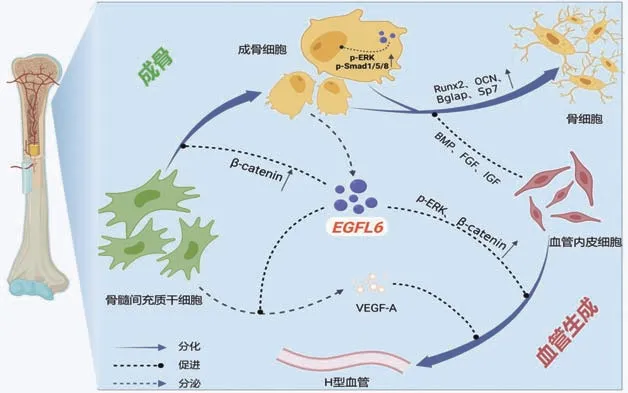
圖1 EGFL6偶聯成骨與血管生成
2.1 EGFL6與MAPK/ERK信號通路 隨著對EGFL6的研究逐步展開,其在骨血管生成的作用機制也在不斷地被揭示。MAPK/ERK信號通路是EGFL6調控骨血管生成的重要一環,該通路屬于蛋白質-絲氨酸/蘇氨酸激酶級聯反應,參與了細胞的增殖、分化、遷移和凋亡等生物學過程[27-28]。研究發現,EGFL7能通過結合EGFR激活ERK信號通路,調控骨血管生成[11]。
Chim等[20]首次發現并研究了EGFL6對骨疾病作用,探索了EGFL6是否經由MAPK/ERK信號通路影響骨血管生成。該研究首先驗證了EGFL6是一種分泌蛋白,隨后體外實驗發現含有EGFL6的條件培養基不僅能增強內皮細胞的遷移,還能誘導內皮細胞管狀結構的形成與雞胚絨毛尿囊膜的血管生成。與對照組相比,EGFL6組的內皮細胞中磷酸化ERK(p-ERK)的表達水平顯著升高,進一步抑制ERK通路,EGFL6誘導內皮細胞遷移及小管形成的能力被顯著抑制。Shen等[29]的研究顯示,經EGFL6處理后人臍靜脈內皮細胞(HUVECs)和骨髓間充質干細胞(BMSCs)中p-ERK1/2的表達水平也可發生不同程度的改變。此外,Chim等[20]的研究發現外源性EGFL6不誘導成骨細胞增殖和礦化,這與本課題組的實驗結果相佐證—成骨細胞以胞內分泌EGFL6的方式經由MAPK等信號通路內源性促進成骨[30],同時也提示EGFL6能偶聯成骨與血管生成。以上研究結果證明了EGFL6可通過ERK信號在血管內皮細胞增殖、遷移、管腔形成等方面參與骨血管生成過程。EGFL6可在體外經MAPK/ERK信號通路促進骨與血管生成,但其在生物體內如小鼠模型中的作用以及具體的細胞間通訊形式,還有待進一步探索。
2.2 EGFL6與Wnt/β-catenin信號通路Wnt信號通路是一個復雜的調控網絡,在細胞增殖、分化、黏附和凋亡等多種過程中發揮作用,該通路包括3個主要分支:經典Wnt通路(即Wnt/β-catenin通路)、Wnt/PCP通路及Wnt/Ca2+通路。其中,Wnt/β-catenin信號通路在骨的正常生長及代謝中的地位重要,能參與調控BMSCs、成骨細胞以及破骨細胞的增殖、分化[31-32]。
Shen等[29]研究發現,重組EGFL6蛋白可以促進HUVECs的增殖、遷移和小管形成,促進CD31表達及EMCN的內皮細胞形成;此外,通過RT-qPCR、western blotting等實驗發現,EGFL6可增強體外HUVECs和BMSCs中β-catenin和活性β-catenin的表達。在大鼠牽張成骨模型中,免疫熒光實驗也檢測到經EGFL6干預后牽張間隙活性β-catenin的增加,表明Wnt/β-catenin信號通路是EGFL6促進血管生成和骨生成的一個潛在機制[29]。而Wnt信號通路的抑制劑DKK1只能部分抑制由EGFL6誘導的BMSCs成骨分化及成骨相關蛋白(如CXCR4、Runx2)的上調,提示此信號通路可能僅為EGFL6調控網絡中的一部分,還有其他信號傳導通路參與其中。該實驗表明外源性EGFL6增強了體外BMSCs的成骨分化,并通過刺激血管生成加速骨再生。
2.3 EGFL6與BMP/Smad信號通路BMP信號通路是以BMP為核心和啟動位點的完整信號系統,包括典型的Smad途徑和非典型的MAPK途徑[33],在骨骼發育、骨形成和骨穩態調節過程中至關重要。BMP作為一種分泌型的多功能細胞因子,參與了各種器官的形成和維持過程,其中BMP-2能誘導BMSCs向成骨細胞分化,并增加骨鈣素等成骨相關因子的表達從而促進骨形成[34]。另外,在所有的Smad蛋白中Smad1/5/8與成骨細胞的分化密切相關,被磷酸化的Smad1/5/8(p-Smad1/5/8)與Smad4結合形成復合體,調節相關靶基因的轉錄[34-35]。
BMP/Smad信號通路作為誘導成骨分化的重要信號,經分泌蛋白EGFL6的調控在增強骨與血管偶聯、促進骨血管生成中扮演重要角色。本課題組實驗發現,成骨細胞來源的EFGL6不僅能促進血管內皮細胞增殖、遷移及誘導骨血管的生成,還能調控成骨分化而間接促進血管的生成。過表達EGFL6的BMSCs成骨能力增強;而沉默EGFL6的BMSCs成骨能力明顯減弱,表現為礦化程度降低并伴有關鍵成骨基因(如Bglap、Sp7和Runx2)的表達下調。用BMP-2干預過表達或沉默EGFL6的BMSCs后,可檢測到過表達組p-Smad1/5/8較沉默組明顯增高,提示EGFL6能通過激活BMP/Smad信號通路調控成骨分化[30]。此外,外源性的EGFL6能促進體外內皮細胞形成管狀結構,卻對成骨細胞的增殖及礦化能力無明顯影響[20]。但Liu等[36]研究發現,外源性重組EGFL6蛋白可通過調控BMP-2/Smad4信號通路促進脂肪來源的間充質干細胞向成骨細胞方向分化,這與Shen等[29]的研究結果相似。由于Shen等[29]使用的是含有EGFL6部分片段的重組蛋白,而本課題組使用的是EGFL6的全長蛋白,所以筆者初步猜想不同來源的重組EGFL6蛋白具有的分子差異性可能是導致實驗結果產生差異的原因,同時也提示外源性EGFL6蛋白對成骨分化的生物效應可能具有片段特異性。
2.4 EGFL6與其他分子 除上述列舉信號通路外,一些相關分子可能參與EGFL6對骨血管生成的調控。例如,在胚胎時期EGFL6通過與整合素β1結合激活ERK相關信號通路,參與脊椎動物胚胎血管發育[37]。轉錄因子Twist1可與EGFL6啟動子結合激活下游信號,隨著Twist1的表達量增加可在一定程度提高EGFL6的轉錄活性,促進傷口血管生成及愈合[16];非編碼RNA miR-6086可以直接與EGFL6 mRNA結合負向調控卵巢癌的腫瘤生長和血管生成[38],描述了EGFL6可能的上游調控機制。經典的促血管生成因子VEGF-A在過表達EGFL6的BMSCs中表達上調,而在敲除EGFL6的BMSCs中表達下降[30],可以猜測成骨細胞分化過程中EGFL6可能是VEGF-A的上游調節劑,二者相互協作以調節骨微環境中的血管生成和成骨。腎連蛋白(NPNT)與EGFL6相似,擁有EGF樣重復結構域,能促進成骨細胞分化、礦化以及骨血管的生成[39-40],有研究顯示,皮膚毛囊缺乏NPNT可導致EGFL6代償性地表達上調[19]。骨血管生成是一個多因素交叉作用的復雜過程,多種信號通路與相關分子可能同時參與了此過程的調控,隨著未來研究的深入,期待更多EGFL6調控網絡新成員的發現。
3 EGFL6 調控骨血管生成相關的動物模型
選擇合適的動物模型有助于體內實驗的開展,對揭示EGFL6的作用機制具有重要意義。因繁殖周期短、成本較低、遺傳背景明確等優點,嚙齒類動物是骨修復實驗的優選動物模型[41]。其中,大鼠、小鼠是目前用于研究EGFL6調控骨修復的主要動物。
牽張成骨模型與其他模型相比,能從時間和空間角度反應骨重建的病理過程,可以更直觀地表現骨重塑部位血管生成的情況。Shen等[29]在大鼠脛骨中段建造了牽張成骨模型,隨后將外源性的EGFL6蛋白注入牽張間隙中,利用影像學、組織學及免疫學方法發現EGFL6同時促進了H型毛細血管及新生骨的形成,新血管能沿著新生骨組織圍繞成柱狀,向著牽張間隙延伸從而加速骨愈合。該大鼠模型實驗提示,提高局部EGFL6的濃度可能是促進骨缺損修復和骨折愈合的方法,為未來EGFL6的臨床應用提供了動物實驗基礎,但最適蛋白濃度、是否存在其他調節因子代償以及是否對人體有效仍需進一步研究。
另一方面,本課題組利用基因敲除技術構建了EGFL6敲除的小鼠模型,發現生理狀態下EGFL6的缺失不影響小鼠正常骨表型的發展,EGFL6敲除小鼠意外地表現出與對照組無明顯差異的身高、體重以及骨小梁、骨皮質參數[30]。這或許表明EGFL6在生理狀態下的骨發育過程中不占主要地位,亦或提示存在其他代償性的血管因子彌補了EGFL6的缺失,所以解決哪些因素可以彌補EGFL6的損失也是未來的工作方向之一。而在EGFL6敲除小鼠制造脛骨單皮質骨缺損后,缺損區域的H型血管和表達Runx2的成骨細胞顯著減少,導致骨愈合延遲,表明骨修復的病理狀態下,EGFL6作為一種關鍵的調節因子對骨與血管的生成至關重要。
4 總結與展望
目前針對EGFL6的研究多見于腫瘤領域,但隨著研究的深入,其在骨修復重塑中的作用越發引人注目。血管生成是骨生長、骨重塑以及病理性骨疾病的重要組成部分。EGFL6或許在正常生理狀態下對骨生長不起主要作用,但在病理狀態下的骨缺損修復過程中則是不可或缺的,其可經多種信號通路及相關分子調控成骨細胞與血管內皮細胞之間的交互,偶聯成骨與血管生成,促進骨組織的修復與再生。但對于EGFL6的具體作用機制還需進一步挖掘,如EGFL6是通過內源性還是外源性的方式促進成骨分化;除上述通路外是否還存在其他作用通路,有無某條優勢通路在EGFL6調控網絡中起主導作用;EGFL6上游的調控機制、具體的分子靶點及其在其他骨疾病中的作用等。
綜上所述,深入研究EGFL6在骨微環境中調控血管生成的作用機制,加深對骨重建及血管再生的認識,有助于為骨愈合受損、骨壞死等臨床骨病的治療提供一個理想的靶點。

