miR-499a-5p在骨肉瘤中的表達及其對骨肉瘤發生發展的影響*
崔小飛,朱博,李康路,黃漢記,3,盧德杰,趙勁民△
(1.廣西醫科大學第一附屬醫院創傷骨科,南寧 530021;2.廣西組織器官再生生物醫學材料工程中心,南寧 530021;3.廣西再生醫學重點實驗室,南寧 530021)
骨肉瘤(OS)是青少年惡性骨腫瘤中最常見的原發性腫瘤之一,其特點是侵襲性強、早期全身轉移、肺轉移是其主要的死亡原因[1-2]。目前臨床上對OS患者原發腫瘤的常用治療方法是化療、手術治療和放療。然而,手術切除往往不能完全切除腫瘤,甚至在上述治療后仍經常發生復發和轉移,導致高死亡率[3]。目前對OS的早期診斷比較困難,主要原因是缺乏敏感和特異的診斷標記物,無法在早期監測疾病,進行預后分析。因此,需要新的診斷生物標志物和更好的治療靶點來提高OS轉移的早期診斷和治療效果[4]。
microRNAs是一組新發現的內源性非編碼小RNAs(miRNAs),負向調節3’非翻譯區(UTR)的靶蛋白編碼miRNA的穩定性和翻譯[5]。異常表達的miRNAs參與調控不同類型人類癌癥的發生和發展,并與細胞增殖、凋亡有關[6]。由此可見,miRNAs被認為是在癌癥診斷、預后和治療效果方面具有潛力的生物標志物[7]。研究表明,miRNAs與OS的發生和疾病的臨床病程調控密切相關[8]。而差異表達miRNAs通過負調控靶基因表達水平,為OS的早期診斷、臨床精準治療以及預后評估提供了新的靶點,其變化與OS的分化程度、腫瘤分期及肺轉移密切相關[4]。本研究旨在觀察miR-499a-5p在OS中的表達,并探討miR-499a-5p的生物學功能、具有生存意義的典型通路及其在OS中的靶mRNA,以期為OS的診斷和治療提供潛在的生物標志物。
1 材料與方法
1.1 細胞和主要試劑
骨肉瘤細胞系(143B,MNNG)和成骨細胞系(hFOB1.19)均購買于深圳市豪地華拓生物科技有限公司(深圳)。hFOB1.19專用培養基購自普諾賽生命科技有限公司(武漢)。胎牛血清購自天杭生物科技股份公司(杭州)。提取RNA的試劑盒購買于美基生物科技有限公司(廣州)。cDNA反轉錄試劑盒購自Takara生物技術公司(日本東京)。DMEM/F-12培養基購買于美侖生物技術有限公司(大連)。2×SYBR Green qPCR Mix購買于愛博泰克生物科技有限公司(武漢)。
1.2 方法
1.2.1細胞培養 采用hFOB1.19專用培養基培養hFOB1.19細胞,采用完全培養基培養骨肉瘤細胞系。完全培養基由DMEM/F-12培養基加入1%青霉素(100 U/mL)、1%鏈霉素(100 U/mL)和10%胎牛血清配制。將細胞置于培養箱(37℃、5% CO2)中進行培養。各隔3 d更換1次新鮮的培養基,當細胞密度達到90%~95%時按1∶3的比例進行細胞傳代。
1.2.2 miRNA提取與實時熒光定量PCR(RT-qPCR)當細胞培養至90%~95%,按照miRNA提取試劑盒的說明進行miRNA的提取,并利用反轉錄試劑盒合成cDNA。采用2×SYBR Green qPCR Mix和miR-499a-5p引物進行RT-qPCR反應。采用2-△△CT法計算miR-499a-5p相對表達量,用U6作為內參。
1.2.3 miRNA靶基因的預測 為了探索可能影響OS發生和發展的miRNA調控基因網絡,本研究從3個數據庫miRDB(http://mirdb.org/)、DIANATOOLS(http://diana.imis.athena-innovation.gr/DianaTools/index.php? r=microTCDS/ index)、Target Scan(http://www.targetscan.org/vert-71/)中預測miR-499a-5p的下游靶基因集,將這3個miRNA靶基因數據進行交集分析,以維恩圖的形式顯示。利用Venny(https://bioinfogp.cnb.csic.es/tools/venny)在線工具構建維恩圖。
1.2.4基因本體論(GO)和京都基因和基因組百科全書(KEGG)富集分析 進一步使用R語言“clusterProfiler”包對miR-499a-5p的靶基因進行富集分析。運用“org.Hs.eg.d b”軟件包進行注釋轉換,最后通過R軟件包“ggplot2”繪制氣泡圖。以P<0.05為差異有統計學意義。
1.2.5蛋白互作網絡(PPI)篩選樞紐基因 利用string數據庫,將miR-499a-5p的靶基因進行構建蛋白互作網絡。并利用得到的PPI網絡信息,導入Cytoscape 3.8.2軟件并使用“cytoHubba”插件篩選出top3基因作為候選基因。
1.2.6生存分析 通過GEPIA(http://gepia.cancerpku.cn/index.html)在線網站對篩選出top3關鍵候選基因進行生存分析,篩選生存預后顯著差異的靶基因。以P<0.05為差異有統計學意義。
1.3 統計學方法
采用GraphPad Prism 8.0對實驗數據進行統計分析和繪制柱狀圖。計量資料以均數±標準差()表示,組間比較采用t檢驗,以P<0.05為差異有統計學意義。

表1 PCR引物序列
2 結果
2.1 miR-499a-5p在OS細胞中的表達
RT-qPCR檢測結果顯示,與人成骨細胞系(hFOB1.19)比較,miR-499a-5p在人OS細胞系(143B及MNNG)中的表達降低(P<0.05),見圖1。
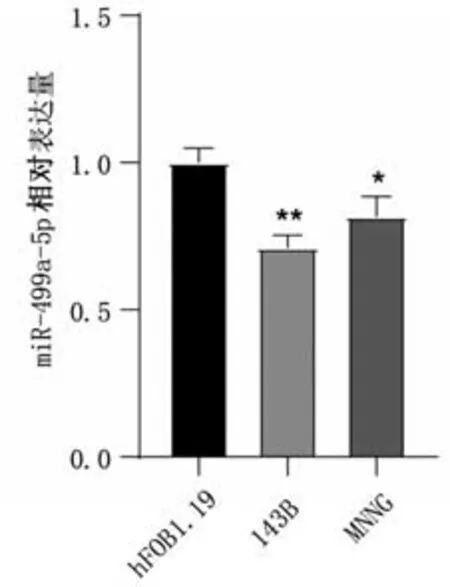
圖1 miR-499a-5p 在人成骨細胞系(hFOB1.19)及人OS 細胞系(143B及MNNG)中的表達
2.2 miRNA-499a-5p 靶向基因的預測及富集分析結果
通過3種在線預測工具對miR-499a-5p靶向的基因進行預測。結果顯示,miRDB數據庫預測到586個基因,DIANATOOLS數據庫預測到971個基因,Target Scan數據庫預測到421個基因。對其預測的基因進行交集,發現3個預測工具同時預測到181個潛在的靶基因,見圖2。并進行GO和KEGG富集分析處理,其中,GO分析結果如圖3所示,生物過程(BP)富集最顯著的是RNA聚合酶Ⅱ促子轉錄的正向調控,其次是正調控轉錄;細胞組成(CC)富集最顯著的是細胞核,其次是細胞質;分子功能(MF)富集最顯著的是蛋白結合,其次是DNA結合。另一方面,KEGG富集分析結果表明,最顯著的是人類T細胞白血病病毒1感染信號通路(HTLV-I infection),其次是軸突引導通路(axon guidance pathway)、催產素信號通路(oxytocin signaling pathway)和T細胞激活信號通路(T cell receptor signaling pathway),見圖4。
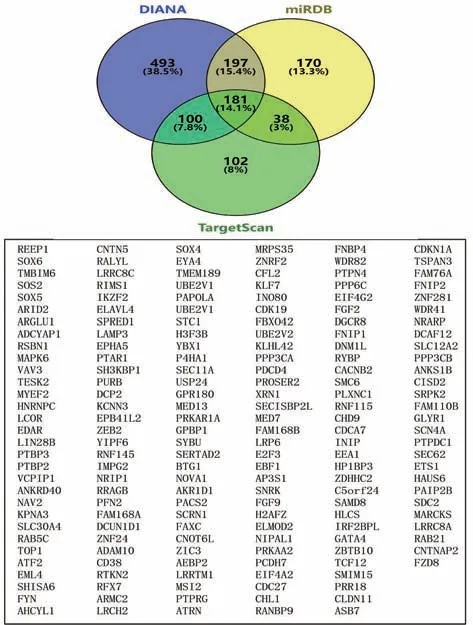
圖2 miR-499a-5p調控的靶基因的預測

圖3 GO功能富集分析
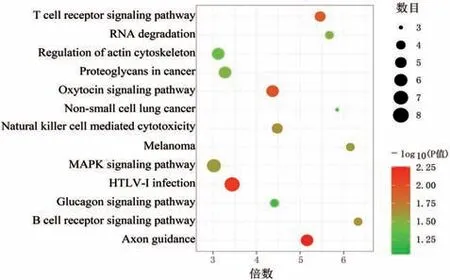
圖4 KEGG通路的富集分析
2.3 miR-499a-5p調控的PPI構建
由miR-499a-5p調控的181個候選靶基因,使用string數據庫構建的網絡信息得到PPI圖,見圖5A,并將蛋白互作信息導入Cytoscape 3.8.2軟件構建網絡圖并篩選得到top3基因分別是異質核糖核蛋白C(HNRNPC)、真核翻譯起始因子4γ2(EIF4G2)和真核翻譯起始因子4A同工型2(EIF4A2),其中基因HNRNPC有14個節點,基因EIF4G2有8個節點,基因EIF4A2有7個節點,見圖5B。
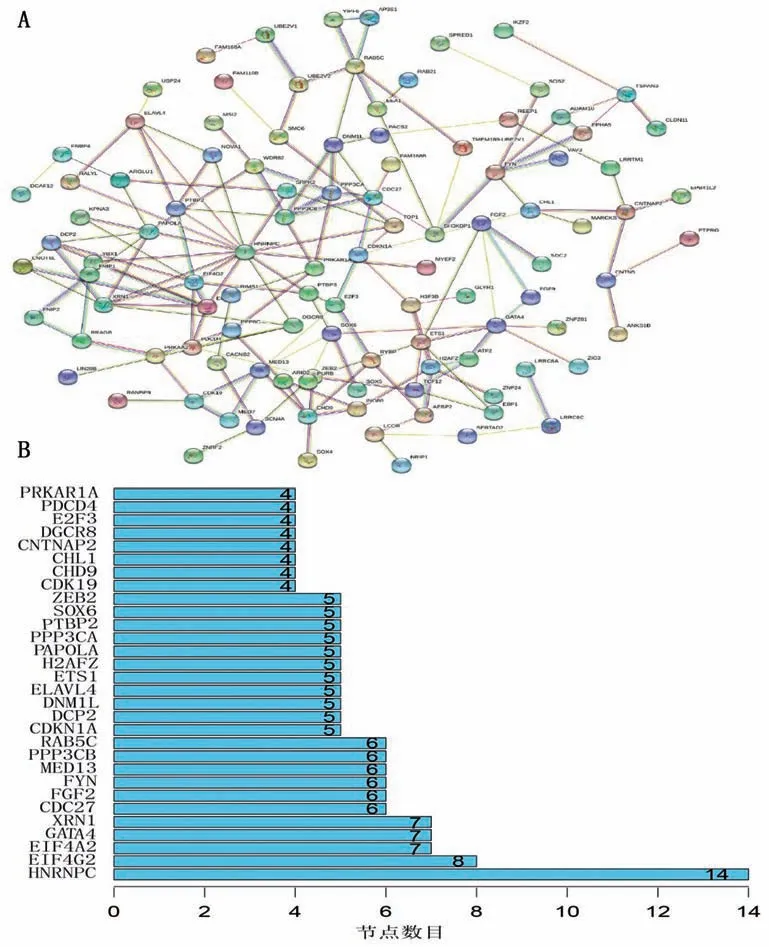
圖5 miR-499a-5p調控網絡中靶基因的篩選
2.4 生存分析
通過GEPIA在線數據集對HNRNPC、EIF4G2和EIF4A2進行生存分析。HNRNPC、EIF4G2和EIF4A2的生存分析結果顯示其P值分別為0.01、0.61和0.38。其中只有HNRNPC差異有統計學意義(P<0.05),即OS標本中HNRNPC基因高表達組較低表達組預后較差(P<0.05),見圖6。
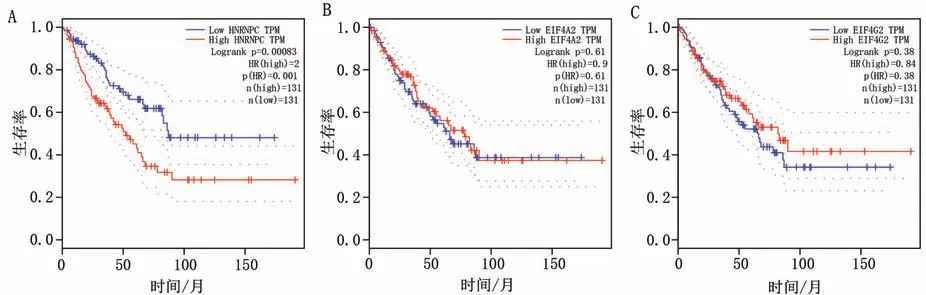
圖6 Top3關鍵基因的生存分析曲線圖
2.5 構建miR-499a-5p 調控HNRNPC 進而影響OS進展的模式圖
通過前述的分析,推測低表達的miR-499a-5p可能通過調控HNRNPC的高表達,最終加快OS的增殖和轉移,見圖7。

圖7 miR-499a-5p調控HNRNPC進而影響OS進展的模式圖
3 討論
OS常見于青少年,但可以在任何年齡發展。診斷年齡是OS的一個預測因素,但其分子基礎仍不得而知[9]。越來越多基于公共數據庫的研究,如GEO和TARGET數據庫,被運用于探求新的OS生物標志物[9-10]。在基因表達調控過程中,miRNAs有著重要作用,結合靶mRNA后會致使后者的裂解或抑制后者的翻譯機制,導致蛋白質水平下降[7]。多種信號通路,包括細胞凋亡均被miRNAs調節[11]。先前的研究已經揭示了miR-499a-5p在許多癌癥中的作用,包括乳腺癌[12-13]、肺癌[14]、肝癌[15]、結直腸癌[16]和黑素瘤[17]以及在心肌梗死的抗細胞凋亡作用[18]和線粒體裂變等作用[19]。然而,關于miR-499a-5p與OS發生風險的相關報道很少。本研究結果表明,與普通成骨細胞比較,miR-499a-5p在OS細胞143B、MNNG中表達顯著降低。此外,本研究通過3種miRNA靶基因預測軟件獲得181個miR-499a-5p下游靶向基因,利用string數據庫和Cytoscape3.8.2軟件結合分析找到了HNRNPC、EIF4G2和EIF4A2 3個最為關鍵的基因。KEGG富集分析揭示其靶基因主要富集于人類T細胞白血病病毒1感染信號通路、軸突引導通路、催產素信號通路和T細胞激活信號通路。已有相關文獻指出,人類T細胞白血病病毒1感染信號通路具有干擾細胞增殖和T細胞轉化[20],并促進神經酰胺和Fas配體誘導細胞凋亡的作用[21],形成宿主對抗癌癥發展的障礙[22];軸突引導通路上有豐富的OS驅動基因[23],并在OS轉移過程中起重要作用[24];催產素信號通路可調節新皮質的生長,影響抗炎、抗氧化的進程[25];T細胞激活信號通路在多種生物學進程中都有參與,經常在人類癌癥中異常激活[26- 27]。越來越多的證據顯示,KEGG主要富集的這4種信號通路在骨組織中經常被過度激活[28],參與了腫瘤的發生、增殖、侵襲、細胞周期進程、抑制凋亡、血管生成、轉移和耐藥等過程[29-30]。為了進一步篩選出關鍵預后基因,本研究通過GEPIA在線數據集對關鍵基因HNRNPC、EIF4G2和EIF4A2進行生存分析,結果顯示僅有HNRNPC具有顯著意義的差異基因,HNRNPC過表達組預后不良的發生率明顯高于HNRNPC低表達組,最終篩選出HNRNPC作為miR-499a-5p在OS中具有影響預后意義的關鍵基因。HNRNPC屬于目前已知的一種RNA連合蛋白,在RNA剪接、穩定和表達方面起著重要的作用[31-32]。這一參與可變剪接的基因與腫瘤的進展、治療抗性有著密切的關系,且在腫瘤甲基化方面的研究已有報道[33],可增強多種類型腫瘤的惡性程度,包括乳腺癌[34]、前列腺癌[35]和結腸癌[32]。除此之外,經過生物信息學方法證明,HNRNPC基因的表達與患有多形性膠質母細胞瘤、口腔鱗狀上皮癌的患者預后情況呈負相關關系[33-36]。因此,HNRNPC被認為是腫瘤相關基因,很可能在OS的發生發展中發揮著關鍵作用。
綜上所述,本研究結果表明,miR-499a-5p在OS細胞系中的表達低于成骨細胞系,通過數據庫預測miR-499a-5p下游調控靶基因以及靶基因的生存分析獲得關鍵預后基因為HNRNPC,由于HNRNPC在OS中與生存預后相關,因此我們推測miR-499a-5p很可能通過調控HNRNPC的表達,從而影響OS的發生發展。

