HIF-1α、HIF-2α和GLUT-1在非霍奇金淋巴瘤中的表達及其臨床意義*
張庭鳳,蔡正文,孫蔚亮,梁 俐,甘廷慶,羅婕
(廣西醫科大學第二附屬醫院腫瘤內科,南寧 530007)
缺氧誘導因子-1(hypoxia inducible factor-1,HIF-1)和葡萄糖轉運蛋白-1(glucose transporter-1,GLUT-1)在腫瘤細胞的生長和凋亡中起著重要的調控作用,與腫瘤的發生、轉移和凋亡密切相關。在乏氧微環境中,HIF-1和GLUT-1表達上調,導致腫瘤對缺氧的適應。國內、外的相關研究顯示,HIF-1α、HIF-2α和GLUT-1蛋白能夠作為惡性腫瘤的早期預警指標以及腫瘤良、惡性的鑒別診斷指標,而對三者在非霍奇金淋巴瘤中表達情況的研究報道較少。淋巴瘤國際預后指數(international prognostic index,IPI)是非霍奇金淋巴瘤常用的預后判斷指標,而HIF-1α、HIF-2α和GLUT-1的表達與IPI的關系尚未見報道。本研究旨在對HIF-1α、HIF-2α和GLUT-1在非霍奇金淋巴瘤中的表達情況以及與IPI的相關性進行分析,現將結果報道如下。
1 資料與方法
1.1 一般資料
收集2017年3月至2021年3月廣西醫科大學第二附屬醫院收治的非霍奇金淋巴瘤和淋巴結增生患者的病理切片標本,均經病理診斷證實。非霍奇金淋巴瘤42例(淋巴瘤組),其中男25例,女17例;年齡20~69歲,中位年齡45歲。淋巴結增生37例(淋巴結增生組),其中男20例,女17例;年齡18~62歲,中位年齡34歲。
1.2 方法
1.2.1免疫組織化學法檢測HIF-1α、HIF-2α和GLUT-1的表達 使用生物組織脫水機完成組織脫水、透明和浸蠟。組織包埋、4μm連續切片和烤片。常規切片脫蠟和抗原修復,用磷酸鹽緩沖液(PBS)沖洗3次,每次3 min。將配制好的3%過氧化氫滴加于切片組織上以阻斷內源性過氧化物酶,室溫孵育15 min,PBS沖洗3次。滴加稀釋的山羊血清,室溫封閉30 min,以減少非特異性染色。滴加稀釋的一抗(HIF-1α 稀釋比1∶200、HIF-2α 稀釋比1∶400、GLUT-1稀釋比1∶500),于4°C冰箱中孵育過夜。PBS沖洗切片3次,每次3 min,滴加酶標鏈霉親和素標記的山羊抗兔/小鼠二抗(稀釋比1∶1 000),37℃孵育30 min。PBS沖洗后每張切片滴加新鮮配制的二氨基聯苯胺(DAB)顯色液,顯微鏡下觀察,陽性信號為棕黃色或棕褐色,用蒸餾水沖洗切片終止顯色。用Harris蘇木素復染2 min,水洗后用1%的鹽酸酒精分化,再用PBS浸洗返藍。然后將切片置于梯度乙醇中脫水,二甲苯中透明,中性樹膠封片。以PBS液代替一抗作為陰性對照。晾干的切片在顯微鏡下觀察,采集圖像。
1.2.2結果判讀 由兩位具有副主任醫師資格的病理學專家雙盲閱片,根據染色強度和陽性細胞數評估HIF-1α、HIF-2α和GLUT-1表達情況。判斷標準:(1)染色強度:無色為0分,淺黃色為1分,棕黃色為2分,棕褐色為3分;(2)陽性細胞數≤10%為0分,11%~50%為1分,51%~79%為2分,≥80%為3分。陽性細胞數得分與染色強度得分相乘即為染色指數(staining index,SI),SI≥3視為陽性。
1.2.3 IPI評分 按年齡、分期、結外病變、體力分級(ECOG評分)、乳酸脫氫酶(LDH)5個指標(Shipp標準)進行IPI評分。本研究將IPI按0~2分(低危、低中危)和3~5分(高中危、高危)分為兩組。
1.3 統計學方法
采用SPSS 20.0軟件進行數據分析,計數資料以百分率(%)表示,兩組間比較采用χ2檢驗或Fisher精確概率檢驗,兩指標間相關性分析采用列聯系數,以P<0.05為差異具有統計學意義。
2 結果
2.1 HIF-1α、HIF-2α 及GLUT-1 蛋白在淋巴瘤和淋巴結增生中的表達
淋巴瘤組HIF-1α、HIF-2α及GLUT-1蛋白陽性表達率均高于淋巴結增生組(P<0.01),見表1、圖1。
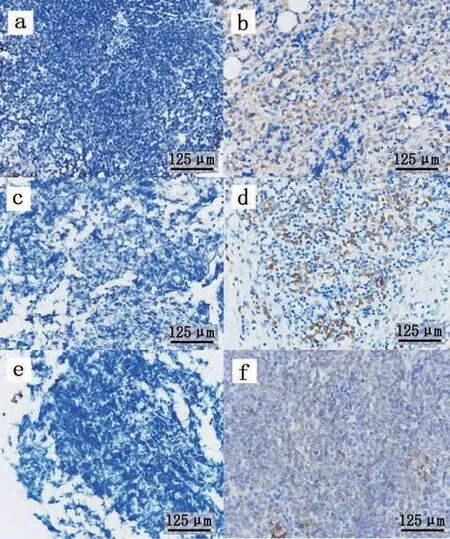
圖1 淋巴瘤和淋巴結增生HIF-1α、HIF-2α及GLUT-1免疫組化染色(SP法,×400)
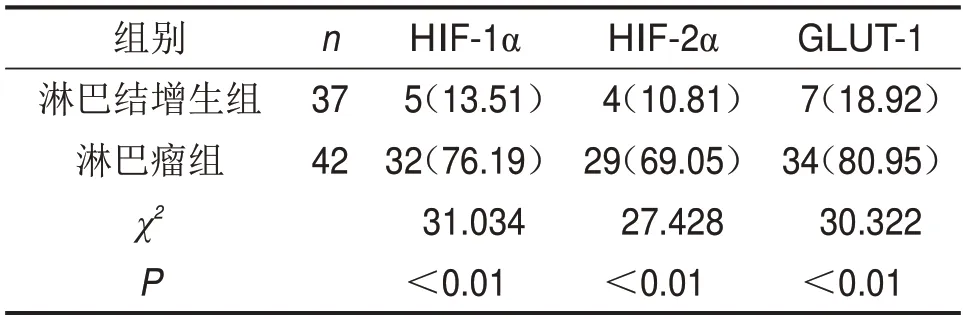
表1 兩組HIF-1α、HIF-2α及GLUT-1蛋白陽性表達率比較 n(%)
2.2 淋巴瘤組織中HIF-1α、HIF-2α及GLUT-1表達之間的相關性分析
淋巴瘤組織中HIF-1α的表達與HIF-2α、GLUT-1的表達呈正相關關系(r=0.593,P<0.05;r=0.583,P<0.05),HIF-2α 的表達與GLUT-1的表達呈正相關關系(r=0.331,P<0.05)。
2.3 淋巴瘤不同IPI分組中HIF-1α、HIF-2α 及GLUT-1蛋白的陽性表達率比較
IPI 3~5分組HIF-1α、HIF-2α及GLUT-1蛋白陽性表達率均高于IPI 0~2分組(均P<0.05),見表2。
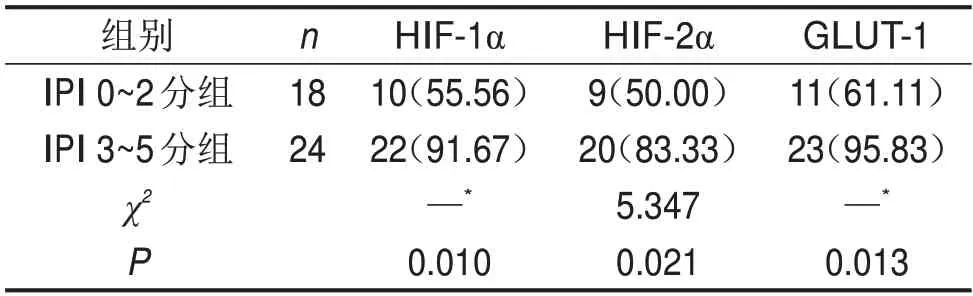
表2 淋巴瘤不同IPI分組中HIF-1α、HIF-2α及GLUT-1蛋白的陽性表達比較 n(%)
2.4 淋巴瘤中HIF-1α、HIF-2α及GLUT-1表達與IPI評分相關性分析
HIF-1α、HIF-2α及GLUT-1的陽性表達與IPI評分均呈正相關關系(0<r<1,P<0.05),HIF-1α、HIF-2α及GLUT-1陽性表達者IPI評分也較高,見表3。
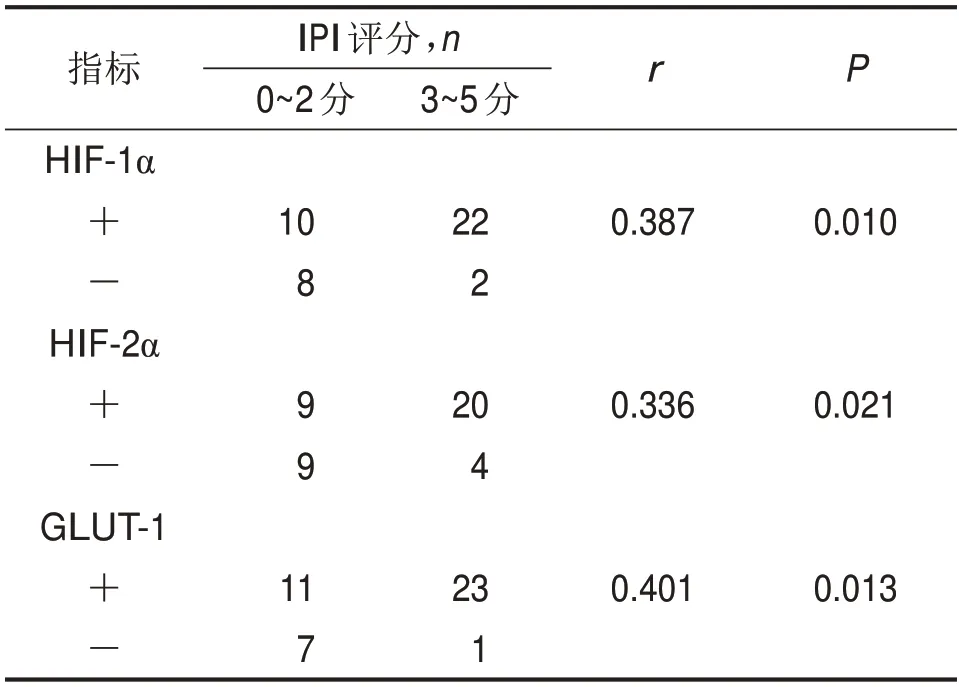
表3 HIF-1α、HIF-2α和GLUT-1的表達與IPI評分的相關性
3 討論
缺氧是許多惡性腫瘤的共同特征,腫瘤細胞對缺氧的適應性反應主要由HIF-1介導,HIF-1由HIF-1α、HIF-2α亞基與HIF-1β亞基共同構成,GLUT-1是HIF-1的靶基因,α亞基是HIF-1的氧調節亞基,β亞基是結構性亞基。常氧狀態下,α 亞基通過泛素化途徑被降解;而在低氧條件下,HIF-1α、HIF-2α降解被抑制,引起這兩者聚集,并與β亞基組成異二聚體發生適形性變化,使HIF-1蛋白與其下游的低氧反應元件發生作用,誘導腫瘤血管生成、改變細胞能量代謝方式等發揮低氧調節能力[1]。目前已有許多研究證實,HIF-1在多種惡性腫瘤組織中呈高表達,并在腫瘤生長、侵襲方面起著重要作用[2-5]。在本研究中,淋巴瘤組HIF-1α、HIF-2α 陽性表達率均顯著高于淋巴結增生組(P<0.05),提示淋巴瘤中HIF-1α、HIF-2α 的表達可能參與淋巴瘤發生、發展過程的調控,并有助于良、惡性淋巴結病變的鑒別。盡管HIF-1α、HIF-2α 均參與缺氧的調節,但兩者擔任角色不同,HIF-1α主要調節缺氧早期及急性期的適應性反應,而腫瘤的長期和慢性缺氧過程中主要由HIF-2α 介導,這說明在不同的缺氧時期,參與調控腫瘤組織缺氧適應的HIF分子不同。有研究顯示,缺氧急性期HIF-1α表達明顯增加,隨著缺氧時間延長,HIF-1α 濃度逐漸下降,而HIF-2α 表達水平逐漸升高[3]。本研究結果顯示,HIF-1α與HIF-2α 表達呈正相關關系,提示兩者在淋巴瘤發生、發展的過程中可能具有協同作用,但明確兩者的動態變化還需要開展更多的臨床研究加以證實。
GLUT-1是分布在細胞膜上的一類跨膜蛋白,是介導葡萄糖進入細胞內的載體,同時也是HIF-1的靶基因。多項文獻表明,惡性腫瘤如頭頸部腫瘤、肺癌、乳腺癌組織中GLUT-1的表達高于正常組織[4-8]。本研究檢測結果也顯示,淋巴瘤組中GLUT-1表達率明顯高于淋巴結增生組,其原因可能是惡性腫瘤組織代謝旺盛,需要攝取更多的能量,糖酵解較正常細胞高。此外,本研究結果還顯示,HIF-1α、HIF-2α與GLUT-1的表達呈正相關關系,與馬宗麗等[9]研究結果一致,證實了兩者之間的協同作用。缺氧條件下,GLUT-1作為HIF-1的靶基因,被激活轉錄,促使糖酵解增加以適應乏氧環境,HIF-1α可通過介導乏氧反應基因的調控而上調GLUT-1的表達[9]。同時,也表明兩者共同參與惡性腫瘤生長過程的調控。
研究表明,在許多實體瘤中,HIF-1α 高表達已被證明與預后較差、轉移風險增加和死亡率升高相關[10-12];也有一些研究顯示,GLUT-1是影響原發性中樞系統淋巴瘤無進展生存期的不利預后因素[13]。IPI是由國際非霍奇金淋巴瘤預后因素協作組于1993年提出的一個淋巴瘤預后判斷模型,國內、外已有研究就IPI的預后意義評價進行補充和完善,以期納入更有效的指標以便更全面地評估非霍奇金淋巴瘤患者的預后[14-16]。本研究結果顯示,IPI 3~5分組HIF-1α、HIF-2α及GLUT-1蛋白的陽性表達率高于0~2分組;且HIF-1α、HIF-2α、GLUT-1的陽性表達與IPI評分呈正相關關系,表明HIF-1α、HIF-2α、GLUT-1可能是非霍奇金淋巴瘤預后不良的高危因素。
綜上所述,HIF-1α、HIF-2α和GLUT-1三者對淋巴瘤的發生、發展過程有著重要的調控作用,檢測HIF-1α、HIF-2α和GLUT-1有助于良、惡性淋巴結病變的鑒別。另外,HIF-1α、HIF-2α、GLUT-1與IPI評分呈正相關關系,三者可能是非霍奇金淋巴瘤預后不良的高危因素,對非霍奇金淋巴瘤高危人群的篩查和評估有一定的臨床意義。三者可否作為非霍奇金淋巴瘤的預后生物指標,還有待擴大樣本量進一步研究。

