番茄SlDNMT2基因的克隆和抗逆性研究
張 玉, 汪宏濤, 劉嘉荔, 劉永勝, 唐曉鳳
(合肥工業大學 食品與生物工程學院,安徽 合肥 230601)
植物在生長發育過程中可能受到一定的生物脅迫與非生物脅迫。生物脅迫主要有植物病毒性感染、蟲害等;非生物脅迫主要包括鹽脅迫、干旱脅迫、熱脅迫、冷脅迫和一些重金屬離子脅迫等。植物響應非生物脅迫發生一系列生理生化反應,以適應不同的環境變化。自然界中較長壽的樹木進化出相應的機制以應對環境的變化,維持正常的生長發育[1-3]。Zn2+離子脅迫可能降低瓢兒菜根部營養物質的積累[4];Mn2+脅迫降低垂穗披堿草幼苗葉片中葉綠素含量的積累,進而對幼苗的生長發育產生影響[5];Fe2+離子脅迫條件下,擬南芥菜和油菜會產生更多的丙二醛,對植物的生長發育產生毒害作用[6]。隨著科技和工業的發展,重金屬離子污染日益加重,對農作物的生長發育產生影響,進而對食品安全產生威脅。因此,關于這些脅迫方面的研究對提高作物產量和食品安全與品質意義重大。
DNA甲基化是一種常見的DNA復制后共價修飾作用,在植物生長發育過程中至關重要[7-8]。植物體內DNA甲基化的水平主要與DNA甲基轉移酶有關,根據結構域的排列形式,其主要可分為4個家族,即甲基轉移酶(methyltransferase,MET1)、染色質域甲基轉移酶(chromomethylase,CMT)、域重排甲基轉移酶(domains rearranged methyltransferase,DRM)、5’端胞嘧啶甲基轉移酶(DNA 5’cytosine methyltransferase2,DNMT2)[9-10]。MET1和CMT最早從擬南芥中克隆,其在植物體器官和組織中均有表達,具有特殊的結構域,主要參與維持胞嘧啶位點的甲基化作用[11];DRM可以分為DRM1和DRM2,主要識別半甲基化或未甲基化的DNA,在DNA甲基化過程中發揮重要作用[12-13]。有研究報道,擬南芥中DNMT2可以與組蛋白去乙酰化酶發生相互作用,并且在冷處理脅迫下,DNMT2的表達量有一定的增加,對生長發育產生影響[13]。擬南芥中DNA甲基轉移酶基因的突變擾亂正常的DNA甲基化過程,不利于植物的生長發育[14]。植物體中DNMT2具有高度保守的結構域,但卻沒有催化活性[13],因此,目前關于植物體內DNA甲基過程中DNMT2的作用機制和功能性的研究較少。
番茄(Solanumlycopersicum)是一年或多年生短日照植物。其含有豐富的碳水化合物、維生素等營養成分,因此具有一定食用價值;此外,番茄中含有番茄紅素、類黃酮等物質,具有抗氧化作用,因此其還具有一定藥用價值[15-17]。目前番茄廣泛種植于中國南北方,在我國果蔬供應方面影響深遠[18]。
本文以模式植物番茄為實驗材料,分析DNA甲基轉移酶SlDNMT2基因的表達模式;通過生物信息學技術,分析SlDNMT2蛋白的生物學進化關系;利用煙草瞬時表達系統,分析SlDNMT2蛋白的亞細胞定位情況;并成功構建植物RNAi表達載體,利用農桿菌介導的侵染法轉化野生型番茄,得到番茄轉基因RNAi植株;進一步探究不同非生物脅迫條件對轉基因RNAi植株和野生型植株的影響作用。本文為進一步分析SlDNMT2基因在DNA甲基化過程中的功能作用奠定了基礎,對研究植物體內DNA甲基轉移酶DNMT2基因作用的分子機制具有重要作用。
1 材料與方法
1.1 實驗材料
1.1.1 植物材料
野生型(AC)番茄植物(SolanumlycopersicumMill. cv. Aillsa Craig)來自美國康奈爾大學THOMPSON植物研究所,由本實驗室繁殖保存;煙草(NicotianatabacumL.)來自美國康奈爾大學THOMPSON植物研究所,由本實驗室繁育保存。
1.1.2 菌株和質粒
大腸桿菌DH5α(EscheriachiacoliDH5α)、根癌農桿菌GV2260(AgrobacteriumtumefaciensGV2260)、根癌農桿菌EHAl05(AgrobacteriumtumefaciensEHAl05)、亞細胞定位表達載體pART-27GFP及植物表達載體pBI121均保存于本實驗室-80 ℃冰箱。
1.1.3 分子生物學試劑
RNA提取試劑 (Invitrogen公司);反轉錄試劑盒(5X All-In-One RT Master Mix)、質粒提取試劑盒(Easy Pure Plasmid Mini Prep Kit)),(TOYOBO公司);瓊脂糖膠回收試劑盒(Easy Pure Quick Gel Extraction Kit,Omega公司)高保真DNA聚合酶Primer Star、DNA聚合酶、限制性內切酶、T4 DNA Ligase (TaKaRa公司);聚合酶鏈式反應(polymerase chain reaction,PCR)引物和測序(上海生工技術有限公司)。
1.2 方法
1.2.1SlDNMT2目的基因的克隆
根據番茄SlDNMT2基因序列設計2對引物。第1對特異性引物信息具體為:
DNMT2-F 5’CGGTTGTTTGCTTGCGTCT3’,
DNMT2-R 5’CTTGTGCAGATGGAGCTTCAG3’;
第2對特異性引物信息具體為:
DNMT2-F1 5’ATGGAATCGGAAGTTTCTAGA3’,
DNMT2-R1 5’TCATGAATGGTTGATGAAGAGATATT3’。
利用PCR技術,獲得SlDNMT2基因編碼區序列。本文為了增加PCR產物的特異性,使用2對引物,通過巢式PCR進行2輪擴增,如圖1所示,黑色箭頭所指位置為起始密碼子(ATG)和終止密碼子(TGA),第1對引物位于目的基因的非編碼區,然后以第1輪產物為模板,使用第2對引物進行巢式PCR第2輪擴增。PCR反應程序為: 94 ℃、2 min,94 ℃、20 s,58 ℃、20 s,72 ℃、2 min,72 ℃、5 min,30個循環。PCR產物經瓊脂糖膠回收試劑盒膠回收,并與克隆載體pEASY-Blunt Simple Cloning Vector連接,轉化大腸桿菌DH5α感受態細胞,菌落PCR陽性鑒定,送上海生工技術有限公司測序。

圖1 巢式PCR引物位置示意圖
1.2.2SlDNMT2的組織特異性表達分析
利用RNA提取試劑,分別從野生型番茄植株幼苗不同發育時期的根、莖、葉、花、果實中提取植物總RNA,樣品取樣質量為100 mg,經反轉錄試劑盒反轉錄獲得SlDNMT2的cDNA序列。以cDNA為模板,以番茄UBI3基因(GenBank登錄號為X58253)為內參,通過實時熒光定量PCR(real-time quantitative PCR,RT-qPCR)技術分析不同植物組織中SlDNMT2基因的表達情況。
1.2.3 SlDNMT2蛋白的亞細胞定位
經限制性內切酶酶切、T4 DNA Ligase 連接、轉化及菌落PCR陽性鑒定等生物化學與分子生物學實驗方法,將目的基因SlDNMT2的CDS序列構建至pART-27GFP表達載體,載體構建過程中所用引物見表1所列。

表1 本研究中所用的引物
pART-27GFP為本實驗保存的亞細胞定位載體,含有強綠色熒光蛋白(eGFP),在激光共聚焦顯微鏡下可觀察到強烈的綠色熒光。利用農桿菌介導的煙草瞬時表達系統,獲得目的基因SlDNMT2融合表達載體,命名為pART-27-35S::SlDNMT2-eGFP。
轉化根癌農桿菌GV2260,菌落PCR陽性鑒定,獲得陽性菌菌樣于28 ℃搖床培養18 h,轉接至新培養基培養6~8 h,加入誘導液1在28 ℃搖床中培養12 h,暗處理10 min,誘導液2處理,注射煙草葉片,放置36~48 h后,撕取煙草葉片表皮細胞,在激光共聚焦顯微鏡下觀察。誘導液1、誘導液2、AB鹽溶液、IM溶液配制方法如下。
誘導液1(20 mL):1 mL AB鹽溶液、19 mL IM溶液、ACE溶液(39 mg/mL、稀釋1 000倍)、Kana溶液(50 mg/mL、稀釋1 000倍);
誘導液2(20 mL):1 mL MES溶液(0.20 mol/L、稀釋20倍)、19 mL無菌水、ACE溶液(39 mg/mL、稀釋1 000倍);
AB鹽溶液(1 L):適量無菌水中加入20.00 gNaCl、3.00 g KCl、0.05 g FeSO4、0.60 g MgSO4· 7H2O;另取一容器,加入3.00 g CaCl2·2H2O,加入適量無菌水,將 CaCl2溶液緩慢倒入上一溶液中,定容至1 L,4 ℃保存;
IM溶液(1 L):適量無菌水中加入9.76 g MES、5.00 g葡萄糖、0.25 g NaH2PO4,玻璃棒攪拌溶解后,定容至1 L,滅菌,4 ℃保存。
1.2.4SlDNMT2基因RNAi表達載體的構建
本文選擇pBI121載體作為番茄植物表達載體,限制性內切酶處理pSK-SlDNMT2 RNAi陽性菌重組質粒和pBI121空載質粒,經膠回收試劑盒回收SlDNMT2基因RNAi特異性片段,T4 DNA Ligase 4 ℃過夜連接,轉化大腸桿菌DH5α感受態細胞,經陽性菌鑒定、發夾結構的驗證等實驗,送上海生工技術有限公司測序正確,最終獲得番茄植株SlDNMT2基因RNAi表達載體。本文中構建RNAi表達載體所需引物及其酶切位點見表1所列。
1.2.5 番茄植株的遺傳轉化
利用根癌農桿菌EHA105介導的浸染法,將上述構建成功的重組質粒轉化至本實驗室保存的野生型番茄植株。利用植物組織培養技術,預培養、共培養、篩選培養,最終獲得轉基因番茄植株。根據pBI121載體中的卡那霉素抗性基因NPTⅡ(GenBank登錄號為AF485783)和菌落PCR技術,進行DNA水平陽性篩選,DNA水平陽性鑒定所用到的引物為:
NPTⅡ-F 5’AGACAATCGGCTGCTCTGAT3’,
NPTⅡ-R 5’TCATTTCGAACCCCAGAGTC3’。
此外,提取轉基因RNAi植株總RNA,反轉錄獲得cDNA,Step One Real-time PCR儀定量分析,進行RNA水平陽性鑒定,結果如圖2所示,定量PCR相關引物見表1所列。圖2中,1~6表示通過菌數PCR鑒定得到的轉基因陽性樣品。結果表明轉基因植株在DNA和RNA水平均為陽性。
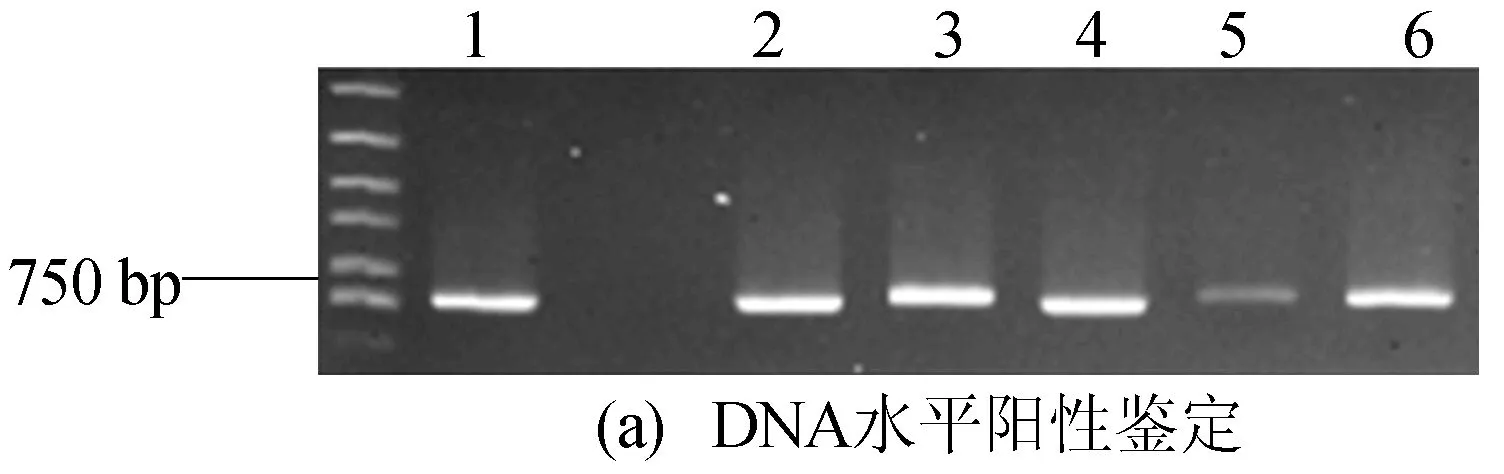
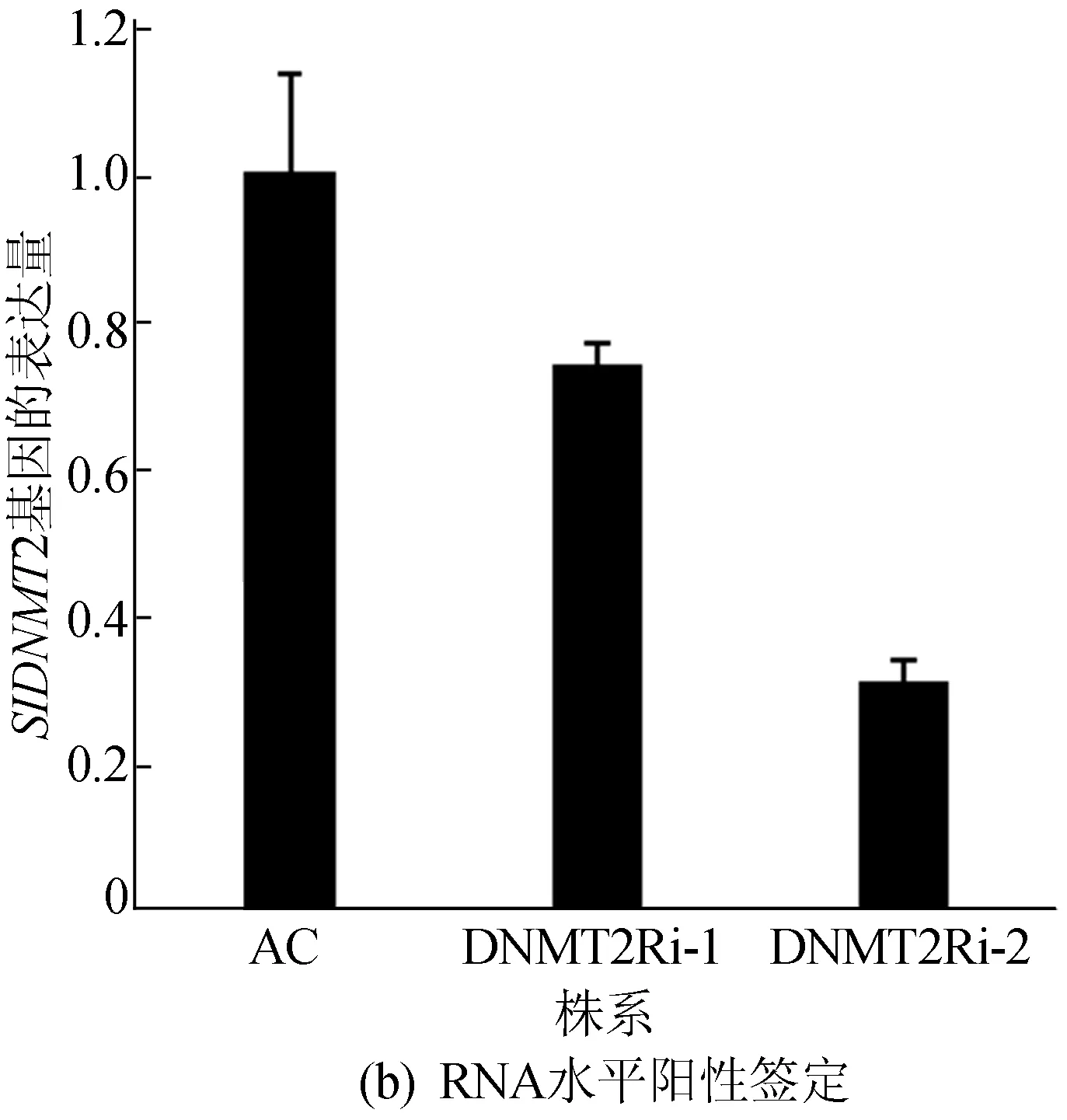
圖2 轉基因RNAi植株的陽性鑒定結果
1.2.6 二價重金屬離子脅迫條件下的表型分析
為了探究轉基因RNAi番茄植株在重金屬離子脅迫條件下的生長發育情況,本文將初始生長狀態一致的野生型(AC)與轉基因RNAi植株,分別移植到1/2MS培養板、含300 μmol/L Fe2+的1/2 MS培養基、含300 μmol/L Zn2+的1/2 MS培養基、含300 μmol/L Mn2+的1/2 MS培養基中,垂直放置于培養架,置于22 ℃培養室生長7 d,記錄不同處理條件下植株的表型。
2 結果與分析
2.1 SlDNMT2基因的生物信息學分析
TAIR擬南芥數據庫中搜索獲得擬南芥AtDNMT2基因序列,利用美國國家生物技術信息中心數據庫(National Center for Biotechnology Information,NCBI)Blast獲得番茄植株中同源基因SlDNMT2序列,進而獲得不同物種中該基因編碼的氨基酸序列。利用DNAMAN軟件分析不同物種DNMT2蛋白保守域,如圖3所示。
此外,利用PFAM網站分析不同物種DNMT2基因氨基酸序列,并通過ClustalX和MEGA7.0軟件分析,繪制不同物種DNMT2蛋白結構域和系統進化樹,如圖4所示。結果表明,番茄SlDNMT2與馬鈴薯StDNMT2的親緣關系較近,同源性高達95.54%;番茄SlDNMT2與擬南芥AtDNMT2親緣關系較遠。
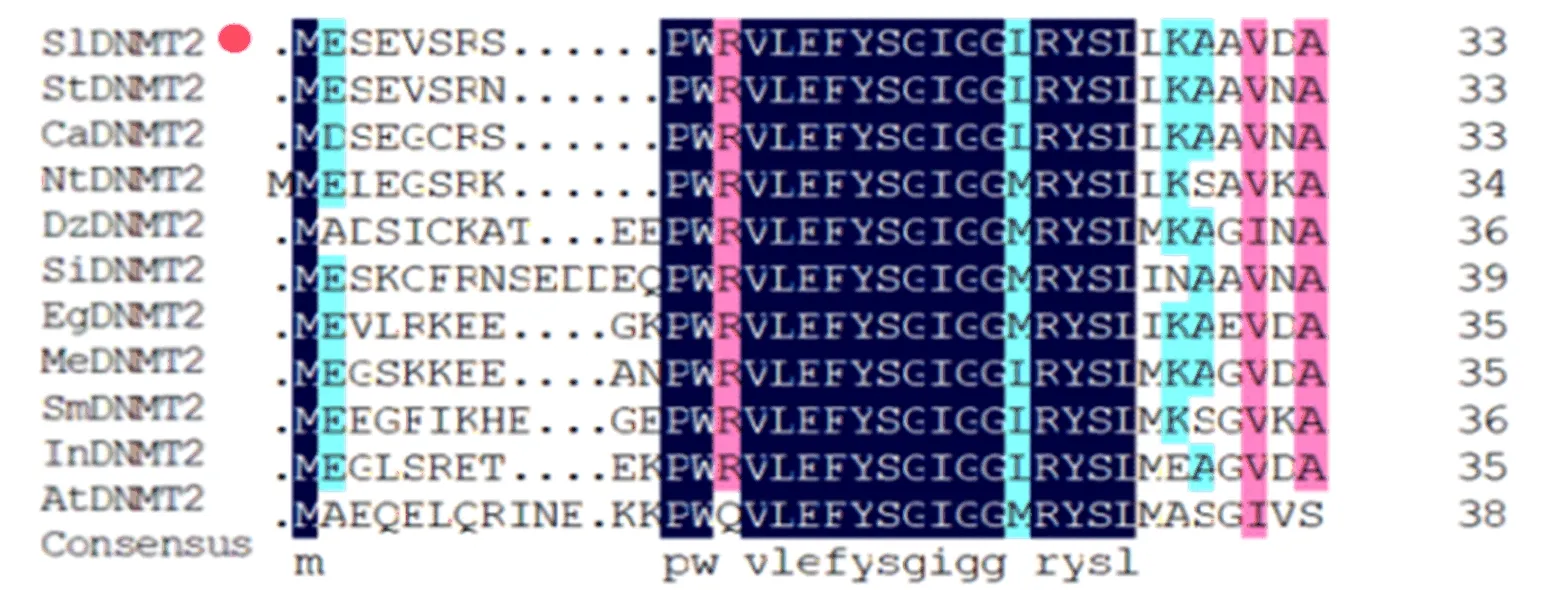

圖3 不同物種DNMT2蛋白保守域

圖4 DNMT2進化樹分析和結構域分析
2.2 SlDNMT2基因cDNA序列克隆
以cDNA作為模板,DNMT2-F、DNMT2-R、DNMT2-F1、DNMT2-R1為引物,巢式PCR擴增得到SlDNMT2基因產物,經0.8%瓊脂糖凝膠電泳進行檢測,結果如圖5所示。根據電泳條帶的大小,判斷SlDNMT2目的基因片段的正確性,并送公司測序,經DNAMAN軟件比對,測序結果正確。

圖5 SlDNMT2目的基因片段
2.3 SlDNMT2蛋白的亞細胞定位分析
利用農桿菌介導的轉化法,將目的基因SlDNMT2轉化至根癌農桿菌GV2260感受態細胞,獲得pART-27-35S::SlDNMT2-eGFP融合表達載體。注射煙草,在激光共聚焦顯微鏡下觀察,結果如6所示。用DAPI染液對細胞核染色可確定細胞核位置,由MERGE混合圖像可確定SlDNMT2蛋白定位在細胞核中。
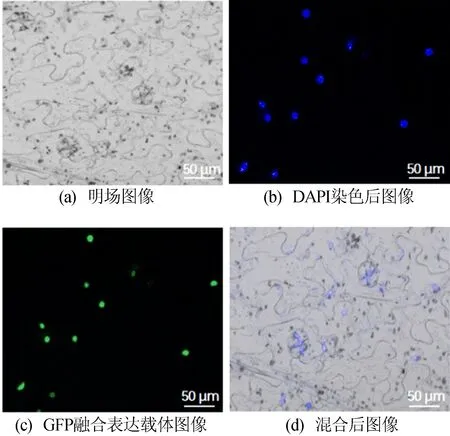
圖6 SlDNMT2蛋白亞細胞定位
2.4 SlDNMT2基因表達的組織特異性分析
Trizol試劑法提取番茄植株不同組織、不同發育時期的果皮中總RNA,反轉錄獲得cDNA,RT-qPCR分析番茄SlDNMT2基因在番茄植株不同組織中表達量的差異,結果如圖7所示。
圖7中,IG1代表授粉后7 d果實;IG2代表授粉后14 d果實; MG代表授粉后35 d果實;Br代表果實變色期;RR代表果實成熟期;Rt代表根;Stem代表莖;L代表葉片;F代表花。結果表明SlDNMT2基因在番茄植株不同發育時期的各組織中均有表達,IG時期果實中SlDNMT2表達量較低,葉片(L)和花(F)中SlDNMT2表達量較高。
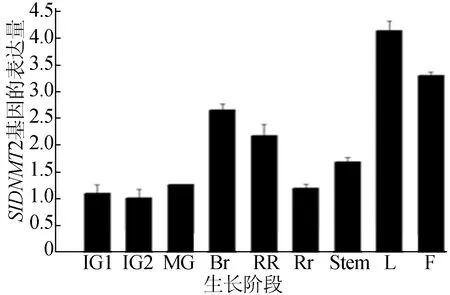
圖7 SlDNMT2基因的表達模式分析
2.5 轉基因植株在脅迫下的表型分析
在不同處理條件下,轉基因RNAi和野生型植株的表型有一定差異,如圖8所示。
由圖8可知,在1/2 MS、300 μmol/L Mn2+、300 μmol/L Fe2+培養條件下,野生型和轉基因RNAi植物生長狀態沒有顯著差異;但是,在300 μmol/L Zn2+培養條件下,野生型植株比RNAi植物的生長發育狀態較好。
利用ImageJ軟件測量植株高度和SPSS18軟件分析數據,結果如圖9、圖10所示。
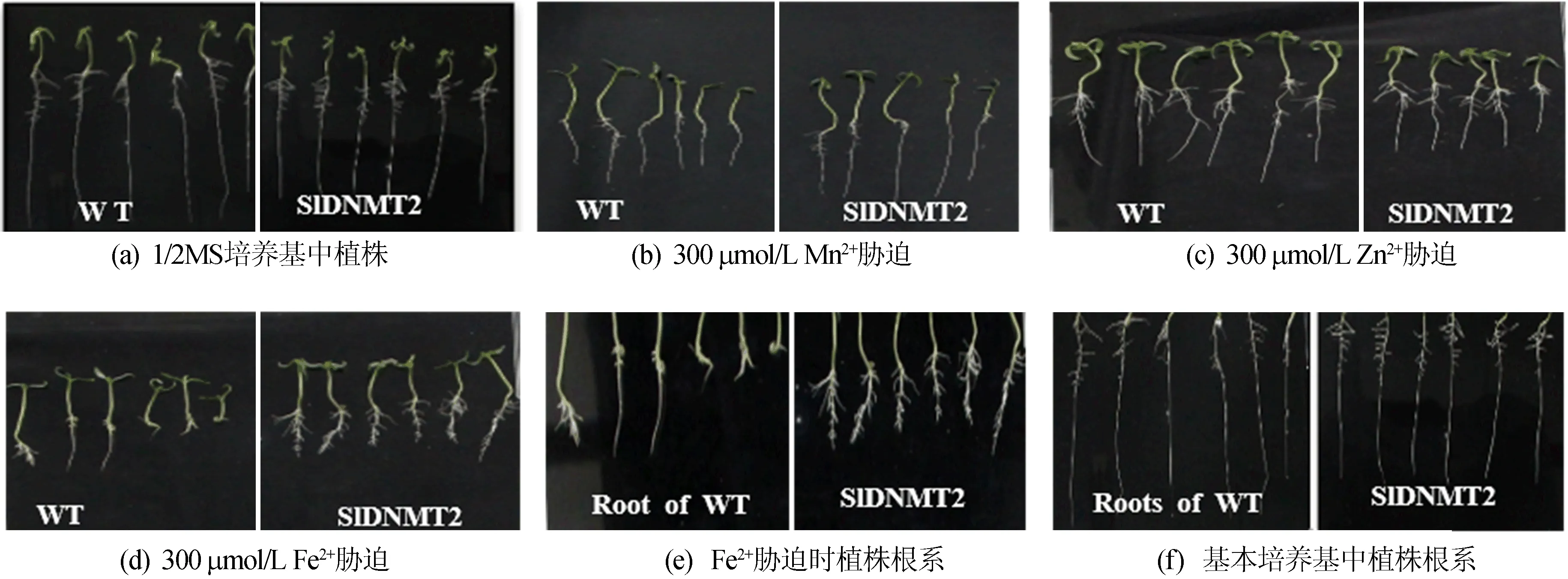
圖8 重金屬離子脅迫下的表型分析
從圖9可以看出,300 μmol/L Zn2+條件下,野生型植株的高度比RNAi植物更長,且差異具有顯著性。但是,1/2 MS、300 μmol/L Mn2+、300 μmol/L Fe2+培養條件下生長的植株高度并沒有顯著性差異。
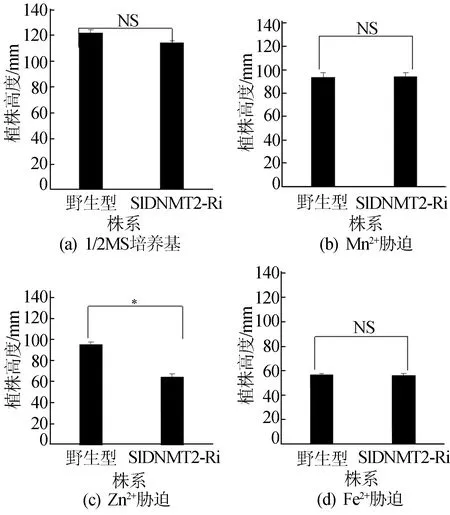
圖9 植株的高度統計結果
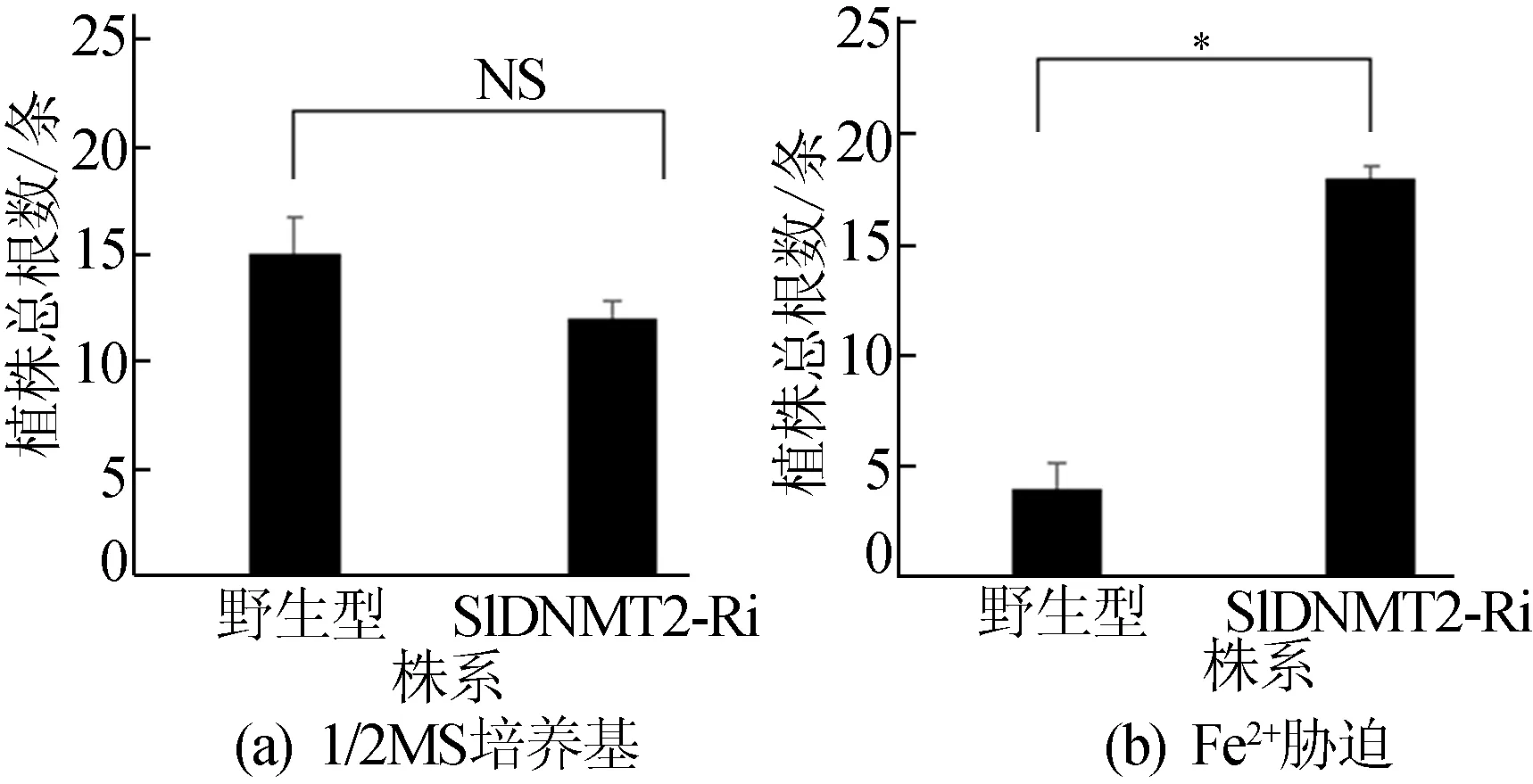
圖10 植株根總數量統計
由圖8e、圖8f、圖10可知,在1/2 MS培養基中,轉基因和野生型植株根生長情況和根的總數量沒有顯著性差異;但是,300 μmol/L Fe2+處理時,轉基因RNAi植物的根系比野生型更發達,統計根數量,差異具有顯著性。以上結果表明當外源添加300 μmol/L Zn2+離子時,SlDNMT2可能參與正調控作用;當外源添加300 μmol/L Fe2+時,SlDNMT2可能參與負調控網絡途徑而發揮作用。
3 討 論
植物通過DNA甲基化修飾作用調節相關基因表達,與植物生長發育、衰老、死亡密切相關。SlDNMT2是植物甲基化作用中的關鍵基因,本文通過基因差異表達分析實驗,發現SlDNMT2基因在植物生長發育的9個重要時期均有表達,并且在葉和花時期表達量較高,說明SlDNMT2基因可能參與調節植物葉片和花器官的生長發育。
不同的脅迫處理會影響植物DNA甲基化水平的變化,在植物中,重金屬離子脅迫使小麥、水稻葉片中DNA甲基化水平升高[19]。重金屬離子脅迫處理可能影響三葉草植物中DNA甲基化的水平[20]。以上研究結果表明,DNA甲基化作用可能參與植物應對重金屬離子脅迫應答途徑。
4 結 論
本文通過分子克隆獲得番茄植株SlDNMT2基因,該基因是合成DNA甲基化作用中關鍵酶的重要組成部分。通過遺傳轉化成功獲得轉基因RNAi植株,并發現300 μmol/L Zn2+脅迫對轉基因RNAi植物影響作用比野生型更加顯著。結果表明,SlDNMT2基因可能參與番茄植株對非生物脅迫(重金屬離子脅迫)的響應途徑。300 μmol/L Zn2+離子存在時,SlDNMT2基因可能參與正調控網絡途徑;而300 μmol/L Fe2+離子存在時,SlDNMT2基因可能參與負調控網絡途徑,因此,轉基因植株對300 μmol/L Fe2+抗性更大。然而,在植物生長發育過程中,SlDNMT2基因調節植物細胞進行脅迫應答反應的機制及其在脅迫應答信號轉導途徑中的調控機制等問題仍需進一步研究。

