PCR儀溫度過沖特性有限元仿真研究
張 辰, 孫繼賢, 梁曉會, 魏名山, 田 冉,江 斌, 李 征, 范志永
(1. 軍事科學院軍事醫學研究院科研保障中心,北京 100850; 2. 北京理工大學機械與車輛學院,北京 100081;3. 北京林電偉業電子技術有限公司,北京 100097; 4. 公安部第一研究所,北京 102200)
0 引 言
聚合酶鏈式反應是一種體外擴增特定DNA片段的分子生物學技術[1-2]。PCR的基本步驟分為3步:變性(95 ℃)、退火(55 ℃)和延伸(72 ℃)[3]。經過3個步驟的不斷循環,PCR技術可以將微量的DNA片段擴增至初始的數百萬倍。因具有特異性強、靈敏度高、操作簡便快速、純度要求低等特點,PCR技術在生物學、醫學等領域具有廣泛的應用[4-5]。
PCR儀是實施PCR技術的設備載體[6]。它通過控制半導體制冷片(thermal electric cooler,TEC)的輸入電流,實現TEC周期性吸熱與放熱,令反應樣品溫度達到PCR步驟所需溫度并保持一段時間,從而保證3個擴增反應步驟的循環[7]。在實際過程中,針對TEC的控制大多基于PID調節,故在升/降溫的終止時刻,常常出現溫度控制超調現象,亦稱為溫度過沖現象[8]。有限的溫度過沖有利于試液的快速變溫,而過量的溫度過沖會導致試液中聚合酶失活等嚴重后果[9]。由此可見,PCR儀的溫度過沖特性對DNA片段擴增效果有重要影響。
目前針對PCR儀的研究大多集中在溫度控制算法方面,有關其傳熱特性僅有少數學者開展過研究。黃靖等[10-11]運用ABAQUS有限元軟件仿真研究了TEC匹配差異、導熱膠厚度不均和四周空氣對流散熱3種因素對96孔PCR儀溫度均勻性的影響。其結論表明,通過匹配TEC、采取隔熱或熱補償的措施,可以有效改善PCR儀96孔基座的溫度均勻性。毛賀[12]運用數學插值方法對基座孔和試液的溫度時變曲線進行六次多項式擬合,對試液溫度延遲現象進行了數學描述,以預估某PCR儀反映試液的升/降溫情況。然而,對PCR儀溫度過沖現象的研究卻鮮有報道。
本文針對PCR儀反應試液溫度難以估計的問題,分析了某型號PCR儀熱循環系統的結構及傳熱機理,構建了PCR儀單孔仿真模型,探究了在50 μL試液量下溫度過沖特性對試液溫度的影響規律。在此基礎上,分析了在不同試液量下(10,20,25,50,100 μL)PCR反應試液溫度的差異性,為PCR儀的設計及優化提供研究基礎。
1 PCR儀熱循環系統結構
典型的PCR儀熱循環系統如圖1所示。系統由6片基于帕爾貼效應的TEC串聯連接,實現溫度升降[13]。系統的溫控對象為TEC上方的96(8×12)孔紫銅基座以及反應試液。基座上等距布有直徑為5.5 mm的深孔,以供裝有反應試液的試管嵌入其中。孔間挖有一定深度的凹槽單元,以減小基座的熱容,提高溫變響應速率。試管上端與恒溫105 ℃的熱蓋相接觸,避免了高溫蒸發后的試液冷凝于試管頂部。TEC下端為散熱器,上下兩端接觸面均涂有0.05 mm厚的導熱硅脂。散熱器下方安裝有冷卻風扇,以對散熱器進行強制對流換熱。
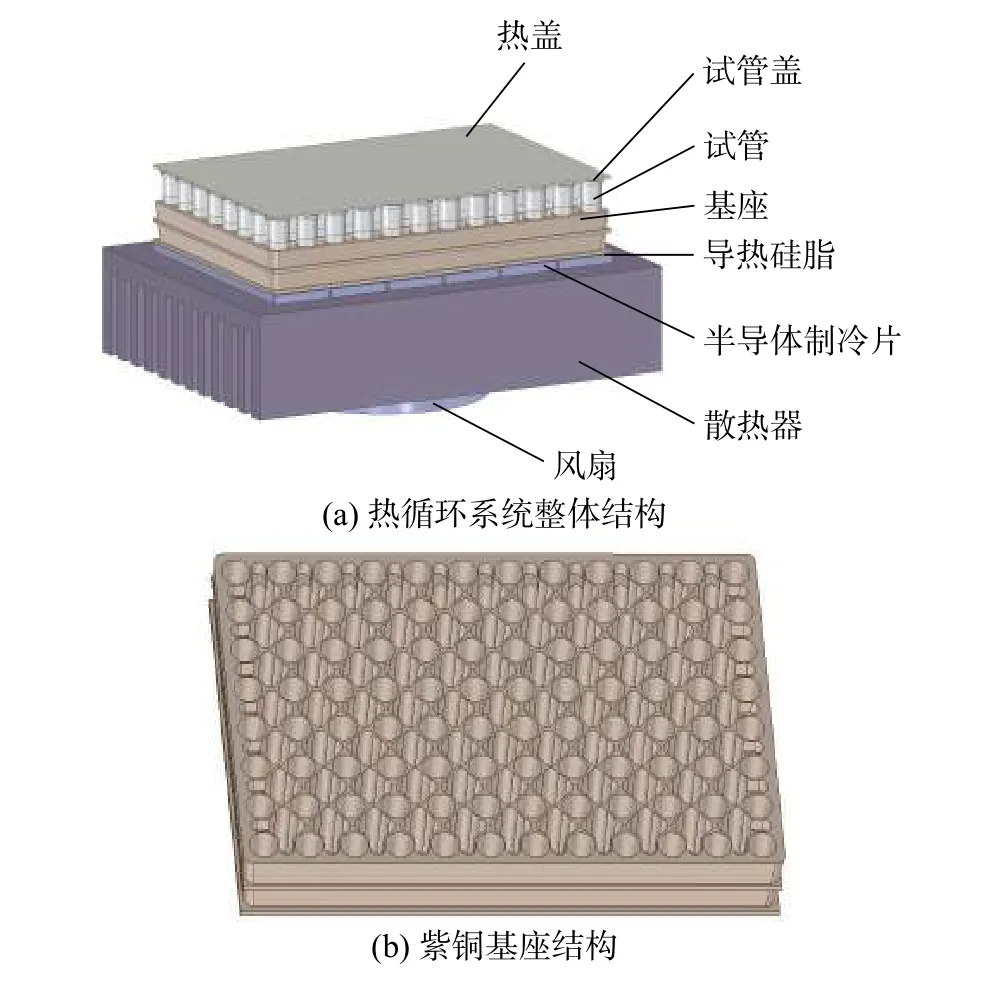
圖1 PCR儀熱循環系統結構示意圖
2 PCR儀傳熱機理及數學模型
PCR儀熱循環系統主要依靠熱傳導實現其功用。TEC上表面吸收或釋放熱量給導熱硅脂薄層,之后熱量傳至金屬基座,基座再將熱量傳遞至試管,進而傳遞至反應試液。試管頂部的熱蓋在PCR反應過程中一直維持較高溫度,但因試管導熱系數很小,其對試液溫度的影響可以忽略。此外,試管與基座之間存在狹小空氣間隙,會對熱傳遞起到阻礙作用,將其等效為接觸熱阻[14]。這些熱傳導過程均可用無內熱源的非穩態導熱微分方程進行描述[15]:
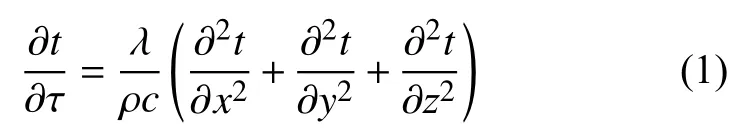
式中:λ——微元體導熱系數,W/(m·K);
ρ——微元體密度,kg/m3;
c——微元體比熱容,J/(kg·K)。
TEC在升/降溫時釋放/吸收的熱量值可分別用下式描述[16]:

式中:Qh/Qc——升/降溫時TEC釋放/吸收的熱量值,J;
th/tc? 升/降溫時TEC與基座接觸面的溫度值,K;
αn/αp——TEC中N、P型半導體的塞貝克系數;
I——工作時通過TEC的電流值,A;
λ——TEC 導熱系數,W/(m·K);
Δt——冷熱面溫差,K。
基座四周以及各試管間均存在較大的空氣間隙,從而受到空氣自然對流換熱的影響。這一影響因素屬于加載第三類邊界條件的非穩態導熱,可用下式進行描述:

式中:h ——流體的對流換熱系數,W/(m2·K);
tw——壁面溫度,K;
tf——流體溫度,K。
3 PCR儀仿真方法及試驗驗證
3.1 仿真模型的建立
PCR儀熱循環模塊幾何模型復雜,適合采用有限元數值方法進行研究。雖然PCR儀基座各孔存在一定的溫差,但由于其溫差較小,各孔之間的熱傳導可以忽略。所以,為簡化仿真難度并集中研究溫度過沖特性的影響,本文假設基座各孔溫度均勻,僅針對單孔的反應模型進行研究,如圖2所示。其中,試管內反應試液為50 μL,其余幾何結構與整體熱循環系統結構保持一致。采用ANSYS-Meshing對幾何模型和反應試液進行網格劃分,全局網格尺寸設置為0.4 mm,空氣及試液區域網格設置為0.8 mm,以減小總體網格數量。網格類型均為四面體網格。劃分網格之后的節點數為33385,網格數為115642,反映網格質量的skewness值最大為0.709,平均為0.241,網格質量良好。網格劃分結果如圖3所示。

圖2 PCR儀單孔三維模型及結構示意圖

圖3 單孔模型網格劃分
本文采用Fluent軟件完成相關數值計算。針對PCR儀瞬態傳熱問題,采用瞬態求解器,并激活能量方程。各區域材料對應的熱物性參數如表1所示。單孔模型忽略了不同孔之間的溫差以及基座四周空氣對流換熱對模型的影響,進而可以只考慮下邊界TEC和上邊界熱蓋,將其他邊界設置為絕熱壁面。 PCR單孔模型的上下表面分別與熱蓋、TEC直接接觸。根據儀器特性,上表面溫度邊界設為105 ℃,并保持恒定,同時依照規范 JJF 1527—2015中PCR儀溫度控制程序標準程序表的前3個步驟(表2)設計具有不同溫度過沖量的溫度控制曲線作為下表面的溫度邊界條件。此外,在基座與試管之間設置厚度為0.5 mm的空氣層,模擬微小氣隙。因反應試液的量少且受熱較均勻,監測試液的平均溫度作為試液的參考溫度。設置模型初始溫度為30 ℃,求解時間步長為 0.1 s,最大迭代步為 40。

表1 單孔模型各區域的熱物性參數

表2 PCR儀溫控程序標準程序表(部分)
3.2 數值方法準確性驗證
為了驗證PCR儀單孔三維仿真數值方法的準確性,進行PCR儀試液單孔測溫實驗。同時,構建PCR儀單孔傳熱一維模型,與三維仿真結果進行對比驗證。
對于測溫實驗(圖4),選擇經校準后的日本S3熱敏電阻作為測溫傳感器置于試管內,該傳感器直徑為 1.3 mm,測溫范圍為–30~150 ℃,測量精度為0.01 ℃,動態響應時間為321 ms。將熱敏電阻連接溫度記錄器,并進行多點修正,經校準后試驗裝置最大誤差為0.03 ℃,滿足實驗要求。

圖4 PCR儀試液測溫實驗裝置
采用AMESim軟件構建PCR儀單孔傳熱一維仿真模型,如圖5所示。一維模型對各部分物體的幾何特征進行了簡化。除此之外,包括熱物性在內的其他參數設置和三維模型保持一致。

圖5 PCR儀單孔傳熱一維模型
所測PCR儀設備的平均升溫速率為2.22 ℃/s,平均降溫速率為1.18 ℃/s,曲線的升/降溫梯度程序為 30 ℃—95 ℃—30 ℃,升溫平臺期維持 180 s,與表 2保持一致。通過測溫傳感器測得試液溫度的變化規律。同時,將設備的實際溫控曲線作為溫度邊界條件加載至三維模型下表面與一維模型熱源處,仿真求解獲得試液溫度。圖6為實驗與仿真得到的試液溫度變化對比結果。

圖6 試液溫度變化對比曲線
由圖可知,仿真的溫度監測點位置與實驗溫度傳感器放置位置保持相同的情況下,加載同一溫控曲線時,三維仿真得到的試液溫度較一維仿真更貼合于實驗結果。一維仿真不能表征復雜的三維幾何結構,是導致仿真誤差增大的主要原因。由此證明三維仿真方法更可靠,且可以基于此三維模型進行溫度過沖的進一步研究。
4 溫度過沖量對試液溫度影響分析
依據表2的程序以及設備的平均升/降溫速率,設計不同升/降溫過沖量的TEC溫度控制曲線(圖7)。其中,曲線T0至T5表示溫度過沖量的范圍從0 ℃依次增加到5 ℃,溫度間隔為1 ℃。
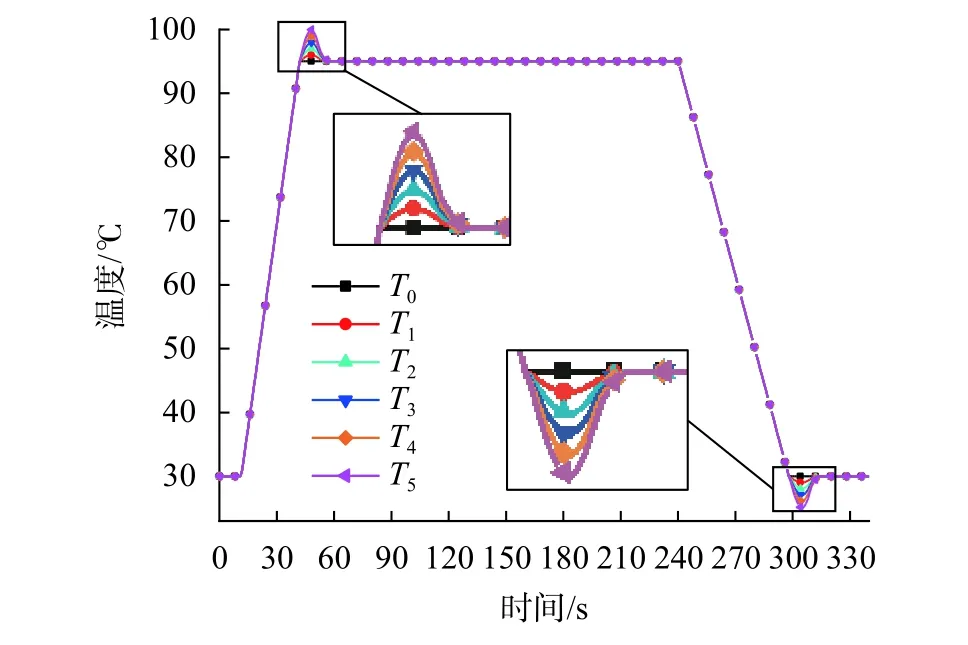
圖7 不同溫度過沖量的溫度控制曲線
圖8為T0~T5六種溫度輸入下試液平均溫度經升/降溫后首次到達平臺期溫度±0.5 ℃時所需時間趨勢線。其中縱坐標時間從開始升溫與降溫時刻算起。由圖可知,隨著溫度過沖量由0 ℃增加至5 ℃,試液的升/降溫所需時間分別縮短了13.7 s與10.7 s。此外,在試液從沒有過沖調整至過沖1 ℃時,試液升溫時間縮短了 4.3 s,降溫時間縮短了 4.6 s;若將過沖4 ℃調整至過沖5 ℃,試液升溫時間縮短了1.4 s,降溫時間則只縮短了0.5 s。由此說明增加溫度過沖量與縮短試液升/降溫時間之間的關系并不是線性的,試液升/降溫時間的改善效果會隨著溫度過沖量的增大而不斷減小。

圖8 試液升/降溫所需時間曲線
圖9反映了試液升/降溫過沖量隨T0~T5六種溫度輸入的變化規律,其中縱坐標代表不同的溫度過沖量。由圖可知,對于50 μL 試液量,溫控曲線升溫過沖不大于3 ℃,降溫過沖不大于1 ℃時,試液不會出現溫度過沖現象。此時對試液來說只是增加了升/降溫速率,是較為理想的情況。當溫控曲線過沖量大于3 ℃時,試液升溫與降溫均會出現較小的溫度過沖,這可能導致試液中聚合酶高溫失活,嚴重影響基因擴增循環,是需要避免的。此外,試液降溫時的溫度過沖現象比升溫時更顯著,原因是TEC的制冷速率慢于制熱速率。這會導致試液降溫所需時間變長,從而受冷更充分,易產生溫度過沖。

圖9 不同溫度輸入對試液溫度過沖量的影響
5 不同試液量的溫度差異性分析
為了探究PCR試管內反應試液量對試液平均溫度變化的影響,選取 10,20,25,50,100 μL 5種不同試液量,對仿真模型下表面分別加載圖7中的T0溫控曲線(無過沖)和T3溫控曲線(最大過沖量為3 ℃),觀察試液溫度的變化情況。
圖10為不同試液量下的試液升/降溫時間曲線。由圖可知,對于各試液量而言,溫度過沖均會縮短其升/降溫所需時間,進而延長試液的實際平臺期,有利于擴增反應的充分進行。無論儀器是否存在溫度過沖的情況,隨著試液量的不斷增加,試液升/降溫所需時間均會不斷增加。以無溫度過沖情況為例,在10 μL 試液量下,試液升/降溫分別需要 45 s和 68 s,而在 100 μL 下則分別需要 63.6 s和 84.5 s,與前者相差18.6 s和16.5 s。這說明在同一溫控曲線下,試液量越多,試液實際平臺期的持續時間就會越短,這可能會導致試液進行反應的實際時間不足。
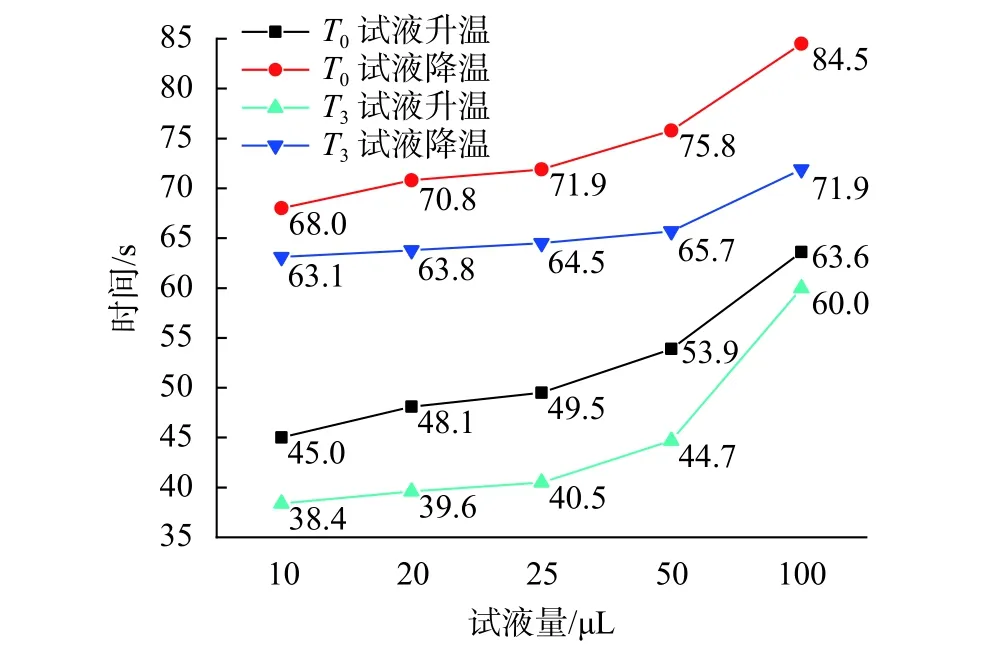
圖10 不同試液量的試液升/降溫時間曲線
圖11為不同試液量的試液升/降溫過沖量趨勢線。由圖可知,在加載相同溫度過沖量的溫控曲線時,不同試液量的試液會產生不同程度的溫度過沖。以溫度過沖量為 3 ℃ 的 T3曲線為例,10 μL 試液量在這一曲線下產生了1.09 ℃的升溫過沖量和1.67 ℃的降溫過沖量,而相同條件下100 μL 試液量的升溫與降溫均沒有出現溫度過沖現象。從實際應用角度出發,針對PCR儀一般具有的block溫控(無溫度過沖)和tube溫控(存在溫度過沖)兩種溫控模式,建議儀器在反應試液量低于50 μL時采用block溫控模式,50 μL及以上時采用tube溫控模式,且tube溫控模式下的最大溫度過沖量不應超過3 ℃。
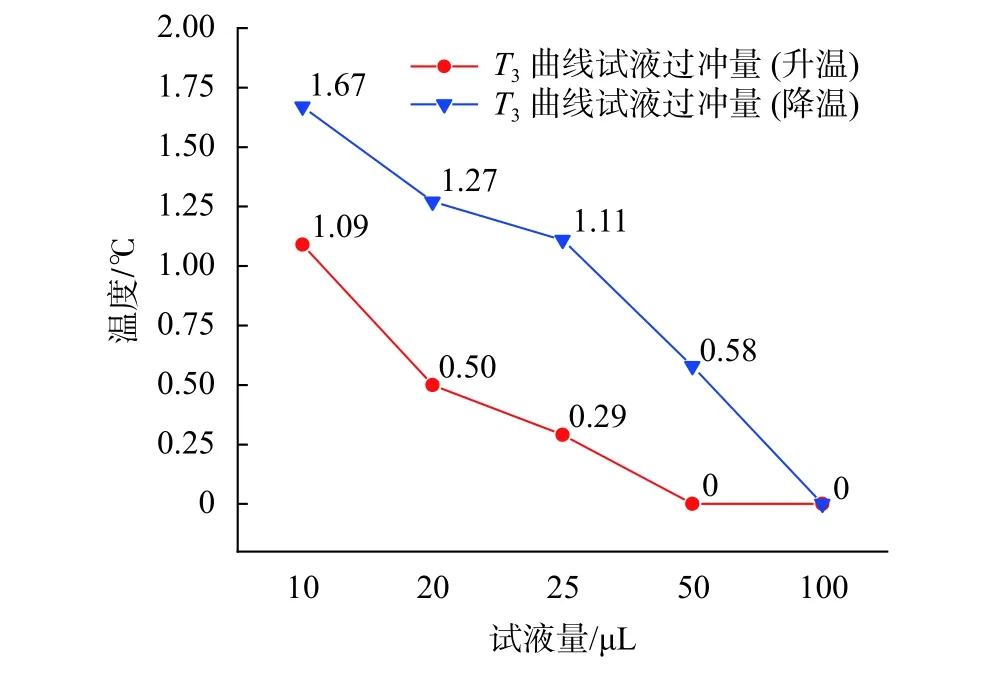
圖11 不同試液量的試液溫度過沖量曲線
6 結束語
本文分析了典型PCR儀熱循環系統的結構及傳熱原理,構建了某型號PCR儀單孔三維傳熱模型,并通過試液測溫實驗與一維仿真對比驗證了數值方法的準確性。對單孔模型的傳熱特性進行了仿真分析,研究了溫度過沖現象對PCR反應試液溫度的影響。在此基礎上,討論了在不同試液量下試液溫度的差異性。相關結論如下:
1)增大PCR儀溫控曲線的溫度過沖量會縮短試液的升/降溫時間,延長試液實際平臺期,有利于反應的充分進行。
2)試液的溫度過沖量存在上限(在50 μL試液量下為3 ℃),若高于上限將可能導致試液實際溫度不理想,造成聚合酶失活等嚴重后果。
3)在同一溫控曲線下,試液量越多,試液實際平臺期的持續時間就會越短,且越不容易出現溫度過沖現象。
4)PCR反應試液量低于50 μL時采用無過沖溫控模式,50 μL及以上時采用過沖溫控模式,將會取得更好的基因擴增效果,且過沖溫控模式下的最大溫度過沖量不應超過3 ℃。

