DKI直方圖預測局部進展期直腸癌患者預后的臨床價值
孫軼群,劉宗霖,付彩霞,信 超,沈長清,童 彤
1. 復旦大學附屬腫瘤醫院放射診斷科,復旦大學上海醫學院腫瘤學系,上海 200032
2. 西門子(深圳)磁共振有限公司,廣東 深圳518000
中國直腸癌的發病及死亡模式趨向歐美發達國家,呈增長趨勢[1]。研究[2]表明,70%~80%患者就診時被診斷為局部進展期直腸癌(locally advanced rectal cancer,LARC),5年生存率僅為20%。新輔助放化療(neoadjuvant chemoradiation therapy,NCRT)可有效降低直腸癌局部復發率,增加外科手術及保肛機會,但是很難進一步提高總體生存率[3-4]。
許多研究[5-7]證實腫瘤標志物水平、病理學分期等與患者預后相關。尋求可信度高、重復性好及簡單易測的預后因子仍然是目前臨床迫切需求。若干研究[8-9]證實非小細胞肺癌和頭頸部鱗狀細胞癌的總生存率與計算機體層成像(computed tomography,CT)直方圖中高熵值和低均勻度密切相關,提示CT直方圖特征可能成為一種新的預后因素。高分辨率磁共振成像(magnetic resonance imaging,MRI)作為直腸癌術前局部分期的標準成像模式,在評估腫瘤浸潤深度、直腸系膜筋膜(mesorectal fascia,MRF)等方面發揮著重要作用,不僅有助于篩選出適合行NCRT的患者,而且能協助外科醫生制訂合理的手術方案[10-12]。彌散峰度成像(diffusion kurtosis imaging,DKI)是磁共振功能成像技術之一,能對組織微觀結構的復雜性提供更準確的信息[13-14]。直方圖分析是對每個像素圖分布特點進行數據分析與運算以量化灰度分布函數的統計[15-18],在醫學影像學分析中較為常用。目前關于DKI直方圖分析在直腸癌預后預測方面的研究有限。因此本研究旨在探討DKI直方圖特征預測LARC患者預后的價值。
1 資料和方法
1.1 臨床資料
回顧并收集2015年1月—2017年12月復旦大學附屬腫瘤醫院符合以下標準的患者。納入標準:① 活檢證實為原發性直腸腺癌;② 患者治療前臨床診斷為局部進展期(LARC為T3~4期和/或N+);③ 患者均在NCRT前于放射診斷科行直腸MRI檢查(包括DKI序列);④ 在復旦大學附屬腫瘤醫院行完整的NCRT后,再接受直腸癌根治性手術。排除標準:① 既往接受過直腸手術、盆腔放療;② NCRT開始前接受抗腫瘤治療;③ 未完成NCRT;④ DKI圖像偽影明顯;⑤ 治療前DKI圖像腫瘤信號不明顯。最終61例患者滿足上述標準納入本研究。
1.2 NCRT方案
所有患者采用術前長程放療。CT模擬定位及束流調強放療,直線加速器6 MV常規照射,照射范圍為直腸腫瘤及盆腔淋巴引流區。放射總劑量為45~55 Gy,1.8~2.0 Gy/次,5次/周,放療期間聯合化療。化療方案:奧沙利鉑50 mg/m2于每周第1天靜脈滴注,每周的第1~5天口服卡培他濱625 mg/m2,每天2次。放療結束后2周再行1個周期化療。具體方案為第1天奧沙利鉑130 mg/m2,第1~14天口服卡培他濱1 000 mg/m2,每天2次。NCRT結束后5~12周內于復旦大學附屬腫瘤醫院大腸外科行全直腸系膜切除術。
1.3 MRI檢查方法
患者均在NCRT前1周內行直腸MRI掃描。患者無需腸道準備,不使用腸道對比劑。采用德國Siemens公司的MAGNETOM Skyra 3.0 T MRI掃描儀進行掃描,使用相控陣表面線圈完成圖像采集。患者取仰臥位,腳先進,直腸MRI掃描序列主要包括矢狀位不抑脂T2加權成像(T2-weighted imaging,T2WI)、橫斷位不抑脂薄層小視野T2WI、橫斷位不抑脂T1加權成像(T1-weighted imaging,T1WI),必要時加冠狀位不抑脂T2WI、DKI序列和增強序列。DKI序列采用自旋回波-平面回波成像序列(spin echoecho planar imaging,SE-EPI)。掃描參數:重復時間(repetition time,TR)4 800 ms;回波時間(echo time,TE)79 ms;掃描視野200 mm×180 mm;層厚5.5 mm;體素2.0 mm×2.0 mm×5.5 mm;層數20;b值分別為0、700、1 400、2 100 mm2/s,彌散敏感梯度場同時取X、Y和Z共3個方向,帶寬1 894 Hz。直腸掃描中的軸位均指直腸腫瘤的軸位。
1.4 腫瘤分割及特征提取
DKI圖像后處理及分析由1名影像科醫生在不知病理學檢查結果的情況下進行。圖像后處理步驟如下所示:第一步,將多b值DKI原始圖像導入德國Siemens公司的Body Diffusion Toolbox科研軟件,分別生成彌散峰度系數(diffusion kurtosis coefficient,K)及校正后的彌散系數(corrected diffusion coefficient,D)參數圖。其中K為描述水分子運動偏離正態分布的程度,D是在非正態分布情況下校正過的表觀彌散系數(apparent diffusion coefficient,ADC)。第二步,將上一步所生成的各個參數圖導入德國Siemens公司的Multiple Parameter Analysis Tool科研軟件進行全腫瘤直方圖分析。首先,通過參考橫斷位T2WI圖像及增強圖像,在D圖上手動描畫腫瘤區域內種子和腫瘤區域外種子,然后使用該軟件根據這些種子進行半自動分割,得到腫瘤感興趣容積(volume of interest,VOI)。隨后使用該軟件同時對多個參數圖進行全VOI分析,生成K及D直方圖及相應參數。
1.5 直方圖特征
特征提取后可獲得K圖的11個直方圖特征(Kmean、Ksd、KMedian、K95%、K5%、KKurtosis、KSkewness、 KDiffEntropy、 KDiffVarianc、 KContrast、KEntropy)、D圖的11個直方圖特征(Dmean、Dsd、DMedian、D95%、D5%、Dkurtosis、DSkewness、DDiffEntropy、DDiffVarianc、DContrast、DEntropy)及1個體積特征,因此每例患者共計23個特征。
1.6 預后因素評估
評估患者NCRT前mrT分期、mrN分期、mr腸壁外血管侵犯(extramural vascular invasion,EMVI)、mrMRF情況、腫瘤長度及距肛距離。記錄患者N C RT前癌胚抗原(carcinoembryonic antigen,CEA)及糖類抗原(carbohydrate antigen,CA)19-9水平。記錄術后病理學特征:神經侵犯(perineural invasion,PNI)、淋巴血管侵犯(lymphovascular invasion,LVI)、癌結節及腫瘤退縮分級(tumor regression grade,TRG)。
1.7 復查及隨訪
復查規則:患者術后2年內每3個月行胸部X線片或胸部CT檢查及實驗室檢查。實驗室檢查必須包括全血細胞計數、肝功能、血CEA及CA19-9水平,之后每6個月復查1次。每3個月行1次腹部MRI或CT掃描和盆腔MRI掃描。術后1年進行腸鏡檢查,之后每隔2年進行1次。
2020年11月對患者進行集中隨訪,術后至死亡時間為總生存期(overall survival,OS),記錄的時間以月為單位,詳細記錄患者死亡原因。
1.8 統計學處理
直方圖特征篩選及影像學標簽的建立:利用受試者工作特征(receiver operating characteristic,ROC)曲線,分別計算各個參數ROC曲線的曲線下面積(area under curve,AUC),以及其各切點診斷的特異度、靈敏度,結合各切點的靈敏度和特異度,選擇約登指數最大的切點所對應數值為最佳診斷界值(cut-off value)。
采用Kaplan-Meier法進行生存分析并用Log-rank檢驗。采用Cox比例風險回歸模型進行多因素分析,計算風險比(hazard ratio,HR)及95%置信區間(confidence interval,CI)。以上均使用R語言3.6.1軟件包及SPSS19.0軟件進行統計學分析,P<0.05為差異有統計學意義。
2 結 果
2.1 患者一般資料
61例患者中,女性9例,年齡31~65歲;男性52例,年齡32~89歲。該組患者具體特征詳見表1。

表1 61例患者基線臨床、影像學特征及術后病理學特征
2.2 隨訪結果
61例直腸癌患者中位隨訪時間44個月,最長隨訪時間76個月,最短隨訪時間18個月。在末次隨訪時,16例患者死亡,多數患者死于多發轉移,轉移部位多為肝肺轉移及腹膜轉移。
2.3 直方圖特征篩選及其預測患者預后的效能
使用ROC曲線的AUC篩選直方圖特征。基于ROC曲線分析結果,NCRT前DSkewness預測OS狀態的AUC為0.678(95% CI 0.526~0.830,P=0.044),DSkewness診斷OS狀態的最佳診斷界值為0.588,靈敏度及特異度分別為58.8%、81.2%(圖1)。本次研究中將NCRT前DSkewness<0.588視為DSkewness低組,DSkewness≥0.588視為DSkewness高組,DSkewness低組與DSkewness高組的DSkewness值差異有統計學意義(P=0.000)。
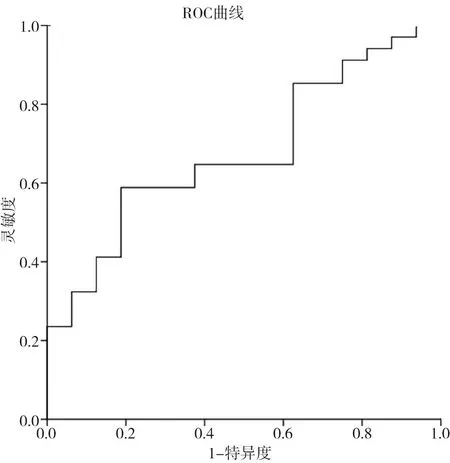
圖1 NCRT前DSkewness診斷OS狀態的ROC曲線
2.4 DSkewness不同分組間患者情況
DSkewness高組及DSkewness低組間OS差異有統計學意義(P=0.028,圖2)。DSkewness低組OS的中位數為56個月,DSkewness高組OS的中位數為37個月。
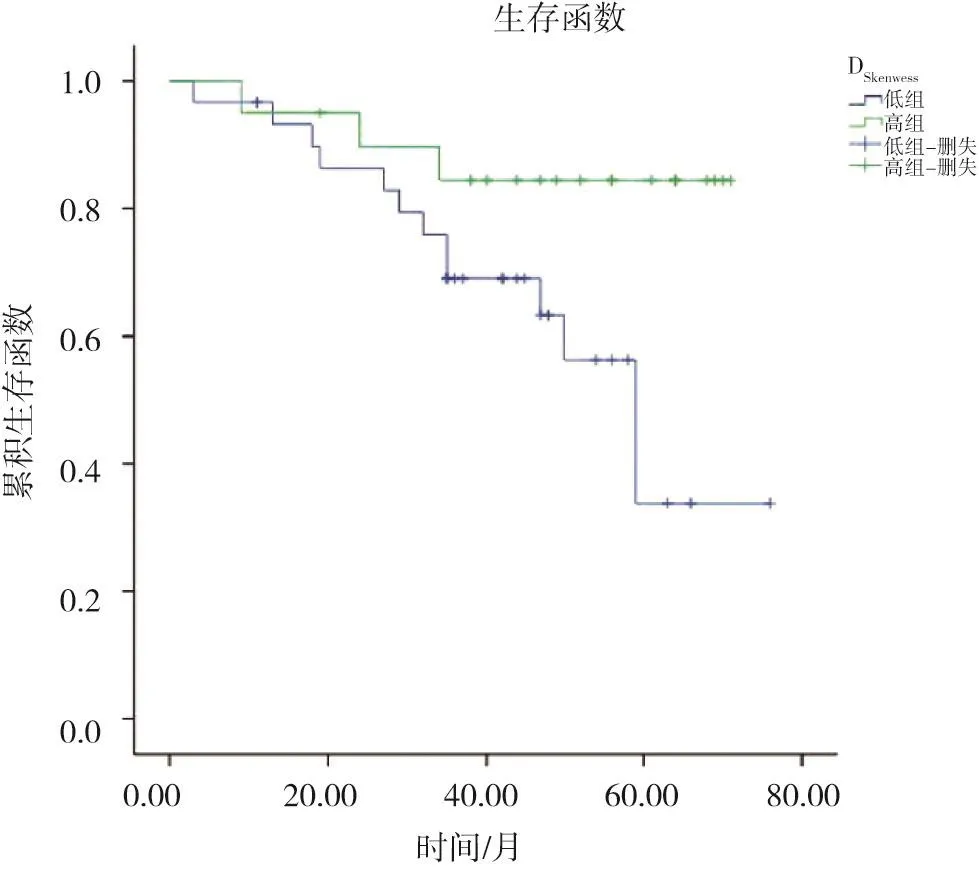
圖2 DSkewness低組和DSkewness高組LARC患者生存比較
2.5 影響LARC患者NCRT后OS單因素分析
經單因素分析:NCRT前mrEMVI、mrMRF、腫瘤標志物CA19-9水平及DSkewness、術后PNI與OS相關,詳見表2。
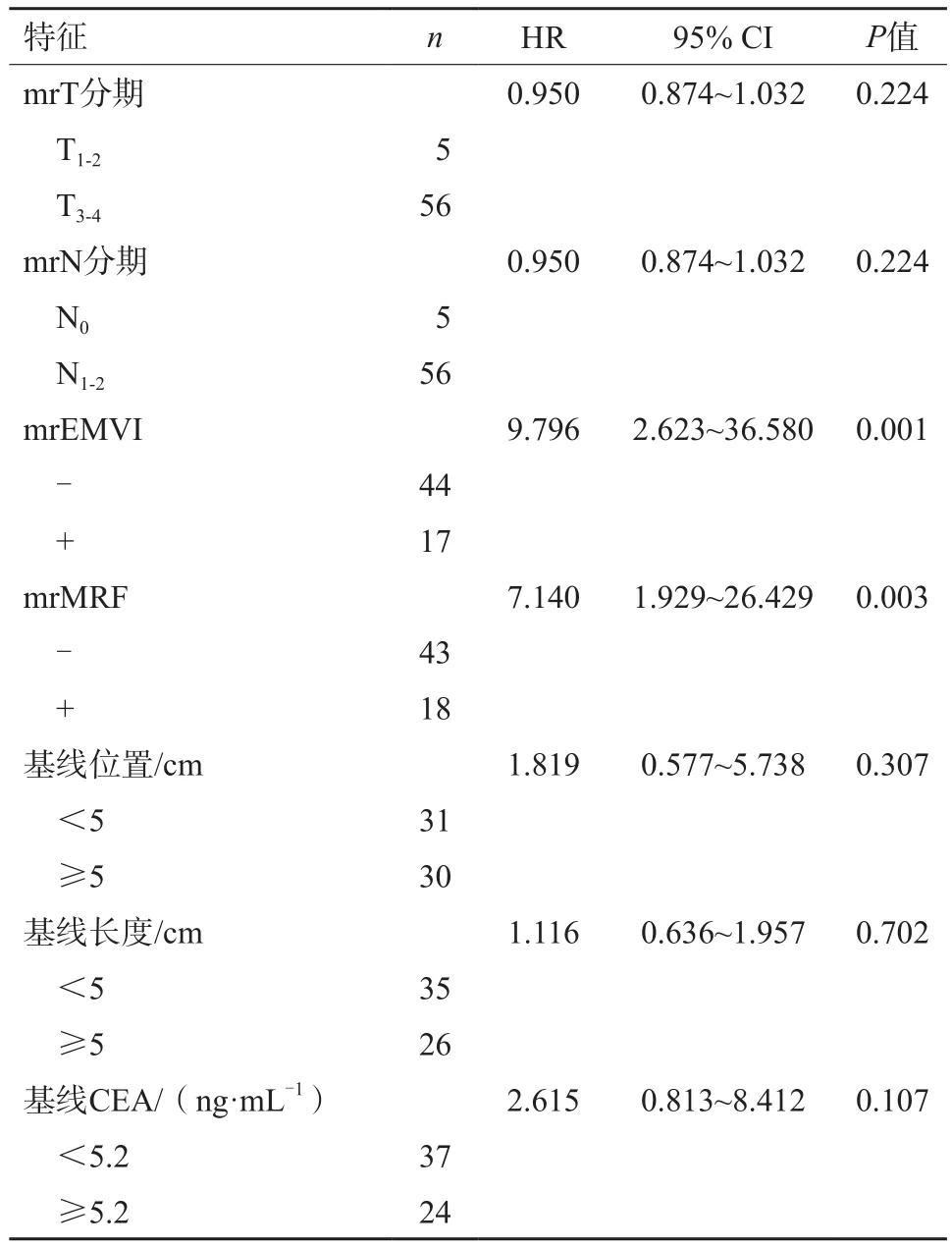
表2 影響LARC患者NCRT后OS單因素分析
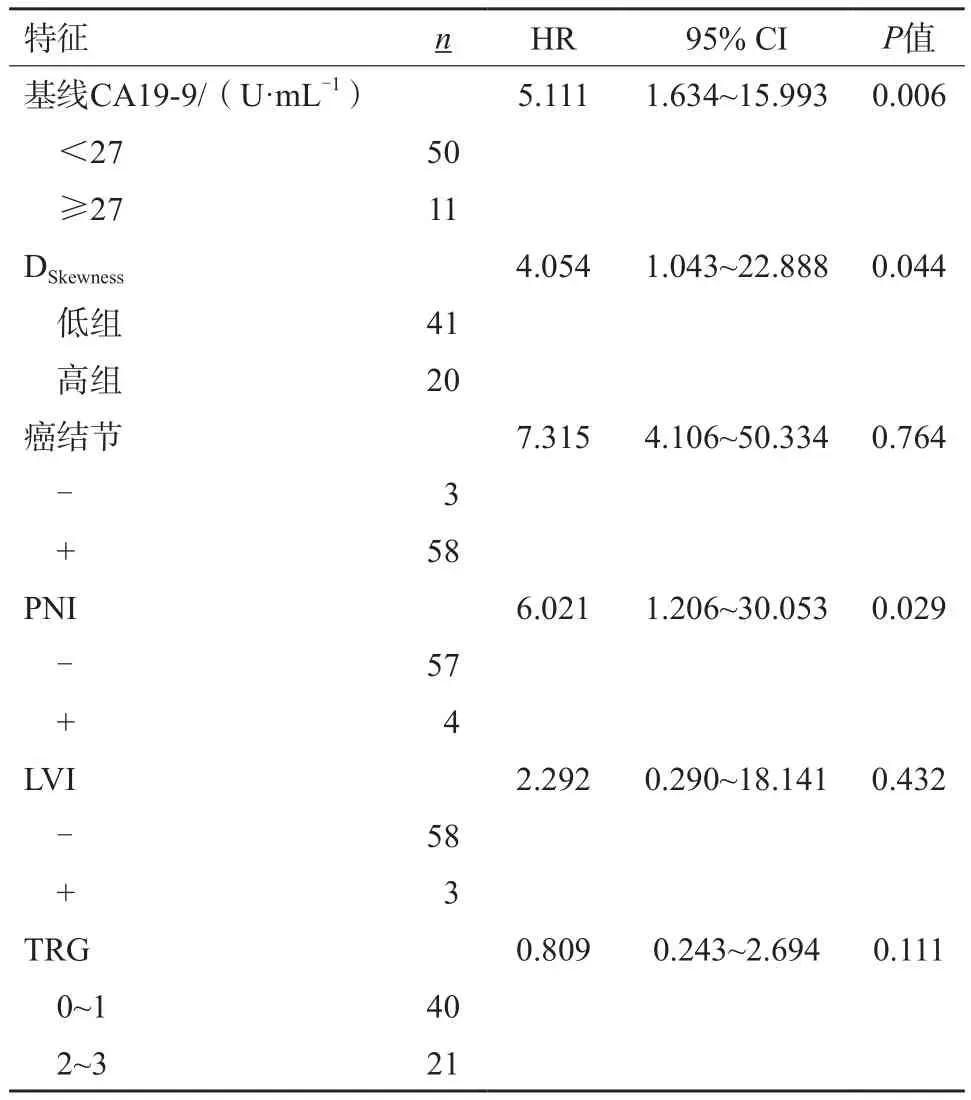
續表
2.6 影響LARC患者NCRT后OS多因素分析
篩選出經單因素分析后P<0.05的因素,即NCRT前mrEMVI、mrMRF、CA19-9水平、影像學特征標志值DSkewness及術后PNI,將以上因素再納入多因素分析。多因素分析結果顯示,NCRT前mrEMVI、CA19-9水平及影像學特征標志值DSkewness是影響LARC患者NCRT后OS的獨立危險因素,詳見表3。
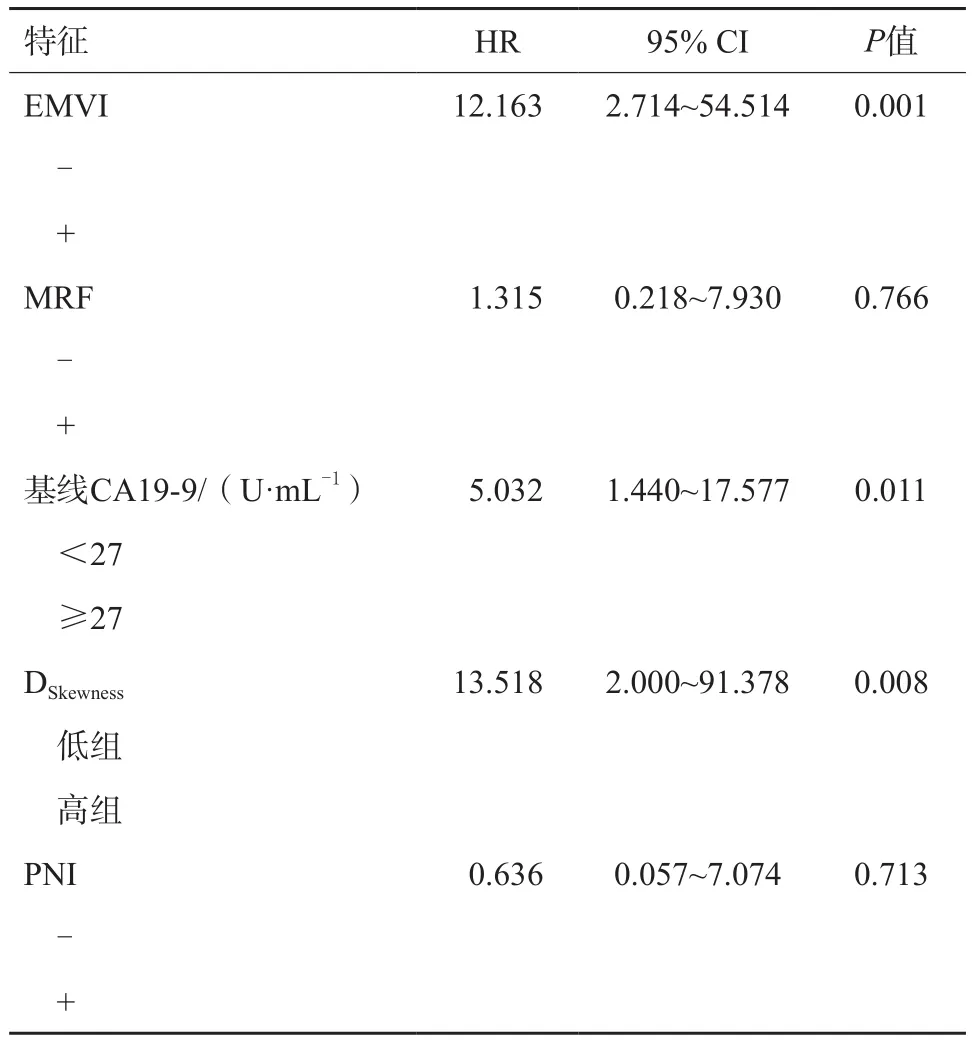
表3 影響LARC患者NCRT后OS多因素分析
3 討 論
目前臨床上主要根據直腸癌的臨床病理學分期、病理學完全緩解(pathological complete response,pCR)、TRG、PNI、LVI、CEA及CA19-9等預測患者的預后。尋求可信度高、重復性好、簡單易測的預后因子仍然是目前臨床的迫切需求。研究[19-20]證實MRI功能參數ADC值及血管灌注參數均為預測直腸癌患者預后的可靠指標。DKI是磁共振功能成像技術之一,可以對組織微觀結構的復雜性提供更準確的信息。過去許多研究[21-23]中,一般計算整個感興趣區域的平均參數,很少利用基于體素的計算方法。另外由于腫瘤內環境復雜,即使相同類型腫瘤或同一腫瘤內部也存在巨大差異,平均值未必能代表腫瘤的確切狀態。隨著高分辨率MRI和信號處理方法的進步,腫瘤直方圖分析MRI越來越多地被使用,該方法可描述腫瘤磁共振功能參數等的分布情況[24]。
本研究在D及K的直方圖中僅篩選出NCRT前DSkewness值與OS相關。NCRT前DSkewness<0.588組較DSkewness≥0.588組患者的OS更差。除此之外NCRT前mrMRF、mrEMVI、CA19-9水平及PNI與OS相關。進一步多因素分析NCRT前mrEMVI、CA19-9水平及DSkewness是患者預后獨立危險因素。還有研究[25]證實mrEMVI的診斷與病理EMVI之間無顯著差異。循環腫瘤細胞(circulating tumor cell,CTC)來源于原發腫瘤,癌癥患者血液中檢測到CTC,是患者預后因素之一[26-27]。腫瘤周圍血管是CTC轉移的主要途徑之一,CTC和mrEMVI之間存在相關性,而LARC患者多數死于轉移,這可能是mrEMVI陽性患者OS差的原因之一。CAl9-9用于胰腺癌、胃癌和結直腸癌的診斷,CAl9-9無腫瘤和器官特異性。NCRT前CAl9-9升高的患者預后差,多因素分析發現NCRT前CAl9-9升高是直腸癌預后獨立的危險因素,與文獻[28-29]報道一致。
值得注意的是,基于本次研究結果,NCRT前根據DSkewness可將患者分為高風險組和低風險組,且兩組的OS差異明顯。同時NCRT前DSkewness是一個獨立的預測因素,可對LARC患者進行無創性風險分層,篩選出可能從NCRT獲益的患者,與常規治療前MRI互補,提取出隱匿的影像學特征達到預測生存的目的。腫瘤異質性與患者預后顯著相關,因此腫瘤異質性被認為是潛在預后因素。D值代表非高斯分布的水分子彌散信息,Skewness是描述數據分布非對稱程度的特征[30]。腫瘤異質性越大,DSkewness越大,這可能是造成預后差組DSkewness更大的原因。本研究結果提示影像組學是預測直腸癌患者療效的無創性影像生物學標志物。
本研究存在局限性:首先,樣本量較小,并且屬于回顧性的單中心研究,今后需多中心大樣本量前瞻性研究驗證本次結果。第二,患者隨訪時間不夠長,中位隨訪期僅44個月。第三,排除了NCRT前DKI圖像上腫瘤信號不明顯的患者,可能造成選擇性偏倚。第四,術后依據患者情況行不同方案的全身化療,臨床信息不全面,因此未將此影響因素納入研究分析。

