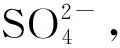pH值和Fe3+濃度對硫酸銨溶解度的影響
李 銳,張燕玲,李 穎,黃幫福,李 露,李光強
(1.云南天朗節能環保集團有限公司,云南安寧 650302;2.昆明理工大學冶金與能源工程學院,云南昆明 650093;3.武漢科技大學鋼鐵冶金及資源利用省部共建教育部重點實驗室,湖北武漢 430081)
二氧化硫(SO2)是主要大氣污染物之一,其在大氣中會被氧化成硫酸霧或硫酸鹽氣溶膠,是環境酸化的重要前驅物。針對煙氣中的SO2治理方法有很多,其中氨法脫硫的脫硫效率高達95%,同時其副產品硫酸銨可用作氮肥,具有較高社會經濟價值,因此,氨法脫硫在我國得到廣泛應用[1]。氨法脫硫工藝中控制硫酸銨結晶是重要環節之一,而硫酸銨溶解度又是控制結晶的核心[2-3]。因此,控制好硫酸銨溶解度可得到粒度分布均勻的硫酸銨晶體,同時可避免暴發成核,降低二次成核率[4]。
目前,國內外針對硫酸銨結晶過程的控制已有相關研究,pH對硫酸銨結晶的影響主要體現在對結晶形狀的影響和破壞晶體的正常生長條件[5]。攪拌速度決定了流體流動狀態以及成核速率[6],攪拌速率越大,介穩區寬度變窄[7],增大攪拌速率會使晶體與晶體、晶體與攪拌槳、晶體與結晶器壁之間的碰撞概率和碰撞強度增加,晶體成核速率增大[8]。一定濃度的Fe3+可促進硫酸銨結晶過程中亞硫酸銨的氧化,但Fe3+濃度過高會使硫酸銨結晶量減少,甚至無晶粒產生[9]。Fe3+與晶面的結合能比Na+、Mg2+高很多,結合能越大說明該離子對晶面影響越大,溶質分子難以取代Fe3+,Fe3+對(101)晶面影響最大,導致硫酸銨晶體呈片狀[10]。以上文獻表明,圍繞pH和Fe3+濃度對硫酸銨溶解度影響研究較為鮮見,且影響機理尚未被完全揭示。
為探明pH和Fe3+濃度對硫酸銨溶解度的影響,本文采用激光法測定了溫度為293.15~353.15 K時硫酸銨分別在純水、不同pH和不同Fe3+濃度溶劑中的溶解度,引入經驗方程用于計算各條件下硫酸銨溶解度,深入探究pH和Fe3+濃度對硫酸銨溶解度影響機理。相關研究成果可為提高硫酸銨結晶效率、產量和質量提供參考。
1 試驗方法
1.1 硫酸銨溶解度測定
溶解度是指在一定溫度下,固體在液體中溶解達到平衡時的濃度,此時溶液為飽和溶液[11]。在結晶過程中,測量結晶物質在特定溶劑中的溶解度是必不可少的步驟。測量溶解度可幫助結晶工藝篩選適合的溶劑體系以及為優化硫酸銨結晶工藝提供基礎數據。因此,本文采用激光法測定硫酸銨在不同溶液中的溶解度,其測定裝置如圖1所示。
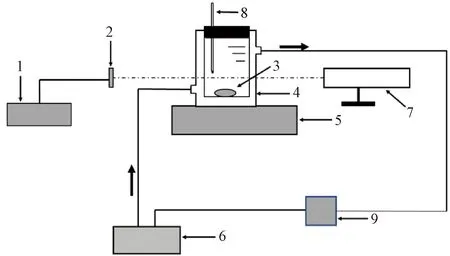
注:1—數字功率顯示器;2—激光接收器;3—磁力轉子;4—雙層夾套結晶器;5—磁力攪拌器;6—恒溫水浴鍋;7—氦氖激光發射器;8—溫度計;9—蠕動泵圖1 溶解度測定試驗裝置Fig.1 Experimental Apparatus of Solubility Determination
測定硫酸銨溶解度的步驟如下:打開恒溫水浴鍋,設定溫度值T;用精度為0.001 g的電子天平稱取一定量的硫酸銨固體和100.000 g溶劑,加入到容積為200 mL的雙層夾套結晶器中;啟動蠕動泵用以控制循環水,使結晶器內的溫度達到設定值T;多次少量補充硫酸銨,直到數字功率顯示器讀數穩定,記錄所加入的硫酸銨質量,通過式(1)計算該溫度下的硫酸銨摩爾溶解度X;采用氦氖激光測定系統監測硫酸銨溶解過程,隨著硫酸銨的溶解,數字功率顯示器讀數逐漸增大;開啟磁力攪拌器,在充分攪拌下,硫酸銨開始快速溶解。重復上述步驟,測量不同溫度下的硫酸銨溶解度,各溫度下硫酸銨的溶解度測量3次,取其平均值作為最終溶解度。
(1)
其中:X——溫度T下硫酸銨溶解度;
m1——硫酸銨質量,g;
m2——溶劑質量,g;
M1——硫酸銨摩爾質量,g/mol;
M2——溶劑摩爾質量,g/mol。
1.2 溶解度經驗方程
為便于量化描述硫酸銨溶解度和溫度之間的關系,采用簡化的Apelblat經驗方程以關聯硫酸銨溶解度數據。當壓力影響不變或壓力可忽略時,溶解度和溫度之間的關系用Apelblat經驗方程來計算,簡化的Apelblat經驗方程如式(2)[12-13]。
lnX=A+B/T+ClnT
(2)
其中:T——反應溫度,K;
A、B、C——試驗所測溶解度數據回歸得到的常數[14]。
此外,采用Matlab軟件對式(2)進行回歸計算。
2 結果與討論
2.1 溶解度測定
查閱文獻[12]可知,硫酸銨在純水中的溶解度如表1所示。

表1 不同溫度下純水中硫酸銨溶解量Tab.1 Dossolved Quantity of Ammonium Sulfate in Pure Water under Various Temperatures
為保證本試驗裝置所測數據的可靠性和準確性,綜合考慮環境溫度和恒溫水浴鍋的影響,本文從表1中選取溫度為293.15~353.15 K,測定試驗條件下硫酸銨在純水中的溶解度,并與文獻值[12]進行比較,結果如圖2所示。用激光法測定的硫酸銨溶解度與文獻值偏差較小,且相對誤差較小,故采用激光法所測溶解度具有良好可靠性和準確性。
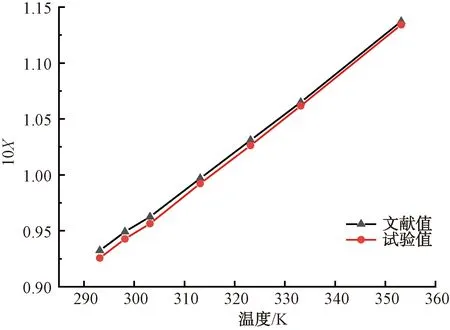
圖2 硫酸銨在純水中溶解度試驗值與文獻值Fig.2 Experimental Value and Literature Value of Ammonium Sulfate Solubility in Pure Water
在圖2基礎上,采用經驗方程(2)對純水中的硫酸銨溶解度文獻值和試驗值進行擬合,結合Matlab軟件計算出常數A、B和C,得到文獻值下的擬合方程如式(3),試驗值下的擬合方程如式(4)。
(3)
(4)
由式(3)和式(4)的相關系數R2可知,采用經驗方程對溶解度和溫度進行擬合可獲得較好效果。故溶解度經驗方程適用于本文對溶解度和溫度的關聯研究。
將純水中硫酸銨溶解度試驗值Xexp與擬合方程的計算值Xcal進行比較,如表2所示。試驗值與計算值相近,可進一步說明溶解度經驗方程擬合效果較好,同時獲得溫度為293.15~353.15 K時硫酸銨在純水中的溶解度。
2.2 pH對溶解度影響
在氨法脫硫工藝中,大量含SO2的煙氣直接與溶液接觸,導致硫酸銨母液偏酸性,因此,研究pH對硫酸銨溶解度影響對優化硫酸銨結晶具有重要意義。基于2.1小節溶解度的測定,同樣在溫度為293.15~353.15 K時,采用激光法測定硫酸銨在不同pH硫酸銨溶液中的溶解度,試驗結果如圖3所示。
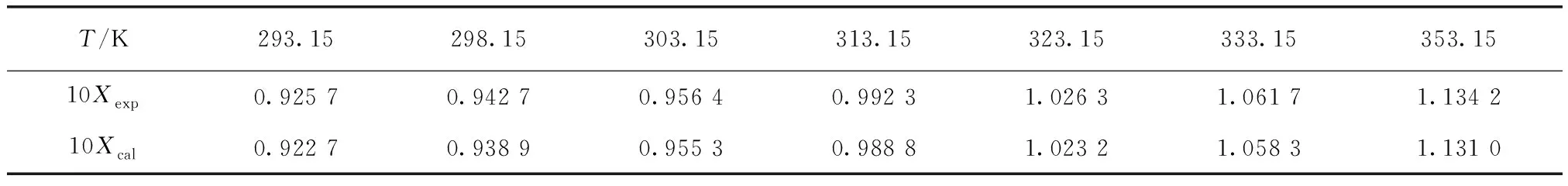
表2 純水中硫酸銨溶解度試驗值與計算值Tab.2 Experimental Value and Calculated Value of Ammonium Sulfate Solubility in Pure Water
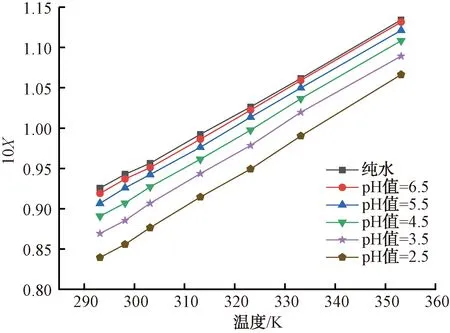
圖3 純水和不同pH值溶液的硫酸銨溶解度Fig.3 Solubility of Ammonium Sulfate in Pure Water and Solution with Various pH Values

采用Matlab軟件對圖3中不同pH條件下硫酸銨溶解度進行擬合,結果如表3所示。由R2可知,使用Matlab軟件對溶解度擬合具有良好的回歸效果。將試驗值與模型計算值進行比較,結果如表4所示,表明試驗值與模型計算值比較接近,經驗模型具有較好的擬合效果,同樣可較準確計算硫酸銨在不同pH及其不同溫度條件下的溶解度。
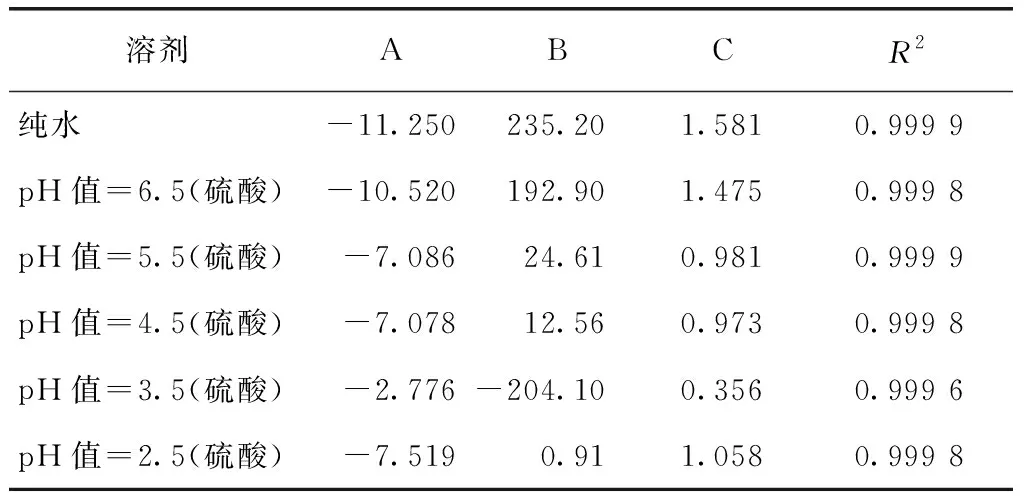
表3 硫酸銨在不同pH值條件下的經驗模型參數回歸結果Tab.3 Parameter Regression Results of Empirical Model of Ammonium Sulfate under Various pH Values
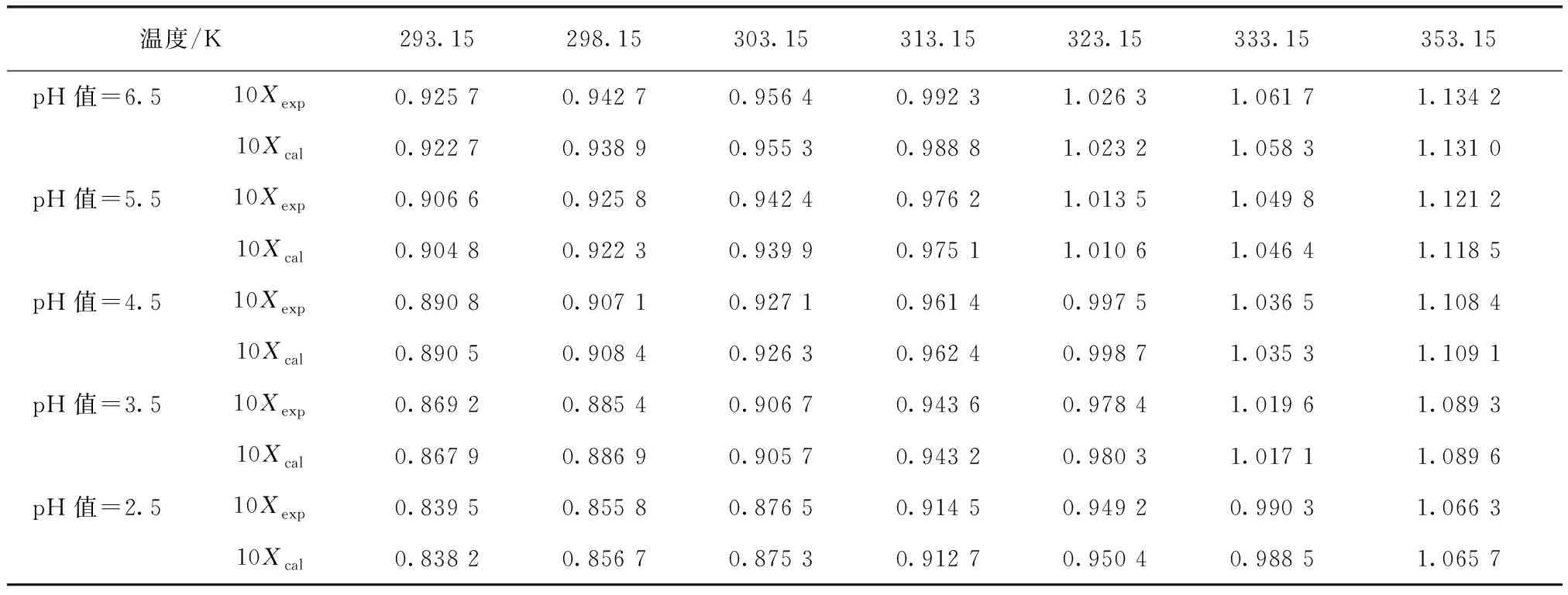
表4 不同pH值溶液中硫酸銨溶解度試驗值與模型計算值Tab.4 Experimental Values and Model Calculated Values of Ammonium Sulfate Solubility under Various pH Values
2.3 Fe3+濃度對硫酸銨溶解度影響
工業煙氣中含有大量雜質,會隨之進入硫酸銨母液中,形成Fe3+且對硫酸銨結晶產生較大影響,故測定和掌握含Fe3+溶劑中的硫酸銨溶解度具有實際意義。同樣選取溫度為298.15~333.15 K,采用激光法測定不同Fe3+濃度對硫酸銨溶解度影響,結果如圖4所示。
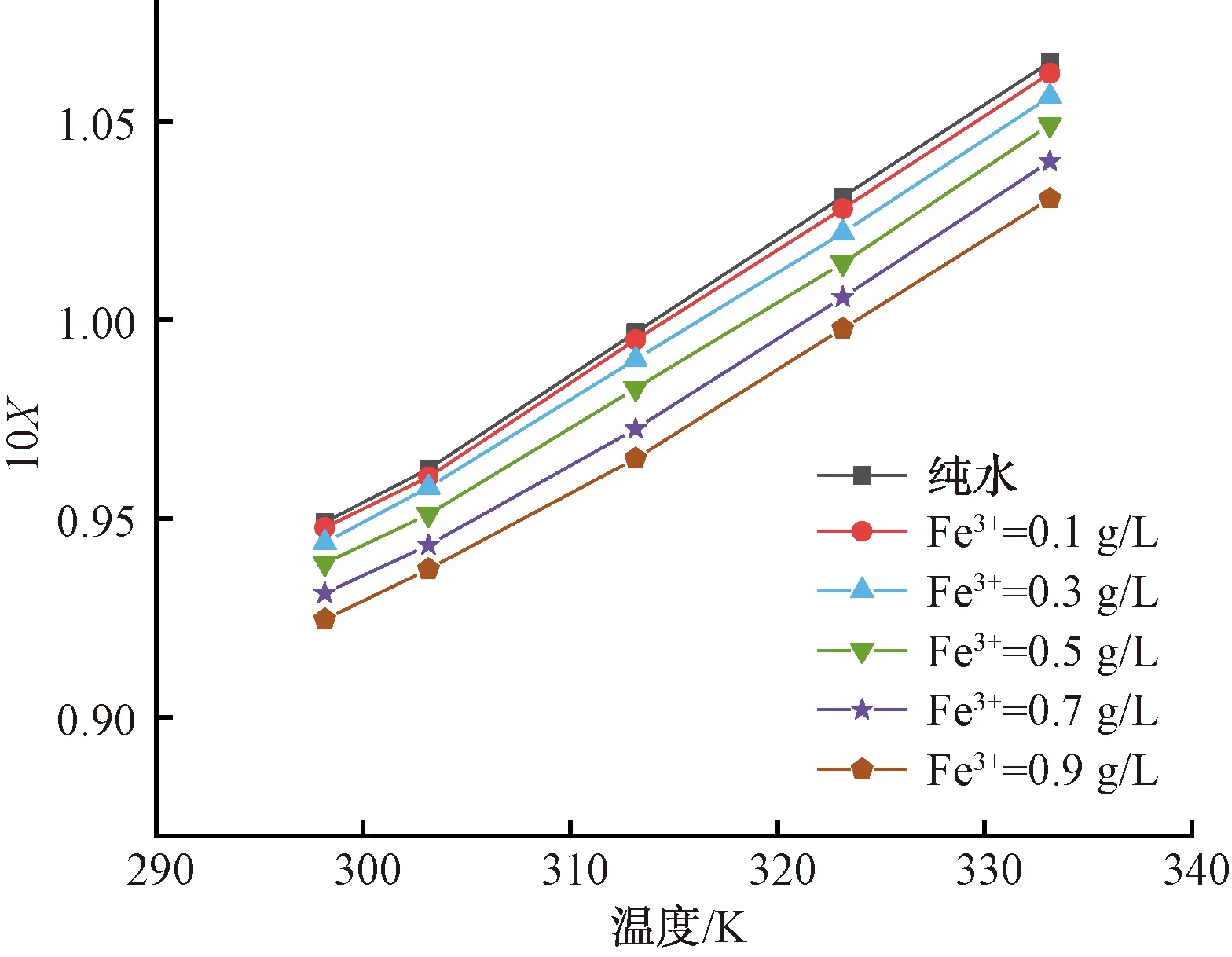
圖4 不同Fe3+濃度對硫酸銨溶解度影響Fig.4 Effect of Various Fe3+ Concentrations on Ammonium Sulfate Solubility
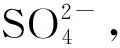
利用Matlab軟件對不同Fe3+濃度條件下硫酸銨溶解度進行擬合,結果如表5所示。并比較試驗值與模型計算值,結果如表6所示。由表5和表6可知,硫酸銨在不同Fe3+濃度的溶液中溶解度試驗值與模型計算值比較接近,該模型有較好的擬合效果。
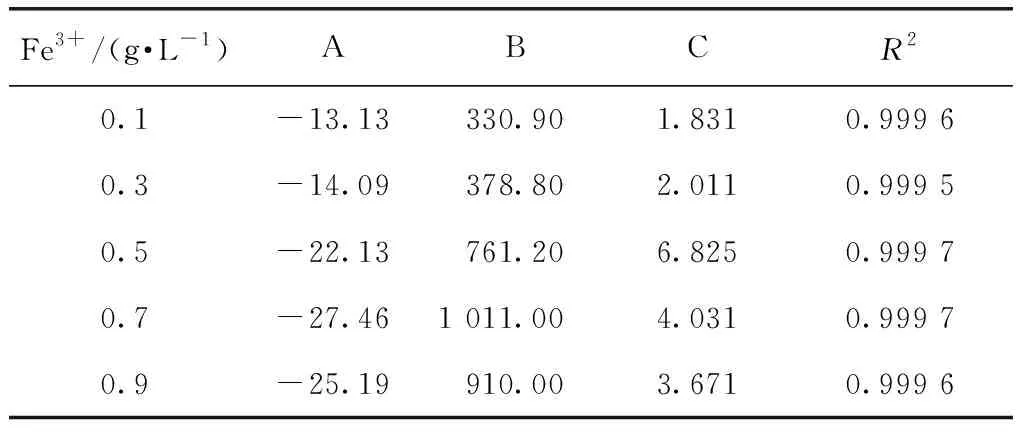
表5 硫酸銨在不同Fe3+濃度條件下的溶解度數據模型參數回歸結果Tab.5 Parameter Regression Results of Empirical Model of Ammonium Sulfate Solubility under Various Fe3+ Concentration
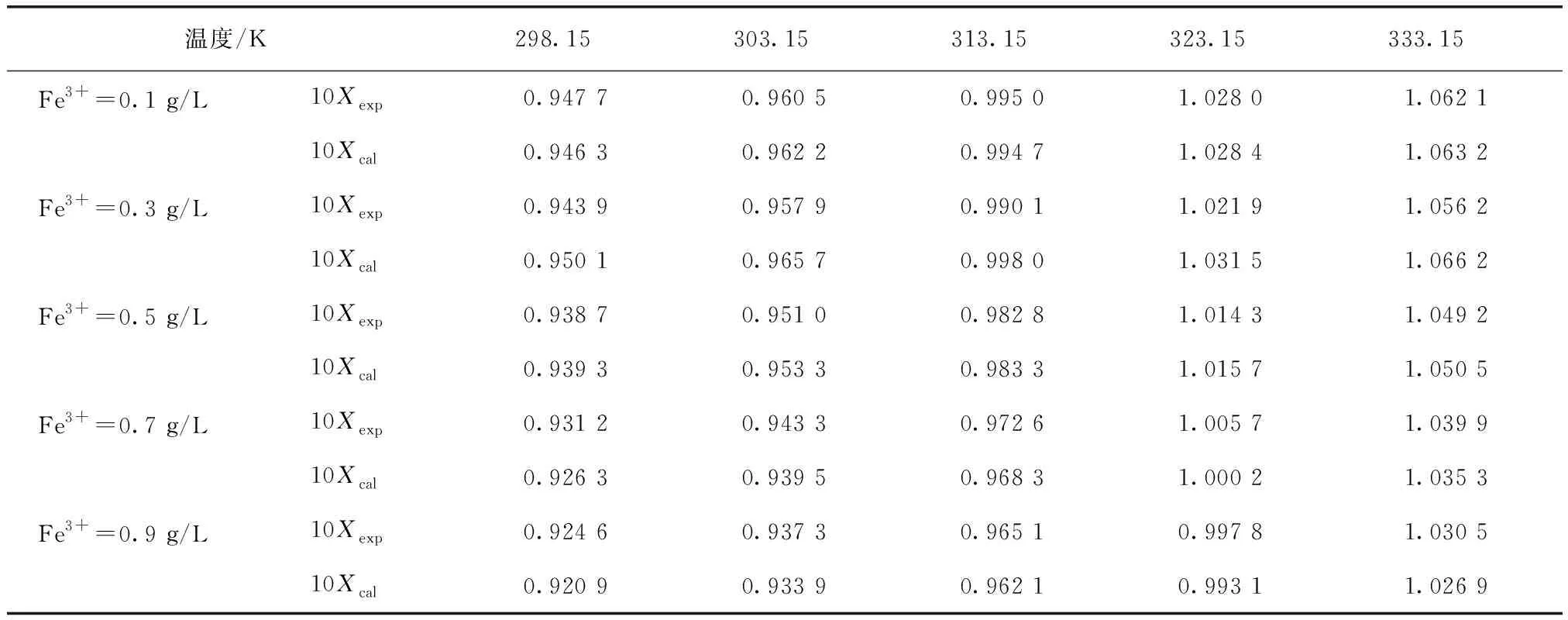
表6 不同Fe3+濃度的溶液中硫酸銨溶解度試驗值與模型計算值Tab.6 Experimental Values and Model Calculated Values of Ammonium Sulfate Solubility under Various Fe3+ Concentrations
3 結論
(1)用激光法測定的硫酸銨溶解度與文獻值偏差較小,此法具有良好的可靠性和準確性。溶解度經驗方程擬合效果較好,可用于計算溫度為293.15~353.15 K時硫酸銨在純水、不同pH和不同Fe3+濃度條件下的溶解度。