高遷移率族蛋白B-1和NADPH氧化酶衍生活性氧對(duì)糖尿病視網(wǎng)膜病變大鼠視網(wǎng)膜電圖波幅和玻璃體通透性的影響
邵 娟,白淑瑋,田蘊(yùn)霖
(西安市人民醫(yī)院 西安市第四醫(yī)院,陜西 西安710004)
糖尿病視網(wǎng)膜病變(Diabetic retinopathy,DR)是目前發(fā)達(dá)國(guó)家成年人視力喪失的主要原因之一,越來(lái)越多的2型糖尿病患者出現(xiàn)DR,包括高血糖、胰島素抵抗和胰島素相對(duì)缺乏,目前可用的治療方法有限[1]。DR的第一個(gè)臨床特征是玻璃體視網(wǎng)膜微血管異常[2],最初的跡象是非增殖性的,例如血管破裂、毛細(xì)血管擴(kuò)張功能障礙和微動(dòng)脈瘤等[3]。此外,玻璃體通透性增加和變性會(huì)導(dǎo)致DR和視力障礙的發(fā)生。玻璃體的通透屏障包括血水屏障和血視網(wǎng)膜屏障,可以保護(hù)眼睛免受炎癥細(xì)胞和血液成分的侵害[4]。這些屏障管理視網(wǎng)膜的血液供應(yīng),并負(fù)責(zé)神經(jīng)視網(wǎng)膜的穩(wěn)態(tài)。細(xì)胞間緊密連接有助于形成嚴(yán)格調(diào)節(jié)的擴(kuò)散屏障,從而產(chǎn)生高選擇性滲透性[5]。還原型煙酰胺腺嘌呤二核苷酸磷酸(Nicotinamide adenine dinucleotide phosphate,NADPH)氧化酶的非吞噬細(xì)胞氧化酶(Non-phagocytic cell oxidase,Nox)是線粒體外活性氧(Reactive oxygen species,ROS)生成的主要來(lái)源[6]。Nox由膜結(jié)合亞基、胞質(zhì)亞基和小G蛋白R(shí)ac組成。研究[7]表明,血管NADPH氧化酶亞型的失調(diào)與DR的發(fā)展和Nox異構(gòu)體有關(guān),吞噬細(xì)胞樣NADPH氧化酶-2(Nox2)是ROS的主要胞質(zhì)來(lái)源,Nox2在DR的發(fā)展中起關(guān)鍵作用。高遷移率族蛋白1(High mobility group box-1 protein,HMGB1)是一種非組蛋白DNA結(jié)合核蛋白,在染色質(zhì)組織和轉(zhuǎn)錄調(diào)控中起重要作用[8]。大量證據(jù)表明HMGB1在介導(dǎo)炎癥、血視網(wǎng)膜屏障破壞、氧化應(yīng)激、細(xì)胞凋亡和糖尿病視網(wǎng)膜神經(jīng)病變中具有重要意義[9]。然而,DR中HMGB1和ROS生成機(jī)制仍不清楚。根據(jù)上述相關(guān)研究,我們假設(shè)了一種新機(jī)制,該機(jī)制描述了糖尿病視網(wǎng)膜微環(huán)境中HMGB1和Nox衍生的ROS之間的相互增強(qiáng),這可能作為糖尿病誘導(dǎo)的視網(wǎng)膜電圖波幅和玻璃體的通透性發(fā)揮關(guān)鍵作用。因此,本研究的目的是探討HMGB1和NADPH氧化酶衍生活性氧相互增強(qiáng)對(duì)視網(wǎng)膜電圖波幅和玻璃體通透性的影響。
1 材料與方法
1.1 實(shí)驗(yàn)材料
1.1.1 實(shí)驗(yàn)大鼠:40只雄性SD大鼠(8~9周齡,200~220 g)購(gòu)自武漢大學(xué)人民醫(yī)院動(dòng)物實(shí)驗(yàn)中心,許可證號(hào)SYXK(鄂)2020-0027。于標(biāo)準(zhǔn)實(shí)驗(yàn)室環(huán)境[溫度(25±2)℃,濕度45%~65%,12 h循環(huán)光照和黑暗],自由進(jìn)食飼料、飲水。所有動(dòng)物程序均按照視覺(jué)和眼科研究協(xié)會(huì)(ARVO)關(guān)于在眼科和視覺(jué)研究中使用動(dòng)物的聲明進(jìn)行,并得到動(dòng)物科學(xué)院機(jī)構(gòu)動(dòng)物護(hù)理和使用委員會(huì)的批準(zhǔn)。
1.1.2 其他材料:夾竹桃素(購(gòu)自Sigma-Aldrich),檸檬酸鈉緩沖液(pH 4.5)(購(gòu)自Sigma-Aldrich),2’-7’-二氯熒光素-二乙酸酯(DCFH-DA,購(gòu)自北京百奧萊博科技有限公司),Spectra Max Gemini XPS 熒光酶標(biāo)儀(購(gòu)自美國(guó)Molecular Devices),gp91 phox(Nox2)、聚腺苷二磷酸核糖聚合酶-1[poly(ADP-ribose)polymerase-1,PARP-1]和Caspase 3抗體(均購(gòu)自圣克魯斯生物技術(shù)公司),高靈敏度化學(xué)發(fā)光成像系統(tǒng)(購(gòu)自美國(guó)伯樂(lè)),高性能cDNA 逆轉(zhuǎn)錄試劑盒、YBR Green/ROX qPCR Master Mix[均購(gòu)自賽默飛世爾科技(中國(guó))有限公司],牛血清白蛋白(Albumin-fluorescein isothiocyanate conjugate,FITC-BSA,購(gòu)自美國(guó)Sigma公司)。
1.2 實(shí)驗(yàn)方法
1.2.1 大鼠DR模型的誘發(fā):30只大鼠禁食過(guò)夜,將鏈脲佐菌素(STZ)55 mg/kg溶于10 mmol/L檸檬酸鈉緩沖液(pH 4.5),于腹膜內(nèi)注射。如果大鼠的血糖高于250 mg/dl,則認(rèn)為患有糖尿病,持續(xù)3周誘導(dǎo)DR模型。48~72 h后尾靜脈采血,全血血糖≥16.7 mmol/L,尿糖~,維持1周以上確定為DR模型建立。
1.2.2 實(shí)驗(yàn)分組:將實(shí)驗(yàn)大鼠分為對(duì)照組(未做任何處理的SD大鼠,n=10)、DR模型組(n=10)、HMGB1注射組(注射5 ng/5 μl重組HMGB1滅菌溶液的DR大鼠,n=10)、ROS抑制劑組(給予ROS抑制劑-夾竹桃素飲用水的DR大鼠,n=10)四組。
1.2.3 ROS檢測(cè):使用2’-7’-二氯熒光素-二乙酸酯(DCFH-DA)檢測(cè)視網(wǎng)膜組織勻漿中ROS的生成,使用玻璃勻漿器在PBS中勻漿視網(wǎng)膜。將含有20 μg蛋白質(zhì)在PBS中稀釋的樣品與5 μmol/L DCFH-DA黑暗孵育15 min。使用Spectra Max Gemini XPS 熒光酶標(biāo)儀檢測(cè)熒光,每15 min測(cè)量1次,持續(xù)1 h,激發(fā)和發(fā)射波長(zhǎng)分別為488、525 nm。
1.2.4 蛋白質(zhì)印跡分析:視網(wǎng)膜和細(xì)胞裂解液在蛋白質(zhì)裂解緩沖液(30 mmol/L Tris-HCl,pH 7.5、5 mmol/L EDTA,1 % Triton X-100、250 mmol/L蔗糖、1 mmol/L釩酸鈉和蛋白酶抑制劑混合物)中勻漿。裂解物在4 ℃下以14 000 g離心15 min,收集上清,上樣蛋白質(zhì)(25~50 μg)進(jìn)行SDS-PAGE電泳,結(jié)束后轉(zhuǎn)移到硝酸纖維素膜上。應(yīng)用小鼠抗大鼠Nox2單克隆抗體(1∶400)、小鼠抗大鼠HMGB1單克隆抗體(1∶400)、小鼠抗大鼠Occludin單克隆抗體(1∶400)和小鼠抗大鼠ZO-1單克隆抗體(1∶40)。剝離膜后用β-肌動(dòng)蛋白重新探測(cè)評(píng)估泳道加載控制。使用高靈敏度化學(xué)發(fā)光成像系統(tǒng)使條帶可視化,并應(yīng)用Gene Tools軟件量化強(qiáng)度。
1.2.5 實(shí)時(shí)反轉(zhuǎn)錄聚合酶鏈反應(yīng)(RT-PCR)檢測(cè)大鼠視網(wǎng)膜組織PARP-1、Caspase 3 mRNA表達(dá):按照美國(guó)Molecular Research Center(MRC)公司的TRIZOL試劑說(shuō)明書從視網(wǎng)膜中提取總RNA。使用高性能cDNA 逆轉(zhuǎn)錄試劑盒以1 μg RNA合成cDNA;同時(shí)用SYBR Green/ROX qPCR Master Mix進(jìn)行RT-PCR。標(biāo)準(zhǔn)PCR條件:50 ℃、2 min和95 ℃、10 min,40個(gè)循環(huán),95 ℃ 延伸15 s,60 ℃延伸1 min。自動(dòng)調(diào)整閾值線至與擴(kuò)增曲線線性部分中的擴(kuò)增線相交,自動(dòng)記錄循環(huán)至閾值(CT)值。mRNA以β-肌動(dòng)蛋白為內(nèi)參,計(jì)算標(biāo)準(zhǔn)化后的ΔΔCT值表示mRNA的相對(duì)表達(dá)量。
1.2.6 視網(wǎng)膜電圖檢查:大鼠暗適應(yīng)過(guò)夜(>12 h),腹腔注射戊巴比妥鈉(65 mg/kg)麻醉,0.5%鹽酸丙胺卡因滴眼液進(jìn)行角膜表面麻醉,復(fù)方托吡卡胺滴眼液散瞳。將圓形角膜電極置于大鼠雙側(cè)角膜表面,不銹鋼針參比電極插入大鼠耳后皮下,接地電極刺入大鼠尾部皮下端(在暗紅燈下進(jìn)行上述操作)。顯示屏基線穩(wěn)定后,記錄視網(wǎng)膜電圖(Electroretinogram,ERG)的a波和b波的振幅變化。
1.2.7 玻璃體通透性評(píng)估:將異硫氰酸熒光素標(biāo)記的牛血清白蛋白(FITC-BSA)溶解在磷酸鹽緩沖液(PBS)中,通過(guò)尾靜脈灌注大鼠。灌注1 h后,立即摘除眼球,用4%多聚甲醛中固定2 h。解剖視網(wǎng)膜,通過(guò)日本奧林巴斯熒光顯微鏡BX53觀察,放大倍數(shù)100倍。實(shí)驗(yàn)至少重復(fù)3次。根據(jù)正常大鼠血漿中獲得的FITC-BSA標(biāo)準(zhǔn)曲線,收集血漿并用熒光分光光度計(jì)測(cè)定熒光強(qiáng)度。
2 結(jié) 果
2.1 四組大鼠視網(wǎng)膜ROS水平比較 通過(guò)DCFH-DA檢測(cè)大鼠視網(wǎng)膜組織勻漿中ROS的生成,DR模型組、HMGB1注射組較對(duì)照組大鼠視網(wǎng)膜ROS水平升高(均P<0.05),ROS抑制劑組較DR模型組、HMGB1注射組ROS水平降低(均P<0.05),見表1。
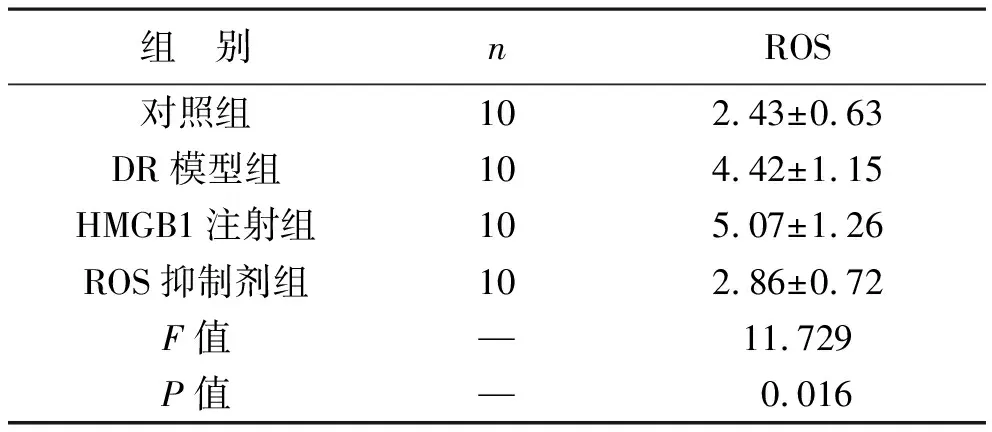
表1 四組大鼠視網(wǎng)膜ROS水平比較(μg/ml)
2.2 四組大鼠視網(wǎng)膜組織Nox2、HMGB1、Occludin、ZO-1蛋白表達(dá)比較 DR模型組和HMGB1注射組較對(duì)照組Nox2和HMGB1的蛋白表達(dá)升高(均P<0.05),ROS抑制劑組較HMGB1注射組和DR模型組Nox2和HMGB1的蛋白表達(dá)降低(均P<0.05)。大鼠視網(wǎng)膜Occludin和ZO-1的蛋白表達(dá),HMGB1注射組和DR模型組較對(duì)照組Occludin和ZO-1的蛋白表達(dá)降低(均P<0.05),ROS抑制劑組較HMGB1注射組和DR模型組Occludin和ZO-1的蛋白表達(dá)升高(均P<0.05)。見表2。

表2 四組大鼠視網(wǎng)膜組織Nox2、HMGB1、Occludin、ZO-1蛋白表達(dá)比較
2.3 四組大鼠視網(wǎng)膜組織PARP-1、Caspase 3 mRNA表達(dá)比較 HMGB1注射組和DR模型組較對(duì)照組大鼠視網(wǎng)膜PARP-1、Caspase 3 mRNA表達(dá)升高(均P<0.05),ROS抑制劑組較HMGB1注射組和DR模型組降低(均P<0.05),見表3。

表3 四組大鼠視網(wǎng)膜組織PARP-1、Caspase 3 mRNA表達(dá)比較
2.4 四組大鼠視網(wǎng)膜電圖波幅比較 通過(guò)視網(wǎng)膜電圖分析大鼠a波和b波振幅,HMGB1注射組和DR模型組較對(duì)照組a波和b波振幅減少(均P<0.05),ROS抑制劑組較HMGB1注射組和DR模型組振幅升高(均P<0.05),見表4。
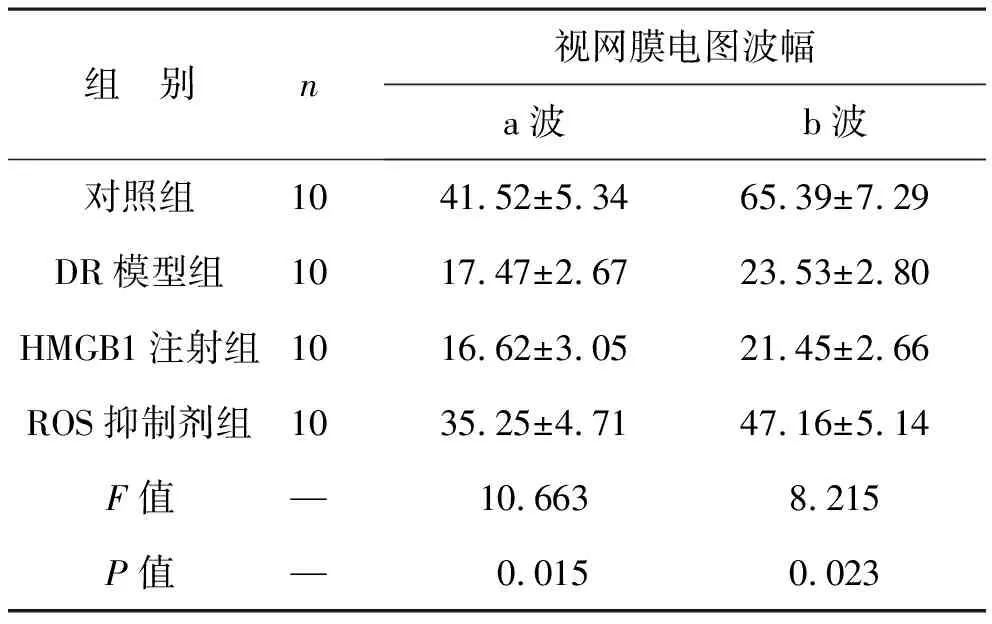
表4 四組大鼠視網(wǎng)膜電圖波幅比較(μV)
2.5 四組大鼠玻璃體FITC-BSA熒光強(qiáng)度比較 通過(guò)測(cè)量FITC-BSA熒光評(píng)估大鼠玻璃體通透性,DR模型組和HMGB1注射組較對(duì)照組熒光強(qiáng)度升高(均P<0.05),ROS抑制劑組較DR模型組和HMGB1注射組熒光強(qiáng)度降低(均P<0.05),見表5。

表5 四組大鼠玻璃體FITC-BSA熒光強(qiáng)度比較
3 討 論
臨床研究報(bào)道,HMGB1在DR患者的視網(wǎng)膜前膜和玻璃體液中表達(dá)上調(diào),其表達(dá)與疾病的活動(dòng)和炎癥生物標(biāo)志物的水平相關(guān)[10]。本研究證明HMGB1表達(dá)在糖尿病大鼠的視網(wǎng)膜中上調(diào),且HMGB1在介導(dǎo)糖尿病引起的視網(wǎng)膜血管病變和神經(jīng)病變中起關(guān)鍵作用。同時(shí)發(fā)現(xiàn)在正常大鼠玻璃體內(nèi)注射HMGB1誘導(dǎo)視網(wǎng)膜中ROS水平和Nox2、Caspase 3和PARP-1的表達(dá)顯著上調(diào),而Occludin和ZO-1表達(dá)降低。ROS抑制劑減弱糖尿病誘導(dǎo)的ROS水平升高,同時(shí)下調(diào)視網(wǎng)膜中HMGB1、Nox2、Caspase 3和PARP-1的表達(dá)。表明DR中HMGB1和Nox衍生的ROS之間存在相互增強(qiáng),這可能是促進(jìn)糖尿病誘導(dǎo)的視網(wǎng)膜電圖波幅和玻璃體的通透性改變的機(jī)制。
越來(lái)越多的證據(jù)支持這樣一種假設(shè),血糖波動(dòng)通過(guò)一些途徑可激活引起細(xì)胞的結(jié)構(gòu)、功能損壞,增加ROS生成和蛋白質(zhì)修飾能力而導(dǎo)致氧化應(yīng)激增加,最終導(dǎo)致視網(wǎng)膜細(xì)胞發(fā)生變化[11]。最近的證據(jù)表明,吞噬性Nox2是血管細(xì)胞、白細(xì)胞和組織巨噬細(xì)胞中超氧化物產(chǎn)生的主要內(nèi)源性細(xì)胞,其激活與糖尿病的血管并發(fā)癥密切相關(guān)[12]。以往研究表明,糖尿病小鼠視網(wǎng)膜和高糖處理的視網(wǎng)膜內(nèi)皮細(xì)胞中Nox2的表達(dá)增加與細(xì)胞內(nèi)黏附分子1和血管內(nèi)皮生長(zhǎng)因子的上調(diào)、增加的白細(xì)胞黏附和血視網(wǎng)膜屏障破壞相關(guān)[13]。此外,Nox2的缺失或NADPH氧化酶的抑制完全阻止了糖尿病誘導(dǎo)的ROS產(chǎn)生的增加,使細(xì)胞間黏附分子1正常化并阻止了視網(wǎng)膜血管通透性[14]。目前研究結(jié)果表明HMGB1通過(guò)激活Nox衍生的ROS生成來(lái)激活糖尿病視網(wǎng)膜中的屏障介質(zhì)[15]。證明了玻璃體內(nèi)使用HMGB1可誘導(dǎo)ROS生成和Nox2表達(dá)的上調(diào)。一份報(bào)告表明,HMGB1通過(guò)激活NADPH氧化酶誘導(dǎo)ROS產(chǎn)生,且針對(duì)HMGB1的中和抗體阻止了失血性休克/復(fù)蘇誘導(dǎo)的p47phox在循環(huán)中性粒細(xì)胞中的p47phox激活。此外,用重組HMGB1體外刺激中性粒細(xì)胞導(dǎo)致NADPH氧化酶的TLR4依賴性激活以及ROS產(chǎn)生增加。在本研究中,我們證明糖尿病引起ROS生成和Nox2、PARP-1和Caspase 3表達(dá)的顯著上調(diào),Occludin和ZO-1降低,并且持續(xù)攝入ROS抑制劑可有效預(yù)防糖尿病引起的ROS、Nox2、PARP-1,以及視網(wǎng)膜中的Caspase 3表達(dá)升高,促進(jìn)Occludin和ZO-1表達(dá)。
有報(bào)道證明ROS抑制劑對(duì)NADPH氧化酶的抑制作用僅限于表達(dá)髓過(guò)氧化物酶的白細(xì)胞,并且該化合物不抑制無(wú)髓過(guò)氧化物酶血管細(xì)胞中的NADPH氧化酶[16]。他們還證明,該化合物可以作為血管細(xì)胞中的抗氧化劑,并且在血管細(xì)胞中觀察到的ROS抑制劑的顯著效果可能是ROS清除的結(jié)果。總之,這些發(fā)現(xiàn)表明糖尿病視網(wǎng)膜中HMGB1和ROS生成之間存在正反饋回路。糖尿病視網(wǎng)膜中NADPH氧化酶衍生的ROS生成增加,導(dǎo)致視玻璃體通透性增加,視網(wǎng)膜電圖波幅降低,從而導(dǎo)致血管病變和神經(jīng)病變。在體外和體內(nèi)模型中產(chǎn)生的大量實(shí)驗(yàn)數(shù)據(jù)表明,糖尿病誘導(dǎo)的視網(wǎng)膜中PARP-1和Caspase 3過(guò)度表達(dá)會(huì)導(dǎo)致細(xì)胞死亡,這是一種先于組織病理學(xué)變化發(fā)展的現(xiàn)象[17]。氧化應(yīng)激增加細(xì)胞凋亡的潛在機(jī)制似乎很復(fù)雜,可能涉及炎癥介質(zhì)的產(chǎn)生和信號(hào)轉(zhuǎn)導(dǎo)的改變。在持續(xù)的氧化應(yīng)激情況下,過(guò)度的DNA損傷會(huì)導(dǎo)致PARP-1過(guò)度活化,通過(guò)消耗煙酰胺腺嘌呤二核苷酸和能量衰竭來(lái)切換細(xì)胞死亡模式[18]。在許多病理?xiàng)l件下,PARP-1的活性改變介導(dǎo)細(xì)胞凋亡。在視網(wǎng)膜中,糖尿病會(huì)誘導(dǎo)PARP-1的過(guò)度表達(dá),這種上調(diào)與視網(wǎng)膜細(xì)胞凋亡有關(guān)。類似地,在糖尿病視網(wǎng)膜細(xì)胞凋亡期間觀察到氧化應(yīng)激和Caspase 3激活之間的密切關(guān)系。最近,大量證據(jù)表明HMGB1在介導(dǎo)疾病細(xì)胞凋亡中的重要性[19]。在目前的研究中,玻璃體內(nèi)給予HMGB1上調(diào)了正常大鼠視網(wǎng)膜中PARP-1和Caspase 3的表達(dá)。此外,我們證明糖尿病視網(wǎng)膜中PARP-1和Caspase 3的表達(dá)上調(diào),并且ROS抑制劑的給予減弱了糖尿病誘導(dǎo)的PARP-1和Caspase 3上調(diào)。我們的研究結(jié)果表明,ROS抑制劑在糖尿病視網(wǎng)膜中阻止糖尿病誘導(dǎo)的PARP-1和Caspase 3表達(dá)的機(jī)制可能是通過(guò)降低ROS的產(chǎn)生。DR中血管通透性的增加伴隨著視網(wǎng)膜內(nèi)皮細(xì)胞中緊密連接蛋白的減少。ZO家族和Occludin是視網(wǎng)膜內(nèi)皮細(xì)胞緊密連接的充分表征成分。特別是,ZO家族可以引起通透性變化,因?yàn)樗cOccludin密切相關(guān),Occludin的磷酸化有助于通透性的調(diào)節(jié)。ZO-1和ZO-2是與緊密連接的細(xì)胞質(zhì)表面相關(guān)的連接蛋白,位于膜接觸點(diǎn)與原纖維[20]。它們參與緊密連接的形成,它們的細(xì)胞定位與血管內(nèi)皮細(xì)胞的通透性密切相關(guān)。我們已經(jīng)提出ZO家族是視網(wǎng)膜內(nèi)皮細(xì)胞緊密連接的一個(gè)組成部分,其表達(dá)為與玻璃體的滲透性呈負(fù)相關(guān)。在此,當(dāng)阻斷或降低HMGB1和Nox衍生的ROS之間相互作用可有效抑制糖尿病視網(wǎng)膜血管滲漏,并恢復(fù)ZO-1和Occludin的表達(dá)。研究中對(duì)各組大鼠中進(jìn)行了12 h的暗適應(yīng)后進(jìn)行視網(wǎng)膜電圖檢查。a波反映視錐細(xì)胞和桿狀細(xì)胞的功能,b波反映與桿狀細(xì)胞相連的雙極細(xì)胞的功能。結(jié)果顯示,與對(duì)照組大鼠相比,HMGB1注射組和DR模型組大鼠的a波和b波的幅度降低,然而,ROS抑制劑治療顯著減輕了大鼠的a波和b波振幅降低。這一發(fā)現(xiàn)表明大鼠視覺(jué)功能的部分恢復(fù),減輕氧化應(yīng)激引起的視覺(jué)損傷。
綜上所述,糖尿病視網(wǎng)膜中HMGB1和Nox衍生的ROS之間存在正反饋,這可能是促進(jìn)糖尿病誘導(dǎo)的視網(wǎng)膜電圖波幅降低和玻璃體通透性增加的機(jī)制。因此,對(duì)HMGB1和Nox衍生的ROS之間相互增強(qiáng)為我們提供了揭示DR發(fā)病機(jī)制的新見解,并將有助于定義一系列新穎且有前景的治療方法。

