鎂改性凹凸棒土對沼液中氮磷的吸附研究
丁 杰,梁越敢
(安徽農業大學 資源與環境學院,安徽 合肥 230036)
氮磷元素的過量排放是造成水體富營養化的主要原因,一般污水中氮磷的處理方法有生物法、化學法以及吸附法等[1],吸附法因具有使用簡便無污染、經濟效益好、可回收利用等優點,在近些年受到廣泛關注。凹凸棒土是一種常見的吸附材料,因其比表面積大、離子交換性強等特點使其具有優秀的吸附性能,被廣泛應用于環保等各個領域。研究表明,對凹凸棒土進行改性會進一步提升其吸附性能,可以很好地滿足對污染物去除的需求[2-3]。Wang[4]在不同改性方式中,選擇鎂鹽對凹凸棒土進行改性處理,用以回收廢水中的氮磷元素,在初始氮磷濃度為120mg/L、50mg/L條件下,氮磷平衡吸附量可分別達到42.6mg/g、69.8mg/g,具有較好的回收效果,同時證明有鎂鹽參與的磷酸銨鎂法是同步去除氮磷的有效方法。利用磷酸銨鎂法不僅可以實現氮磷的高效去除,并且產物磷酸銨鎂可被回收利用[5],這對于環境保護與資源利用有著重要的現實意義。
目前,國內外研究主要集中于一般污水中污染物的去除,而對污染物組成復雜、污染物濃度差別較大的沼液研究較少。為此,本研究利用氧化鎂改性天然凹凸棒土,對沼液中氮磷污染物同時進行吸附去除。通過吸附劑投加量、pH、共存離子、氮磷比等因素進行優化研究,并利用吸附等溫模型與吸附動力學探究其吸附特性,同時運用XRD、FTIR等表征手段進行機理分析,以期為氧化鎂改性凹凸棒土對實際沼液廢水中氮磷的去除回收提供參考。
1 材料與方法
1.1 氧化鎂改性凹凸棒土的制備
稱取10gMgCl2·6H2O(0.05mol)溶于100ml蒸餾水中。稱取10g凹凸棒土,將凹凸棒土加入到100ml氯化鎂水溶液中攪拌20min使其均勻。根據摩爾比5:1,量取20ml氨水(0.26mol)。在不斷攪拌的同時,向氯化鎂溶液中逐滴滴加氨水,滴加完成后繼續攪拌20min。攪拌完成后,利用抽濾裝置將溶液抽濾并不斷加蒸餾水清洗,得到產物后加入適量的無水乙醇浸泡,30min后將乙醇抽濾。將濾紙連同凹凸棒土放入烘箱,在105℃下干燥2h。將干燥后的材料移入坩堝置于馬弗爐中在550℃煅燒3h得到氧化鎂改性凹凸棒土。將煅燒后材料取出研磨過100目篩,收集放入干燥皿備用。
1.2 實驗方法
1.2.1 靜態吸附實驗
取20ml模擬含氮磷廢水(磷25mg/L、氨氮500mg/L),調整吸附劑投加量(2.5~20g/L)、溶液初始pH(3~11)、共存離子(濃度為50、100、200mg/L的SO42-、CO32-、K+、Ca2+和Mg2+)、氮磷比(20:1、10:1、5:1、2.5:1)等參數,控制某一變量時,其他變量不變。密封后放入溫度為25℃、轉速為180r/min的恒溫振蕩箱中振蕩12h后取出,用0.45μm的濾膜進行過濾,取過濾后樣品根據式(1)、式(2)測定氨氮與磷吸附量及去除率。
(1)
(2)
式中:qe為平衡吸附量(mg/g);η為吸附質去除效率(%);C0、Ce分別為起始狀態和平衡狀態時溶液中氮磷濃度(mg/L);V為溶液體積(mL);m為吸附劑投加量(g)。
1.2.2 吸附動力學實驗
取100ml模擬含氮磷廢水(磷25mg/L、氨氮500mg/L),調節溶液pH=7,吸附劑投加量為2.5g/L,分別在1、10、20、30、60、90、120、240、480、720min取樣,測定氮磷濃度。
1.2.3 吸附等溫線實驗
取20ml不同初始濃度(磷25、50、100、200、300、400mg/L,氨氮500mg/L。氨氮10、20、50、100、200、300、500mg/L,磷25mg/L)的模擬含氮磷廢水,調節溶液pH=7,吸附劑投加量為2.5g/L,在15℃、25℃、35℃振蕩12h后,取樣經0.45μm濾膜過濾,測定氮磷濃度。
1.2.4 磷形態提取實驗
取100ml不同初始濃度(磷100mg/L,氨氮22.5、45、450、2250mg/L)的模擬含氮磷廢水,調節溶液pH為7,吸附劑投加量2.5g/L,在25℃振蕩12h至吸附達到平衡,離心后取上清液測溶液中氮磷濃度并計算出吸附劑吸附量。離心出的吸附劑加去離子水清洗后,依次投加到100ml,1mol/L的NaCl、NaOH、HCl溶液中,在相同條件下振蕩12h后分別取樣測定溶液中氮磷濃度。
1.3 分析方法
磷采用鉬酸銨分光光度法測定,氨氮采用納氏試劑分光光度法測定。不同條件下吸附后吸附劑經離心、冷凍干燥、研磨后,分別用X射線衍射(XRD)與紅外光譜(FTIR)分析吸附劑的晶體變化和表面官能團的變化。
2 結果與討論
2.1 吸附劑投加量對氮磷去除影響
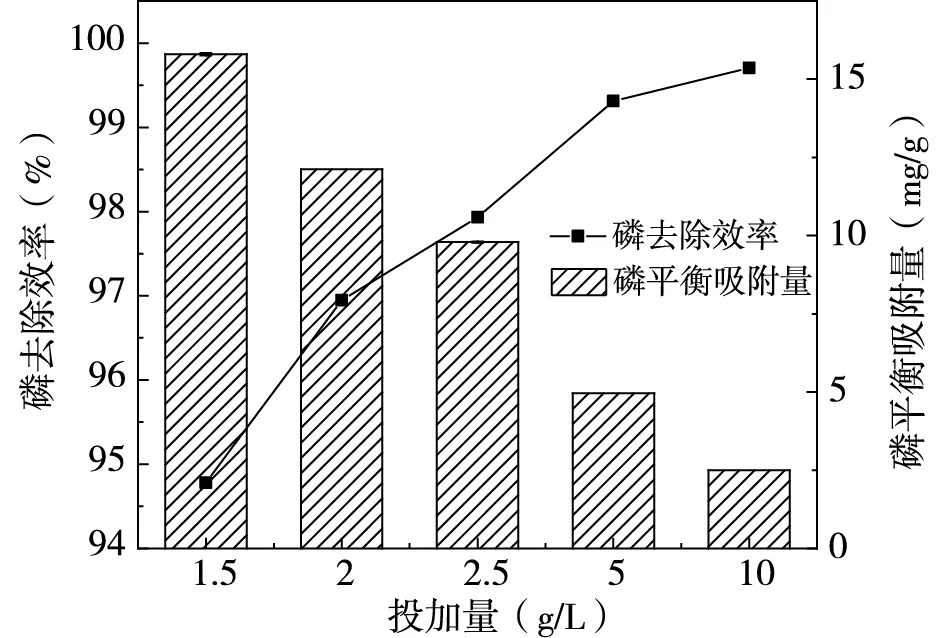
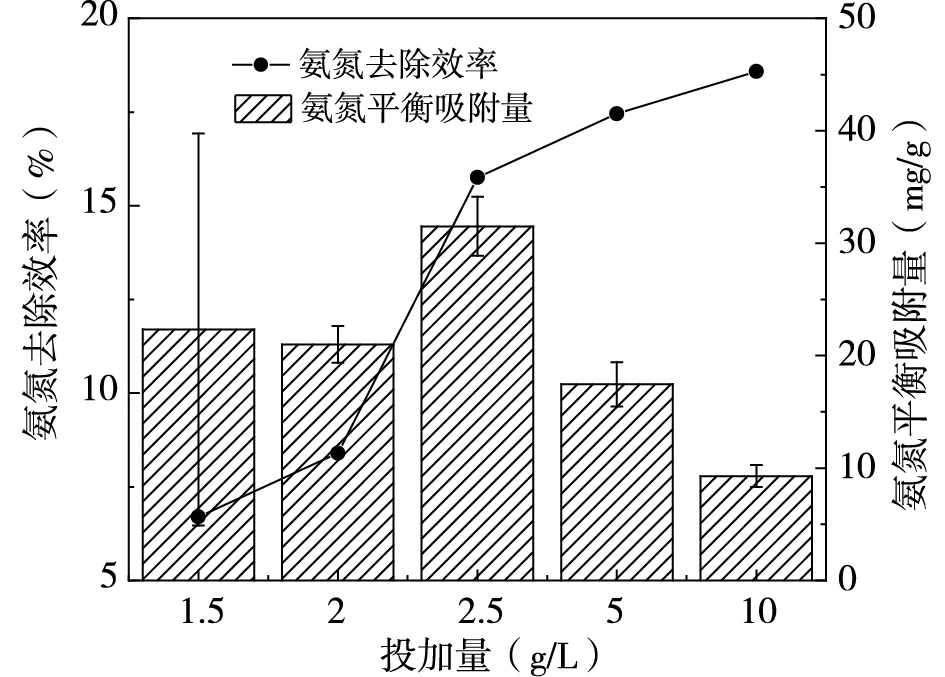
配置溶液氮磷濃度分別為500mg/L、25mg/L(氮磷比20:1),在pH=7,無共存離子情況下,探究不同吸附劑投加量對氮磷去除效率與吸附量的影響,結果如圖1所示。
(a)吸附劑投加量對磷去除效率與吸附量的影響
(b)吸附劑投加量對氨氮去除效率與吸附量的影響圖1 吸附劑投加量對氮磷去除的影響
由圖1(a)可知,磷去除率隨著投加量的增加而不斷升高,但由于磷濃度較低且去除率在90%以上,磷被分散在吸附劑上,造成平衡吸附量降低,因此選擇低投加量最佳。圖1(b)顯示,氨氮去除率由6.70%增加至18.58%,在2.5g/L時氨氮平衡吸附量最大。吸附劑同時吸附氮磷時,兩種物質相互影響會導致其吸附量變化,為實現吸附量以及經濟效益最大化,選擇2.5g/L為吸附劑最佳投加量。
2.2 初始pH對氮磷去除影響
配置溶液氮磷濃度分別為500mg/L、25mg/L(氮磷比20:1),在吸附劑投加量為2.5g/L,無共存離子情況下,探究不同溶液pH對氮磷吸附量的影響,結果如圖2所示。
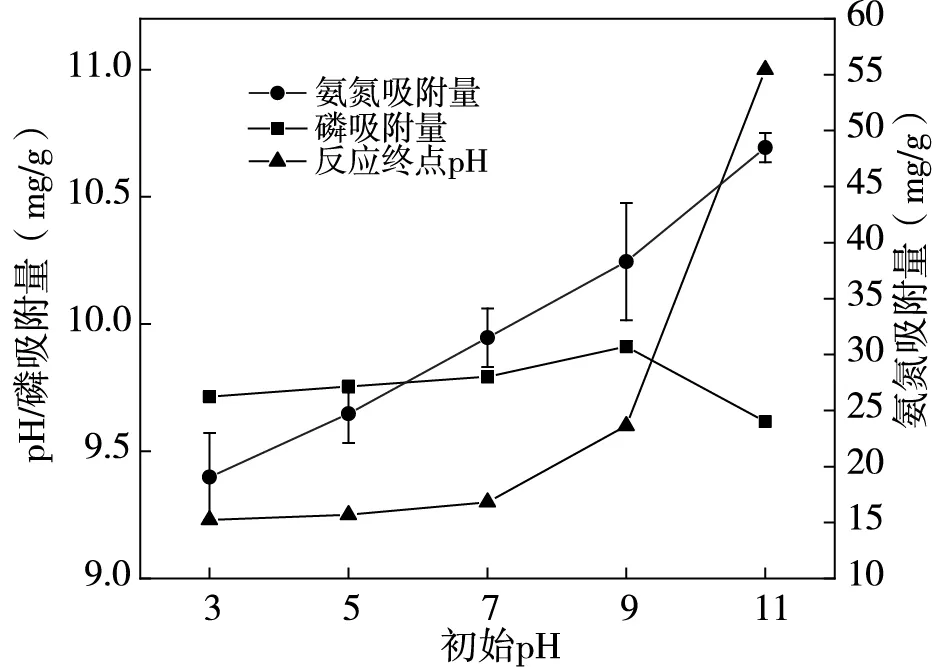
圖2 初始pH對氮磷去除的影響
由圖2可知,磷平衡吸附量在pH為3~9時小幅度上升,氨氮吸附量在pH為3~11區間內持續上升,由19.05mg/g升至48.47mg/g,提升幅度較大。pH值升至11時,溶液中NH4+會轉化為NH3,因此氨氮實際吸附量將低于測量值。在堿性環境下,PO43-、Mg2+、OH-之間會互相反應生成沉淀,磷酸銨鎂反應減弱,造成磷吸附量減小[6]。高pH環境中吸附劑表面電負性增強,靜電排斥作用增加,也會導致磷的吸附能力降低[7]。反應終點pH隨著初始pH的升高而升高,在初始pH=3時,終點pH在9以上,表明吸附材料具有自堿性,在溶液中會釋放OH-,為氮磷的去除提供保障。綜合氮磷吸附量,表明pH=9為磷、氨氮吸附最佳pH。
2.3 共存離子對氮磷去除影響
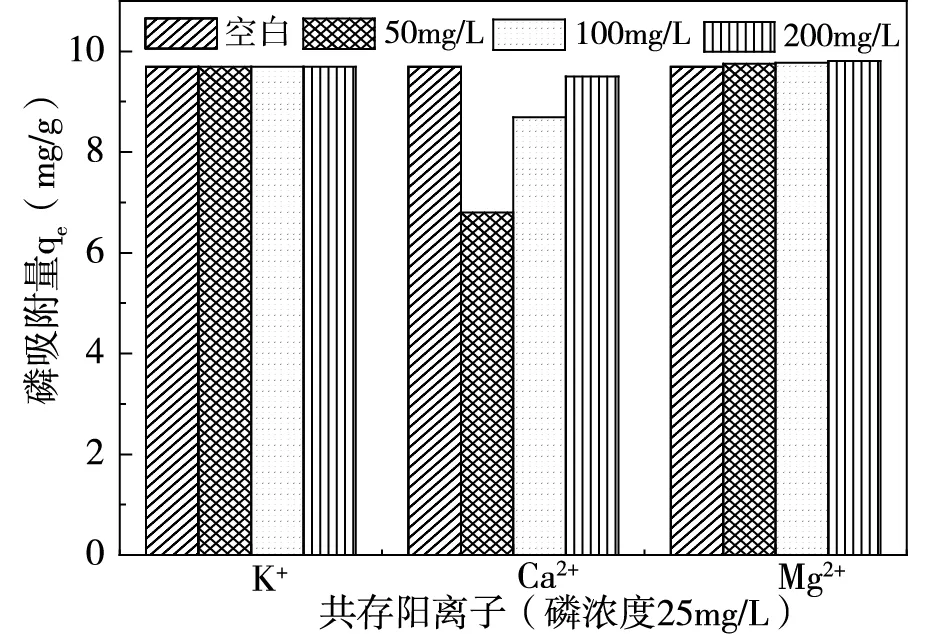
配置溶液氮磷濃度分別為500mg/L、25mg/L(氮磷比20:1),在pH=7,吸附劑投加量為2.5g/L情況下,探究不同濃度共存離子對氮磷吸附量的影響,結果如圖3、圖4所示。
(a)共存陽離子對磷吸附量的影響
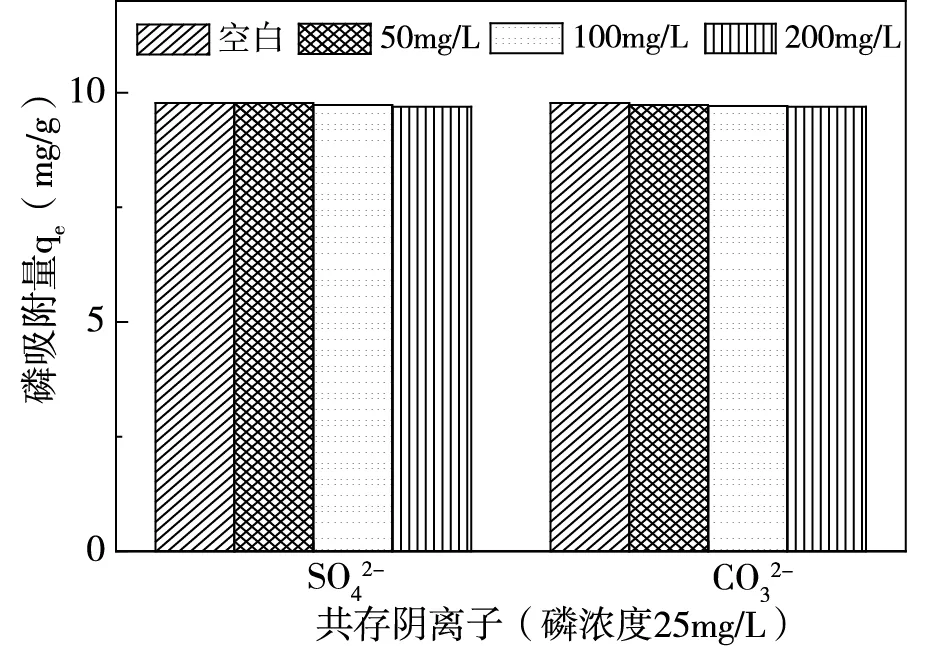
(b)共存陰離子對磷吸附量的影響圖3 共存離子對磷去除的影響
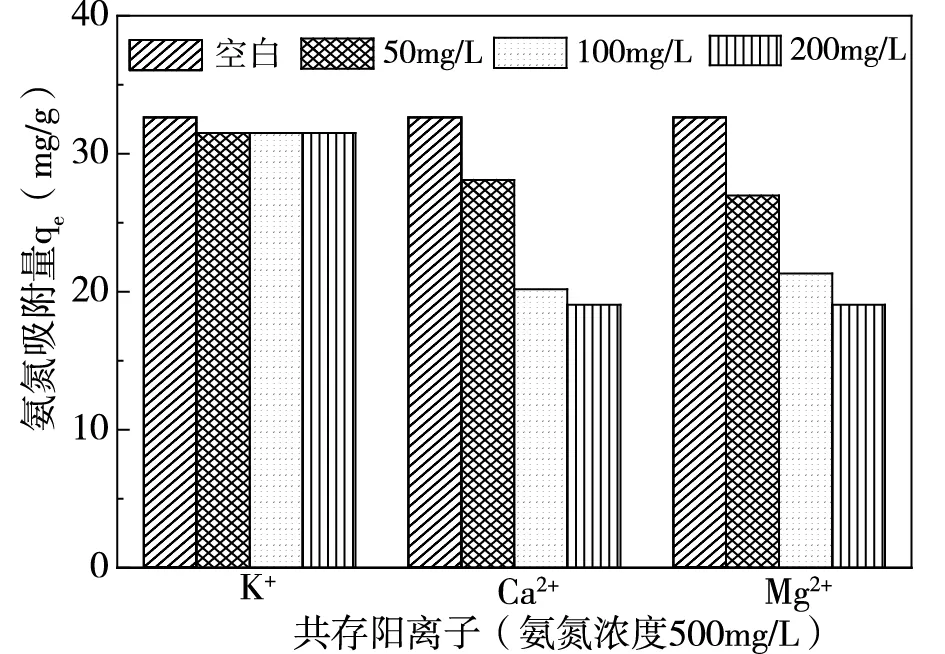
(a)共存陽離子對氨氮吸附量的影響
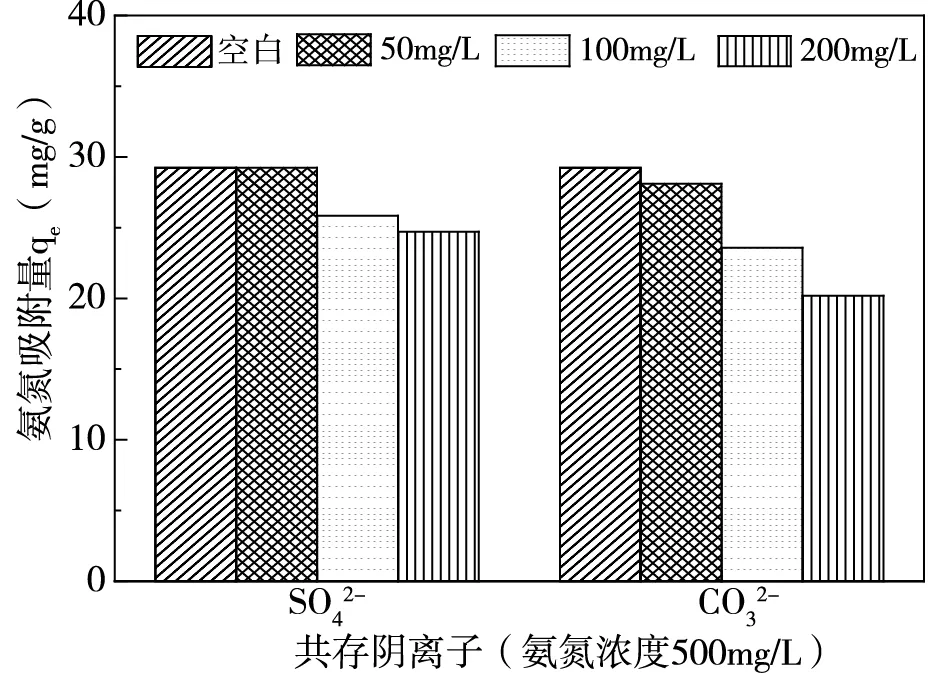
(b)共存陰離子對氨氮吸附量的影響圖4 共存離子對氨氮去除的影響
由圖3(a)可知,陽離子中K+對磷吸附無明顯影響,Mg2+對磷吸附起積極作用,Ca2+通過與磷反應從而使磷的吸附量上升[8]。圖3(b)顯示,SO42-與CO32-兩種陰離子對磷的去除無明顯影響,表明陰離子與磷之間的競爭作用不強。由圖4可知,共存離子對氨氮的吸附均存在抑制作用,K+與NH4+之間由于競爭作用導致氨氮吸附量減小,Ca2+、Mg2+與NH4+產生競爭的同時會阻礙磷酸銨鎂反應[8]。陰離子則會與溶液中NH4+、Mg2+反應結合[9-10],阻礙磷酸銨鎂反應從而使氨氮的吸附量下降。
2.4 氮磷比對氮磷去除影響
在pH=7,吸附劑投加量為2.5g/L,無共存離子情況下,探究不同氮磷濃度對氮磷吸附量的影響,結果如圖5所示。
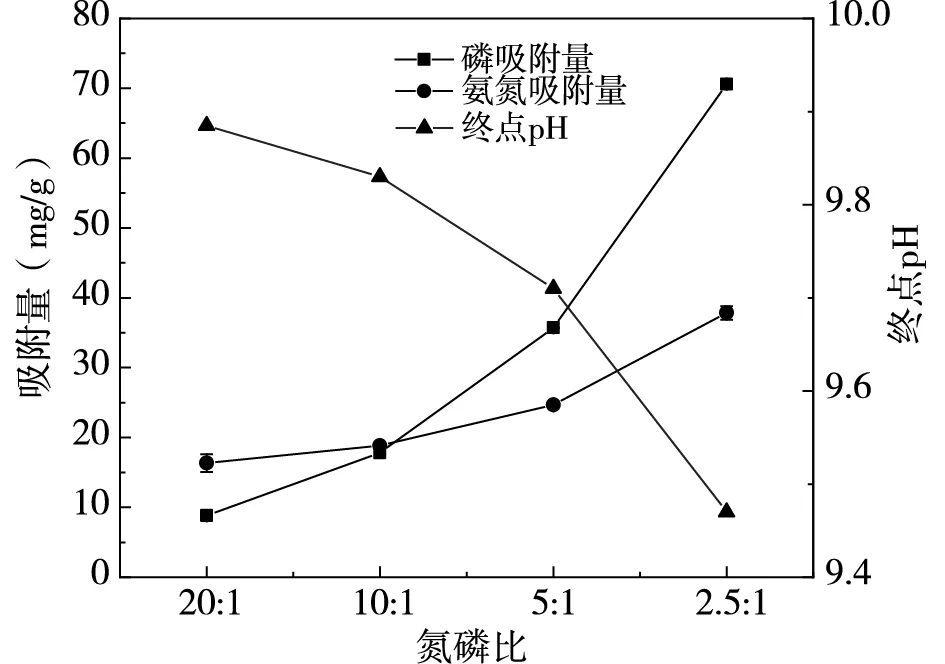
圖5 氮磷比對氮磷去除影響
由圖5可知,隨著氮磷比變化,磷吸附量由8.80mg/g增長至70.58mg/g,氨氮吸附量由16.35mg/g增長至37.83mg/g。磷濃度上升增強了磷酸銨鎂反應從而使氮磷吸附量增加,這與郅蒙蒙[11]對鎂改性生物炭在不同氮磷比條件下對氮磷去除效果的研究結論一致。溶液終點pH隨著氮磷比的增加而減小是由于磷酸銨鎂在反應過程中需要消耗溶液中OH-,表明此時磷酸銨鎂沉淀為氮磷去除的主要方式。
2.5 吸附動力學
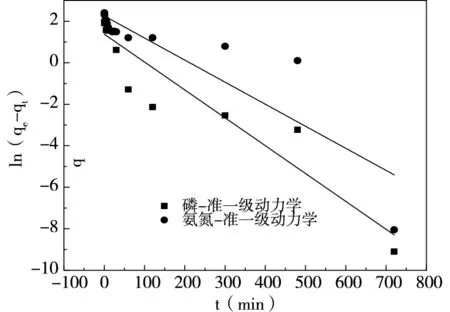
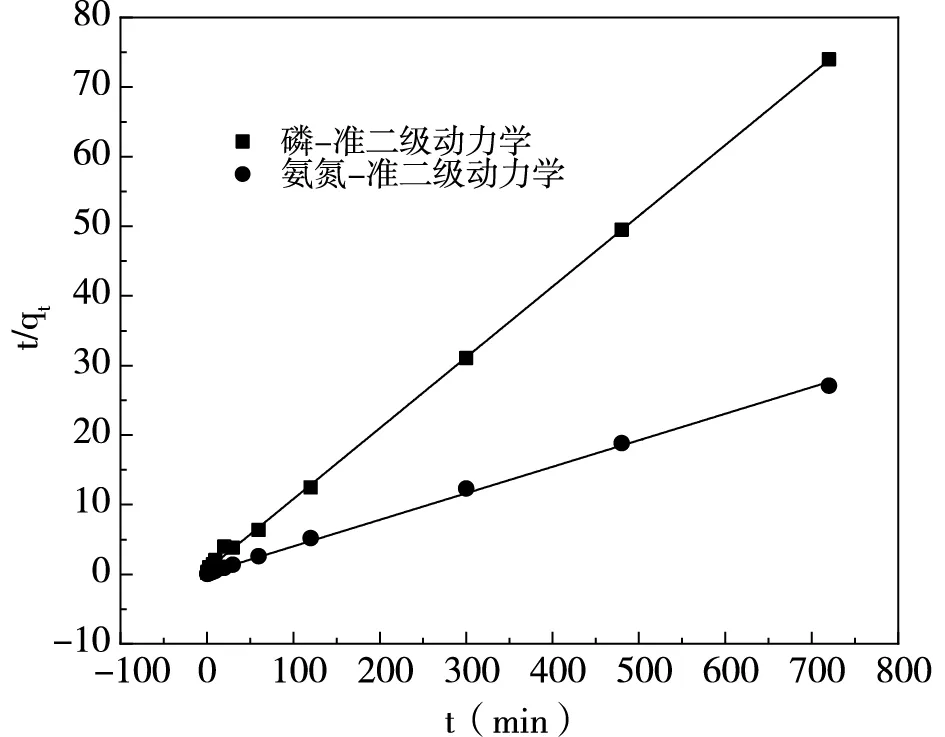
按照1.2.2內容進行實驗,采用準一級動力學(式3)與準二級動力學(式4)對吸附數據進行擬合,結果如圖6、表1所示。
ln(qe-qt)=lnqe-K1t
(3)
(4)
式中:qe為吸附平衡時吸附量,mg/g;qt為t時的吸附量,mg/g;K1為準一級動力學反應速率常數;K2為準二級動力學反應速率常數。
(a)準一級動力學擬合
(b)準二級動力學擬合圖6 氮磷的吸附動力學擬合

表1 氮磷的吸附動力學參數
由表1和圖6可知,氮磷的準二級動力學R2>0.99,并且準二級動力學氮磷的實際吸附量(qe)與計算吸附量(qe-cal)相接近,表明準二級動力學可以更好地描述磷和氨氮的吸附過程,即氧化鎂改性凹凸棒土吸附沼液中磷與氨氮的過程受化學吸附機理控制[12]。
2.6 吸附等溫模型
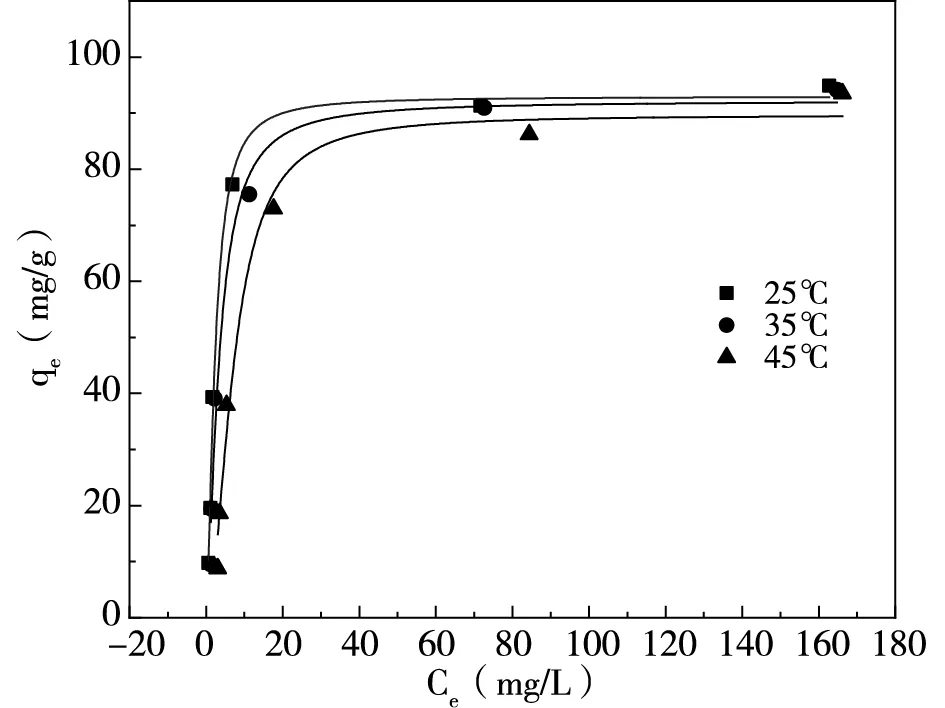
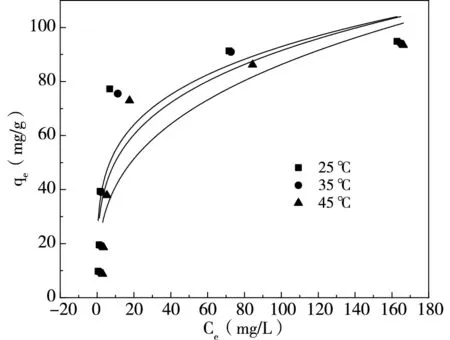
按照1.2.3內容進行實驗,采用Langmuir模型(式5)與Freundlich模型(式6)對吸附數據進行擬合,改性凹凸棒土對磷吸附結果如圖7、表2所示,對氨氮吸附結果如圖8、表3所示。
(5)
(6)
式中:Ce為吸附平衡時吸附質濃度,mg/L;qe為平衡吸附量,mg/g;qm為理論飽和吸附量mg/g;KL為Langmuir模型吸附常數,L/mg;KF、n為Freundlich模型吸附常數。
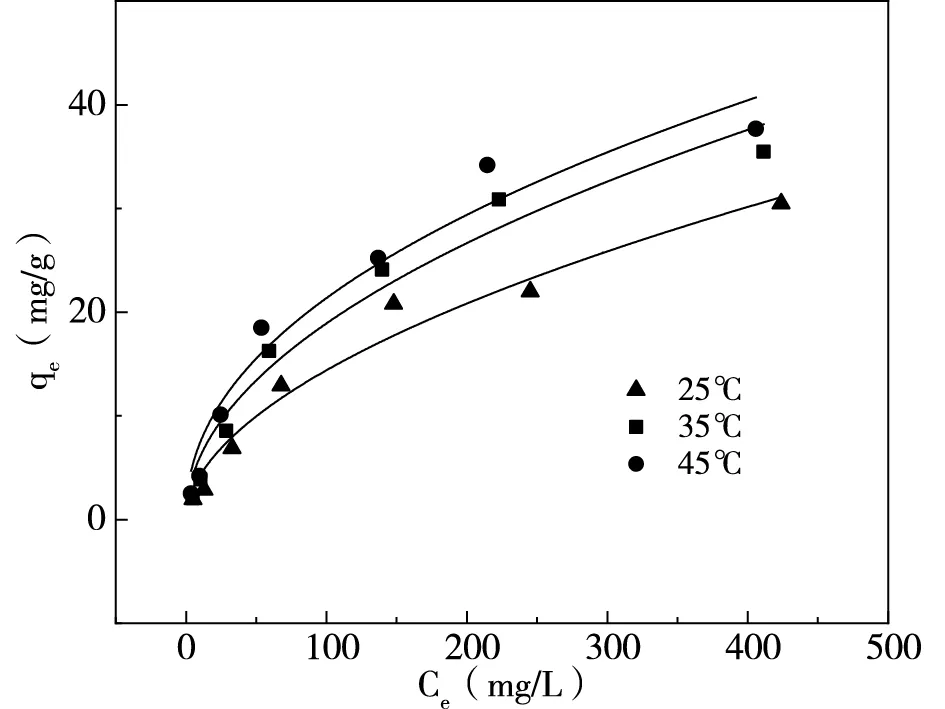
(a)Langmuir等溫模型
(b)Freundlich等溫模型
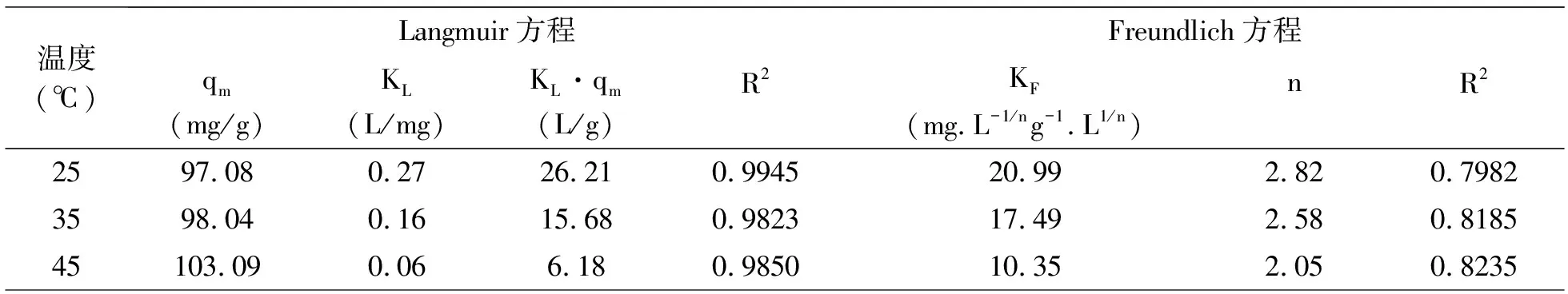
表2 氧化鎂改性凹凸棒土吸附除磷的吸附等溫參數
由圖7與表2可知,Langmuir模型R2在三種溫度下均高于Freundlich模型,表明Langmuir模型更能很好地描述吸附劑吸附磷的過程,為單層吸附[13],并且25℃下磷最大吸附容量可達97.08mg/g。KL·qm為緩沖容量,可以一定程度反映當前條件下體系的緩沖能力。在三種溫度下,25℃時緩沖容量最大,當溫度升高,緩沖容量降低,可見常溫下緩沖能力較強。

(a)Langmuir等溫模型
(b)Freundlich等溫模型
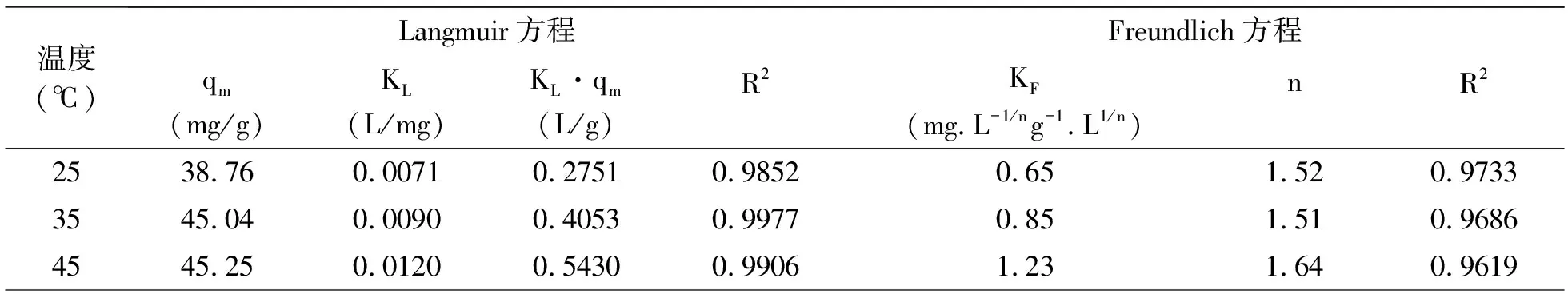
表3 氧化鎂改性凹凸棒土吸附除氨氮的吸附等溫參數
由圖8與表3可知,在三種溫度下Langmuir模型R2>0.98,Freundlich模型R2>0.96,都有較高擬合度。Langmuir模型R2更接近1,表明吸附劑吸附氨氮的過程更符合Langmuir模型,吸附氨氮過程屬于單層吸附,這與郭俊元[14]的研究結果一致,并且25℃下氨氮最大吸附容量可達38.76mg/g。緩沖容量KL·qm值隨著溫度的升高而增大,可見常溫下緩沖能力較弱。Freundlich模型參數中,n代表吸附質與吸附劑之間的結合能力,0<1/n<1則吸附過程易發生,1/n>2則難以吸附。本研究的1/n均小于1,表明對氨氮的吸附容易進行[15]。
2.7 機理分析
利用鹽、堿、酸分別提取弱結合態磷、鐵鋁結合態磷以及鈣結合態磷,三種形態磷分別涉及靜電吸引、配位作用、化學沉淀等機制[16-18],結果如圖9所示。
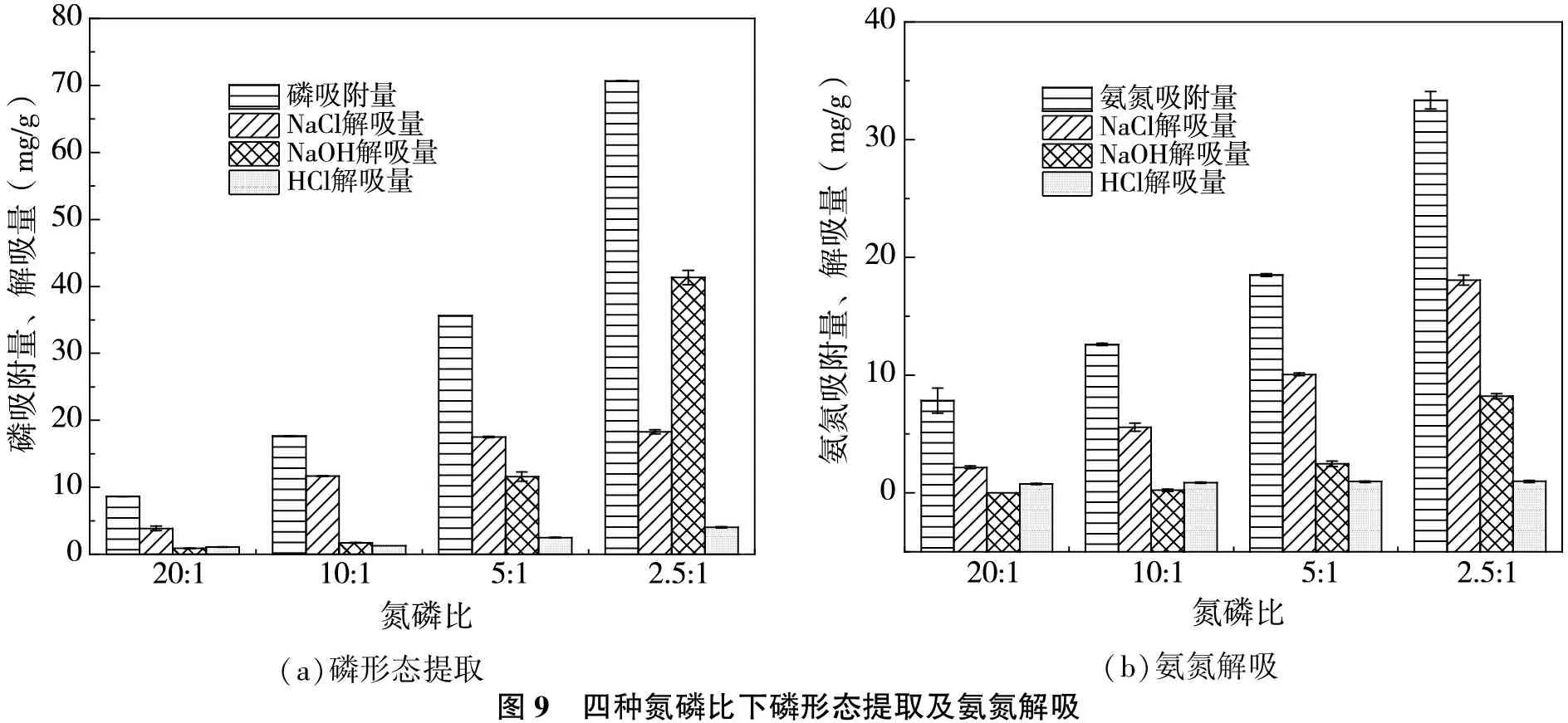
(a)磷形態提取(b)氨氮解吸圖9 四種氮磷比下磷形態提取及氨氮解吸
由圖9(a)可知,提取磷以弱結合態磷與鐵鋁結合態磷為主,鈣結合態磷占比較少。酸、堿性溶液會使磷酸銨鎂沉淀分解與溶解,因此鐵鋁結合態磷與鈣結合態磷的增加,暗示了磷酸銨鎂含量的增加。圖9(b)顯示,隨著氨氮吸附量的增加,三種試劑對氨氮的解吸量增加,其中鹽解吸氨氮為離子交換作用,酸堿解吸氨氮為磷酸銨鎂化學沉淀作用。綜合磷形態提取與氨氮解吸情況,表明磷通過靜電吸引、配位作用、化學沉淀等作用被去除,氨氮通過離子交換與化學沉淀作用被去除,并且不同機理作用在氮磷比的影響下有所變化。
改性凹凸棒土吸附后XRD表征如圖10(a)、圖10(b)所示,FTIR表征如圖10(c)所示。
由圖10(a)、圖10(b)可知,20:1組吸附后在2θ為15.80°、16.46°、20.85°、21.45°、27.08°、31.91°、33.27°處出現明顯的MgNH4PO4·6H2O衍射峰,2.5:1組吸附后在14.42°、15.81°、16.45°、20.86°、21.46°、27.10°、30.62°、31.93°、33.26°處有更明顯的MgNH4PO4·6H2O衍射峰。通過對比發現,兩組在相同角度重合,2.5:1組的衍射峰更加明顯、特征峰強度更大,表明磷濃度上升,磷酸銨鎂含量增加。由圖10(c)可知,3436cm-1附近吸收峰是由表面吸附的水所形成的-OH的伸縮振動,1635cm-1附近特征峰是凹凸棒土結構中吸附水或沸石水的彎曲振動峰。1439cm-1與1022cm-1處分別對應氨氮與磷的特征峰[19,20],氨氮特征峰加強,表明更多氨氮被吸附。在454cm-1處與MgO相關的特征峰[20]在吸附后強度有所減弱,表明MgO在不同環境條件下都參與吸附過程,進一步證明鎂在氮磷去除起到關鍵作用,磷酸銨鎂沉淀為氮磷去除的主要方式之一。
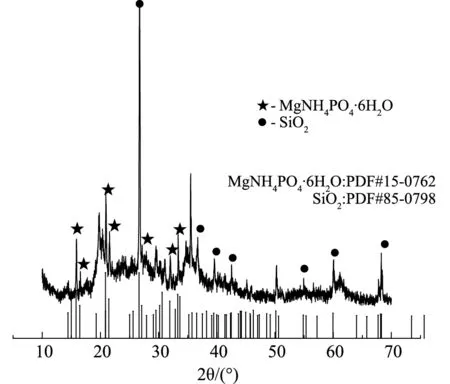
(a)氮磷比為20:1時的XRD
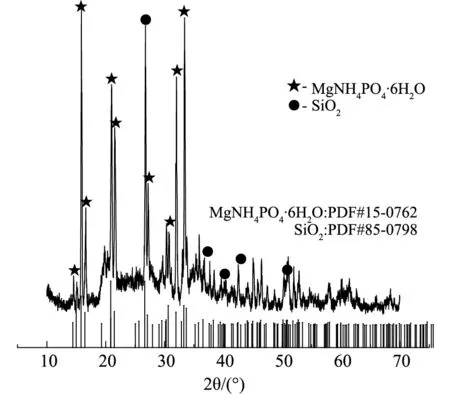
(b)氮磷比為2.5:1時的XRD
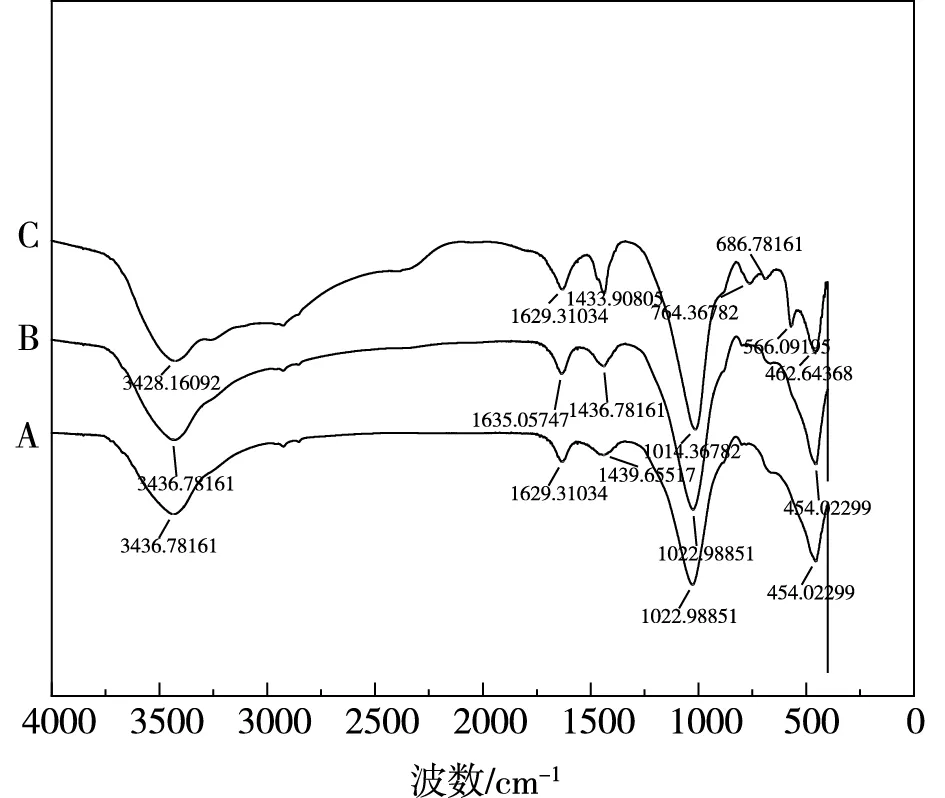
(c)A吸附前FTIR,B氮磷比為20:1時的FTIR,C氮磷比為2.5:1時的FTIR圖10 不同狀態下吸附劑的X射線衍射圖譜與紅外光譜
3 結論
利用氧化鎂改性凹凸棒土為吸附劑,對模擬沼液中氮磷污染物同時進行吸附去除。探究了吸附劑投加量、pH、共存離子、氮磷比等因素對氮磷去除的影響,并通過吸附等溫模型、吸附動力學、XRD、FTIR等手段進一步分析其吸附特性與吸附機理,結果表明:
(1)氧化鎂改性凹凸棒土投加量為2.5g/L、pH=9時氮磷吸附量最大,Ca2+對磷的去除有促進作用,Ca2+、Mg2+、CO32-、SO42-等離子都會抑制氨氮的去除。氮磷比接近1:1時氮磷吸附量最大,磷吸附量可達70.58mg/g,氨氮吸附量可達37.83mg/g。
(2)準二級動力學可以很好地描述氮磷吸附過程,表明氧化鎂改性凹凸棒土吸附氮磷為化學吸附。吸附等溫模型中,氮磷的吸附更符合Langmuir等溫模型,表明吸附過程為單層吸附。
(3)氧化鎂改性凹凸棒土對氮磷去除機理包括靜電吸引、離子交換、配位作用、化學沉淀等,其中磷酸銨鎂化學沉淀在氮磷去除中起到關鍵作用。

