不同來源的外泌體對特發性肺纖維化的免疫調節作用
吳佳敏 張煒 張興 陳麒
特發性肺纖維化(IPF)是一種慢性進行性的間質性肺病,其主要特點是肺部纖維化、呼吸困難加重、肺功能下降以及病死率高。目前認為IPF 的發病機制主要與上皮細胞的反復損傷、異常組織損傷修復導致纖維化和膠原蛋白的積累等相關,研究表明炎癥細胞與成纖維細胞間的相互作用可促進IPF 的發生與發展。此外,作為信息交流載體的外泌體在IPF 過程中的作用越來越受到研究者的關注,其可通過炎癥反應或免疫調節傳遞抑制或促進纖維化的物質來參與IPF 的發展。為了解外泌體在調節IPF 的形成與發展中的作用機制,本文就不同細胞來源的外泌體在IPF 中的研究進展進行綜述。
一、外泌體的形成和功能
目前細胞外囊泡根據其生成方式主要分為3大類:外泌體、微囊泡和凋亡小體。其中外泌體是由細胞膜向內生成內吞的囊泡,隨后形成囊泡腔,并在囊泡腔中形成體積更小的腔內囊泡,這些囊泡或是在細胞中降解、或是通過胞吐的方式釋放于細胞外(圖1)。外泌體的膜結構中包含一系列特殊的表面蛋白,如膜轉運/融合蛋白、熱休克蛋白和四跨膜蛋白等。免疫功能是外泌體所執行功能中的一個重要方面,在不同的病理因素刺激下,細胞產生的外泌體中所攜帶的物質和執行的功能皆會發生變化,呈現出一定的特異性,就目前的研究而言,這一形成過程的具體機制還有待進一步挖掘。
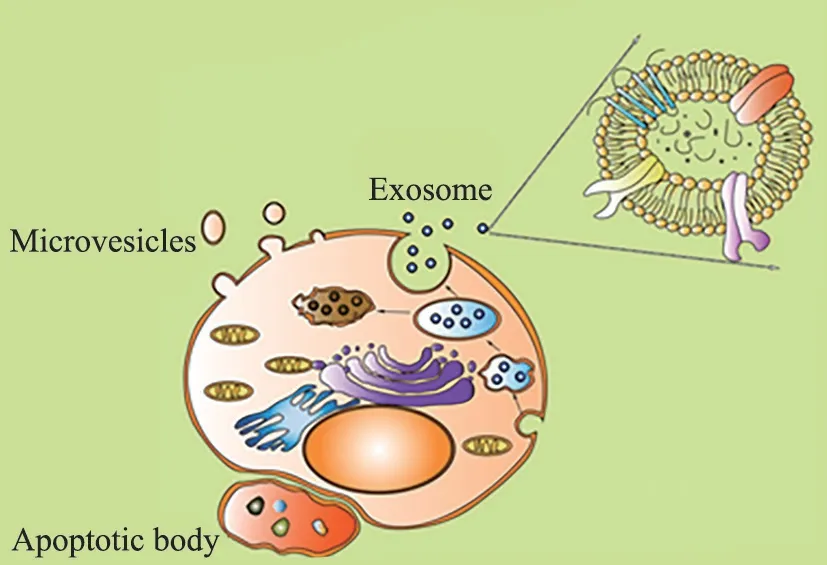
圖1 細胞外囊泡的產生和釋放
二、IPF 的炎癥免疫反應
成纖維細胞參與IPF 過程的理論已被廣泛接受,由于抗炎藥物及免疫抑制劑在IPF 治療過程中療效欠佳,有研究者認為炎癥免疫機制可能并非是導致IPF 的直接機制。但也有研究者發現免疫細胞通過與成纖維細胞相互作用從而影響IPF 的形成與發展。IPF 患者肺部2 型輔助性T 淋巴細胞(Th2)產生的細胞因子(如IL-4、IL-5 和IL-13) 增多,其中IL-4 和IL-13 可促進巨噬細胞活化,誘導巨噬細胞Fra-2 的表達。Fra-2 是人類IPF 的致病因素之一。另外,炎癥因子可刺激成纖維細胞的增殖及膠原蛋白的合成,從而加速IPF 的進程。免疫細胞與肺成纖維細胞的作用呈雙向性,被激活的纖維細胞可分泌促炎因子(IL-11、IL-6和TGF-β)和趨化因子刺激免疫細胞介導免疫反應。炎癥細胞與成纖維細胞的相互作用過程中,外泌體作為信號載體,也參與了細胞間的信息交流,從而調節IPF 的形成與發展。
三、不同細胞來源的外泌體對IPF 的作用
近年來,外泌體在纖維化疾病中的作用越來越受到學者們的重視,通常不同細胞分泌的外泌體攜帶各種信息,包括炎癥因子、微RNA(miR)和基質蛋白等,參與IPF 的各個過程。
1. 肺成纖維細胞來源的外泌體對IPF 的作用
IPF 表現為成纖維細胞樣細胞外基質(ECM)的擴展以及正常肺結構和功能的喪失。成纖維細胞轉化為肌成纖維及ECM 積累是造成IPF 的直接因素,而肺成纖維細胞衍生的外泌體可影響肺部其他細胞,從而促進IPF。目前研究顯示,激活Wnt 蛋白介導的信號通路(如Wnt/β-catenin)也可促進IPF。人肺成纖維細胞來源的外泌體富含Wnt5A,其可誘導肺成纖維細胞增殖。轉化生長因子-β(TGF-β)作為關鍵的纖維化細胞因子,可刺激肺成纖維細胞中Wnt 分泌所需的穿梭蛋白G 蛋白偶聯受體177(GPR177)生成增加,進一步誘導Wnt5A 分泌增多。肌成纖維細胞可產生載有TGF-β 和Wnt/β-catenin 信號分子的外泌體將纖維化信號傳至成纖維細胞,誘導其向肌成纖維細胞轉化。此外,外泌體還可通過激活Wnt/β-catenin 信號通路調節巨噬細胞活化從而促進IPF 發生發展。
2. 巨噬細胞來源的外泌體對IPF 的作用
巨噬細胞是人體內固有免疫細胞之一,巨噬細胞在IPF 過程中的作用受到了廣泛關注。一方面,巨噬細胞可分泌多種促進纖維化的細胞因子(如TGF-β 和IL-13)。另一方面,其與成纖維細胞的相互作用,被認為是IPF 的“調節者”。在急性肺損傷(ALI)過程中,巨噬細胞是肺泡灌洗液中外泌體的重要來源,而外泌體中攜帶多種促炎因子,其可激活嗜中性粒細胞分泌攜帶IL-10的外泌體,而IL-10 反過來刺激巨噬細胞極化,這可能是導致ALI 后纖維化的原因。攜帶miR 是巨噬細胞來源外泌體的另一種重要的作用形式。如富含miR-155 的外泌體在巨噬細胞活化后明顯增加,而這些外泌體可轉移至成纖維細胞中,并促進成纖維細胞表達炎癥因子(如IL-1β、IL-6 和TNF-α等)。巨噬細胞除了產生炎癥因子誘導其他細胞增殖釋放基質成分外,還可通過外泌體攜帶并分泌ECM。有學者用博來霉素建立IPF 模型,其中巨噬細胞對于Fra-2 和Ⅵ型膠原蛋白(Col Ⅵ)基因的表達上調,且巨噬細胞來源的外泌體中檢測到Col Ⅵ的3 條肽鏈(α1、α2 和α3)。無獨有偶,Tsitoura 等通過免疫熒光法同樣發現膠原蛋白1a 主要在肺泡巨噬細胞中過度表達。由此可見,巨噬細胞來源的外泌體可攜帶趨化因子和炎癥因子來募集成纖維細胞及其他炎性細胞,直接刺激成纖維細胞轉化為肌成纖維細胞,甚至將膠原蛋白運輸至細胞外。
3. 間充質干細胞(MSC)來源的外泌體對IPF的作用
目前IPF 的治療手段有限且預后差,因此學者在尋找更有效的治療方式時將目光轉向MSC 移植。MSC 是一類具有自我更新和多向分化潛能的多能干細胞,具有減少膠原蛋白等的沉積,改善IPF 的程度,降低肺部炎癥指標等作用,并被應用于IPF 的治療。現有研究表明,在IPF 過程中,MSC 可通過抑制Smad-3 /TGF-β 介導的信號通路,下調炎癥因子(TNF-α、IL-6)的表達來發揮抗炎作用。MSC 的具體作用機制被認為主要是細胞外囊泡(包括外泌體)的旁分泌。目前研究表明,MSC 可以分泌具有免疫活性的外泌體,并通過外泌體調節肺巨噬細胞表型,促炎性經典活化巨噬細胞受到抑制,而與之相互拮抗的替代性活化巨噬細胞得到激活,進而起到抑制肺部炎癥和免疫反應的作用。Mansouri 等研究也發現在博來霉素誘導的IPF 模型中,MSC 來源的外泌體(MEx)可使促炎性經典單核細胞比例減少,而非經典單核細胞比例增加,改善肺部形態,減少膠原蛋白沉積并恢復肺部結構,甚至MEx 可直接干預骨髓來源的單核細胞向非經典單核細胞轉變。目前多項體內、體外研究的數據均表明MSC可通過抑制促炎途徑和上調抗炎途徑來預防和治療IPF,MSC 在IPF 患者的治療中也表現出正面作用。因此,MSC 有望成為IPF 患者安全有效的治療方式之一。
4. 其他來源的外泌體對IPF 的作用
肌成纖維細胞一直是IPF 研究的關鍵點,周細胞是肌成纖維細胞的主要來源之一。周細胞是存在于體內血管化組織中的多能細胞,參與免疫應答的調節。在炎性細胞因子的刺激下,周細胞可分泌大量趨化因子和細胞因子并將免疫細胞吸引至炎癥部位,還可促進免疫細胞的跨內皮遷移。在肺纖維的臨床或實驗研究中,肺微血管內皮細胞來源的外泌體中,miR-107 均下調,并與周細胞誘導的纖維化相關。另有學者在IPF 模型小鼠的支氣管-肺泡灌洗液中分離出含有let-7d 的外泌體,可直接靶向和抑制TGF-β 受體1,發揮其調節肺周細胞纖維化相關信號通路和基因表達的作用。
四、小 結
體內大多數細胞均可產生外泌體,且可從各種體液中分離獲得。外泌體被廣泛認為是各種生理病理情況下細胞間信息傳遞的重要載體。在IPF過程中,根據不同細胞來源,外泌體可攜帶促進或者抑制肺纖維形成的物質,發揮截然相反的作用,這一功能尤其表現在免疫細胞之間或者其他細胞與免疫細胞之間。但是目前對于外泌體的研究并不局限于此,最新研究表明吸入肺干細胞來源的外泌體可促進IPF 小鼠的肺修復。隨著對IPF 研究的深入,外泌體或將成為臨床治療IPF 的重要途徑。

