基于2019版Bosniak分級系統對腎囊性病變的MSCT與病理對照研究
周航,胡杉,李樹榮,姚浩華,陳煒,陳凌武,陳旭
隨著超聲和放射等影像檢查的普及應用,近年來腎囊性病變的檢出率明顯增高[1],對于不典型惡性腎囊性病變的鑒別診斷是影像診斷難點[2]。近年來影像學檢查在腎疾病診斷上進展迅速[3],以CT影像表現為基礎創立的Bosniak分級系統,臨床上一直被泌尿外科醫師作為術前影像鑒別惡性腎囊性病變的重要依據[4]。該系統自1986年被提出以來,經過多次更新和修訂。由于部分腎囊性病變介于Ⅱ級和Ⅲ級之間,且可以觀察隨訪到18%(12%~26%)囊腫的惡變,Bosniak等在1993年修訂并增加IIF級病變的描述,該類患者通常被要求長達5年、每隔6或12個月的影像學隨訪。該分級系統在2019年再次被修訂和更新,旨在達到提升觀察者間一致性、增加影像客觀指標等目的[5]。為了研究新版分級系統在臨床實踐決策中的應用價值,筆者通過對本中心經MSCT診斷為腎囊性病變患者的影像及臨床病理資料進行回顧性分析,運用2019版標準對圖像進行再次評級,旨在為合理應用該新分級標準對腎囊性病變制定臨床治療方案提供依據。
材料與方法
1.病例資料
搜集2012年1月-2020年12月于中山大學附屬第一醫院就診并行手術治療的腎囊性病變患者共140例作為研究對象,排除3例實性成分>25%的病例后,對137例患者的年齡、性別、囊腫位置、大小和術后病理結果等臨床資料進行回顧性分析。
2.研究方法
所有患者均在中山大學附屬第一醫院完成術前雙腎平掃、增強CT檢查。CT檢查采用64層螺旋CT掃描儀(Aquilion 64,佳能醫療系統公司),掃描參數:層厚0.5 mm,層間距0.5~1 mm,管電壓120 kV,管電流200 mA。所有患者在CT檢查前30 min排空膀胱并飲用600 mL水,掃描范圍為左側膈頂至恥骨聯合處。CT增強掃描通過肘靜脈注射劑量為1 mL/kg的對比劑(Iopromide,370 mg I/mL,德國Bayer Schering公司),注射流率3 mL/s,隨后以相同流率連續注射生理鹽水(40 mL);觸發閾值預設為250 HU,患者屏息,進行皮質期圖像采集。皮質期采集后30 s、100 s分別采集腎髓質期和排泄期圖像。MSCT圖像由甲、乙兩位具有5年以上CT診斷工作經驗的影像科醫生采用2019版Bosniak分級標準進行背對背評級。
3.統計學分析
采用SPSS 25.0軟件進行統計學分析。采用χ2檢驗比較腎囊性病變良性與惡性組間臨床資料的差異;采用Kappa值分析兩位醫師對圖像評估的一致性。將Bosniak分級與病理結果比較計算出診斷惡性病變的敏感度、特異度并繪制受試者工作特征 (receiver operating characteristic,ROC)曲線。將約登指數最大值所對應的Bosniak分級定為鑒別腎囊性病變良、惡性的臨界值。以P<0.05為差異有統計學意義。
結 果
137例腎囊性病變(圖1~3)中69例為惡性,其中腎透明細胞癌50例,乳頭狀腎細胞癌8例,腎嫌色細胞癌3例,未分型腎細胞癌4例,腎混合性上皮間葉腫瘤1例,低度惡性潛能多房囊性腎腫瘤3例;68例為良性,其中腎單純性囊腫64例,囊性腎瘤1例,腎血管平滑肌脂肪瘤1例,重復腎畸形合并積水1例,黃色肉芽腫性腎盂腎炎1例(表1)。將良、惡性腎囊性病變患者的臨床資料進行比較分析,結果顯示惡性腎囊性病變中男性更多,差異有統計學意義(P=0.017),其他指標如年齡、病變位置、囊腫直徑等在腎囊性良、惡性病變兩組間差異均無統計學意義(P>0.05,表2)。
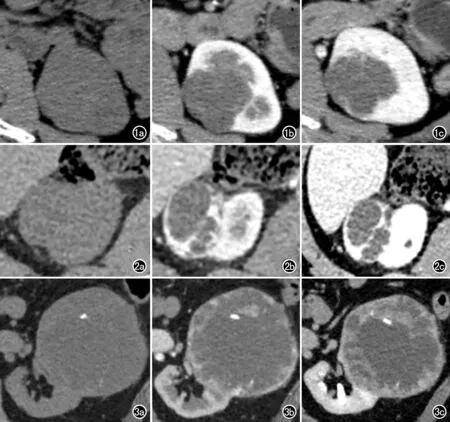
圖1 術后病理為腎透明細胞癌,醫師乙評級結果為BosniakⅡF級囊性病變。a) CT平掃圖像; b) 增強掃描皮質期圖像; c) 增強掃描髓質期圖像。 圖2 術后病理為腎透明細胞癌,醫師乙評級結果為Bosniak Ⅲ級囊性病變。a) CT平掃圖像; b) 增強掃描皮質期圖像; c) 增強掃描髓質期圖像。 圖3 術后病理為腎透明細胞癌,醫師乙評級結果為Bosniak Ⅳ級囊性病變。a) CT平掃圖像; b) 增強掃描皮質期圖像; c) 增強掃描髓質期圖像。
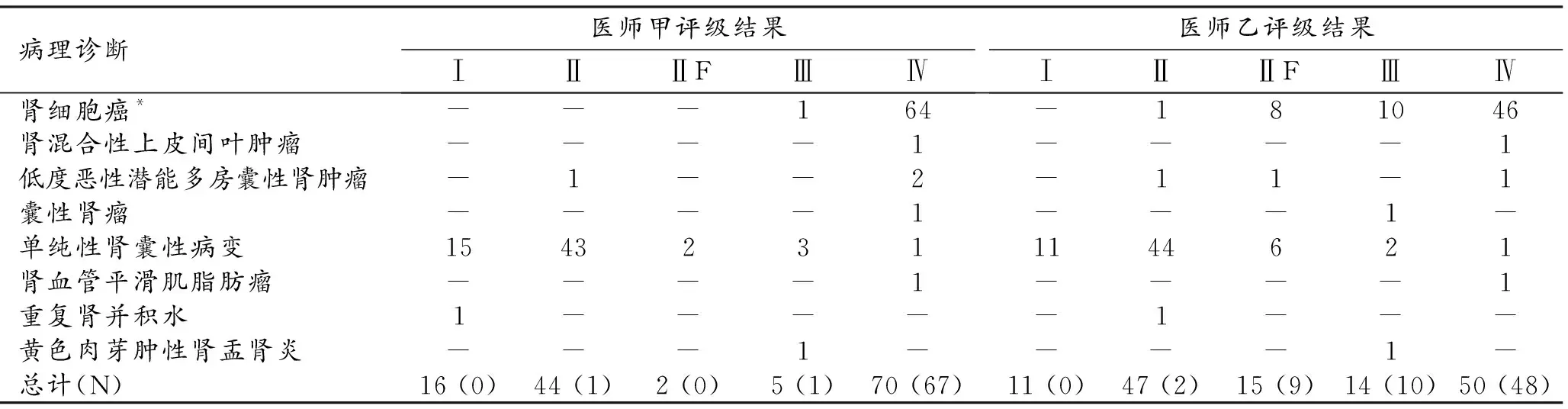
表1 Bosniak評級與術后病理結果對比 (例)
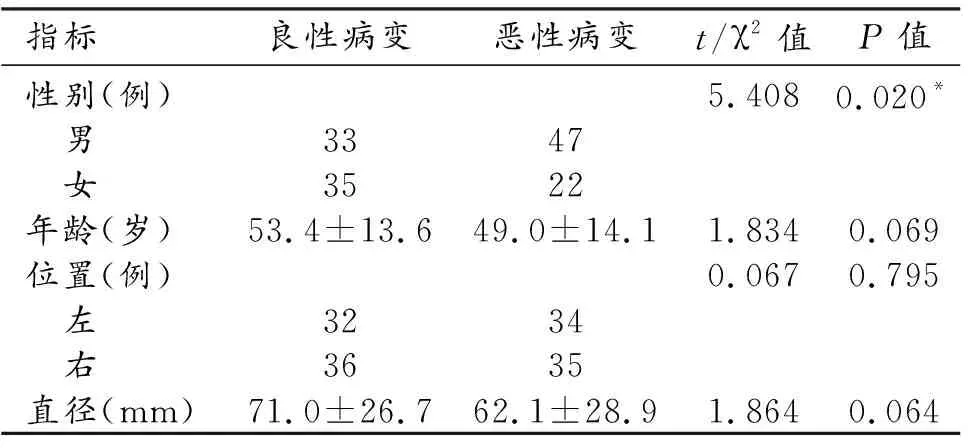
表2 良、惡性囊性病變兩組間患者的臨床資料比較
醫師甲分級診斷結果(括號內為術后病理為惡性腫瘤的例數)為:Ⅰ級16例(0),Ⅱ級44例(1),ⅡF級2例(0),Ⅲ級5例(1),Ⅳ級70例(67);醫師乙的分級診斷結果為:Ⅰ級11例(0),Ⅱ級47例(2),ⅡF級15例(9),Ⅲ級14例(10),Ⅳ級50例(48)。兩位醫師評價圖像的一致性為中等(Kappa=0.597,P<0.001,表1)。
兩位醫師通過新版分級系統診斷腎惡性囊腫的ROC曲線下面積(area under curve,AUC)分別為0.971、0.949;醫師甲以Bosniak IV級診斷為惡性囊性病變時所得約登指數最大,其預測腎囊性病變為惡性的敏感度為97.1%,特異度為95.6%。醫師乙以BosniakⅡF級診斷為惡性囊性病變時所得約登指數最大,其敏感度為97.1%,特異度為82.4%(圖4)。
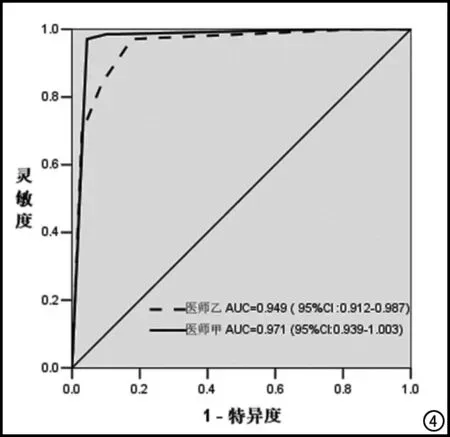
圖4 兩位醫生利用Bosniak分級系統預測惡性囊性病變的ROC曲線。
討 論
腎細胞癌作為泌尿系統常見的惡性腫瘤,其發病率日益增高[6]。近年來腎囊性腫物隨著腹部影像檢查的廣泛應用其檢出率不斷增高,尤其多見于50歲以上人群[7],其中8%~15%是不同于單純腎囊性病變的復雜性病變[8]。由于4 cm以上的腎囊性腫物可能對腎實質造成壓迫或存在惡性成分,一般需要進行外科或超聲介入處理,術前影像對良、惡性的判斷十分關鍵。雖然穿刺病理活檢在許多術前影像學定性困難的腫瘤中有應用價值,但其過程可能會引起囊腫破裂腫瘤種植、出血、感染等[9];另外,囊性病變穿刺所能獲取供病理診斷的組織可能遠少于實性腫瘤[10],因此術期對腎囊性腫物進行穿刺活檢并不被多數學者推薦。1986年,Bosniak提出基于CT影像的腎囊性病變分級系統,為判斷腎囊性病變的良惡性提供了較好的解決方案。但因不同醫生間對該系統的理解和運用存在差異,因此觀察者間一致性較低,尤其在Ⅱ級~Ⅲ級中評級的分歧最明顯,甚至達6%~75%[11]。通過更新,新版分級量化了分級標準[12],將囊壁“發絲樣薄”歸為“薄”,將“薄”、“略增厚”、“厚”分別量化為“≤2 mm”、“3 mm”、“≥4 mm”,適用于Ⅰ/Ⅱ、ⅡF和Ⅲ級;分隔的數量分為“少(1~3個分隔)”與“多(≥4個分隔)”這兩類,適用于Ⅱ~Ⅳ級病變;將不規則增厚定義為“囊壁或分隔上≤3 mm的局灶性或彌漫的凸起,且與囊壁或分隔呈鈍角”,均認為是Ⅲ級病變的特征,同時將結節定義為“≥4 mm與囊壁或分隔呈鈍角的局灶性強化凸起,或者與囊壁或分隔呈銳角的任意大小的局灶性強化凸起”,作為Ⅳ級病變的特征。以上更新有利于提高診斷一致性和降低過度診斷。本研究結果顯示兩位醫師利用新版分級體系診斷的AUC均達到0.90以上,表明新分級系統的診斷效能高。但在臨床實踐中,新標準使得診斷過程較前更繁雜,熟練掌握需要較多病例的積累,特別在甄別ⅡF~Ⅲ級腫瘤時仍存在人為偏差。
通過分析我院137例術前診斷為復雜性囊腫的病例,術后病理結果提示惡性腫瘤69例,其中腎透明細胞癌為最常見的病理類型,占惡性腫瘤的94.1%,低度惡性潛能多房囊性腎腫瘤僅3例,占惡性腫瘤的4.35%。在惡性腫瘤患者中,男性比例較高。由此可見,在囊性腎癌中絕大多數為具有侵襲轉移特點的腎細胞癌。外科處理應該重視無瘤原則,避免操作導致腫瘤破裂,增加腫瘤種植轉移風險。本研究中甲、乙兩位醫生分級評價的一致性為一般(Kappa值為0.597),具有一定的臨床代表性。既往研究報道觀察者對于IIF及III級病變的分級一致性較低,本研究中醫師甲診斷IIF級的例數僅2例,醫師乙診斷IIF級15例,分別對應術后病理為惡性腫瘤的例數為0和9例,惡性率為0%和60%,此結果說明在實踐工作中,部分IV級腫瘤可能潛在地被影像診斷醫師低估為IIF。盡管患者在日后隨訪的過程中可能被重新定級,但不可避免地使患者產生了焦慮情緒和造成醫療資源的浪費;更值得注意的是,保留腎單位手術實施與腫瘤體積有關;在觀察過程中,由于囊腫體積增大,可能導致保腎手術難度增加,因此臨床醫生應持更謹慎態度對待此類過渡型級別的患者。但本研究受到樣本量的限制,Ⅱ~Ⅲ級例數總體偏少,因此結論仍需擴大樣本量行進一步證實。
在大數據時代,將計算機算法與醫學影像有機結合應用于多種腫瘤的定性研究層出不窮。通過對惡性肺結節利用深度學習方法建立分類系統,準確度可高達0.934,幫助臨床醫生高效地篩查診斷惡性肺結節,具有廣闊的應用前景[13]。通過提取CT圖像形態特征、統計學特征及紋理特征構建模型能超越人眼主觀評估,對定量影像特征進行提取、分析和解釋,這種技術在腎實性腫瘤診斷上有較多的應用[14]。相關研究報道利用磁共振圖像建立的腎腫瘤磁共振深度學習模型對于惡性腎腫瘤的診斷效能,其外部驗證隊列的AUC可達0.77[15]。因此利用人工智能圖像識別技術對囊性腎癌的診斷具有較好的探索價值。
綜上所述,本研究結果表明利用2019版Bosniak分級標準,MSCT對腎囊性病變有較高的診斷效能,但在臨床實踐中應重視對該標準規范化運用的培訓。對Bosinak分級ⅡF級以上的患者需結合患者年齡、基礎疾病、腫瘤直徑等綜合因素考慮選擇治療策略。

