嬰幼兒配方乳粉中乳清蛋白檢測及蛋白熱變性的研究進展
徐濤,陳璟瑤,楊寶雨,喬為倉,姜鐵民,陳歷俊
(1.大連工業大學 生物工程學院,遼寧 大連116033;2.北京三元食品股份有限公司 國家母嬰乳品健康工程技術研究中心,北京100163;3.桂林理工大學國家母嬰乳品健康工程技術研究中心南亞分中心,廣西 桂林541006)
0 引言
乳清蛋白作為配方奶粉一項重要檢測指標,在食品安全國家標準GB 10765-2010中規定嬰幼兒配方奶粉乳清蛋白的質量分數應大于60%[1]。然而,最新的國標中只規定了含量標準未規定檢測方法,其檢測仍沿用國標GB/T 5413.2-1997中的乳清蛋白檢測方法。由于原料牛乳在加工前后會出現熱變性產生交聯蛋白,導致生產廠商不能有效對原輔料進行監測把控,相應監管部門也無法實現對終端乳粉產品進行質量監管。因此,明確蛋白受熱結構變化進而開發更為準確的乳清蛋白定量檢測方法是乳制品行業迫切所需。本文從乳清蛋白熱變性和乳清蛋白檢測方法兩個方面。綜述了國內外相關研究進展,旨在為嬰幼兒配方乳粉加工前后乳清蛋白含量檢測提供參考。
1 乳清蛋白組成與功能
乳清蛋白是乳液中多種可溶性蛋白的總稱,必需氨基酸種類齊全,有極高的生物利用效價,主要包括α-乳白蛋白(α-Lactalbumin,α-La)、β-乳球蛋白(βlactoglobulin,β-Lg)、免疫球蛋白(immunoglobulins,Ig)和牛血清白蛋白(Bovine albumin,BSA)等生物活性物質,見表1。

表1乳清蛋白各組分生理功能
2 乳清蛋白熱變性對定量檢測的影響
乳具有一定的熱穩定性,在加熱過程中,乳的熱穩定性受到乳清蛋白蛋白變性、酪蛋白膠束的解聚及其表面電荷的變化、蛋白之間的共聚合作用和乳中各成分平衡被破壞的影響。其中,乳清蛋白自身結構變性和乳蛋白之間的相互作用能夠導致配方乳粉中乳清蛋白的檢測出現誤差。如趙亭亭等[9]使用聚丙烯酰胺凝膠電泳(SDS-PAGE)分析了不同受熱情況對乳粉中乳清蛋白的影響如圖1所示,從左到右樣品受熱溫度依次升高。在受熱溫度低時,乳清蛋白條帶清洗且顏色較深;隨溫度升高,乳清蛋白中β-乳球蛋白與α-乳白蛋白條帶顏色變淺。而酪蛋白條帶無明顯變化。可見使用SDS-PAGE檢測乳制品中的乳清蛋白會有一定的限制,受到加工工藝的影響。除SDSPAGE檢測外,使用毛細管電泳,超高效液相色譜等在蛋白水平的檢測方法也都會受到蛋白變性的影響。與生牛乳相比較,加工后乳制品的檢測譜圖峰形發生偏移,峰底扭曲,導致檢測結果不準確[10-11]。而其他在肽段水平或者氨基酸水平的檢測方法,由于蛋白質被進一步分解,其空間結構的變化不會影響到檢測結果。
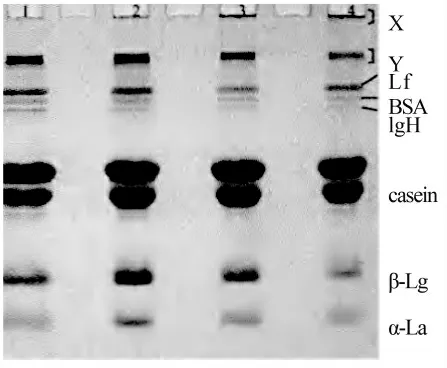
圖1 SDS-PAGE對不同受熱溫度乳蛋白的檢測
2.1 乳白蛋白熱變性
α-乳白蛋白分子內含有8個半胱氨酸殘基,在Cys6-Cys120,Cys60-Cys77,Cys73-Cys90,Cys28-Cys111處能夠形成二硫鍵,由于自身不含游離的巰基,熱處理不會使其分子間發生二硫鍵的交換,受熱更穩定。當溫度到達一定程度時α-La自身的二硫鍵才會被破壞,蛋白結構完全展開如圖2所示,展開后的α-乳白蛋白能夠與含游離巰基的其他蛋白質結合形成蛋白聚合體[12-14]。α-La的熱穩定性還與環境中Ca2+濃度有關,α-La上與Ca2+結合的位點是四個帶負電的天冬氨酸,在未結合Ca2+時,其自身的靜電排斥會影響蛋白二級結構發生變化,進而導致蛋白內的疏水位點更容易接觸到外部,降低蛋白穩定性[13]如圖3所示。

圖2熱處理對α-乳白蛋白結構的變化

圖3α-乳白蛋白與金屬離子結合
2.2 乳球蛋白熱變性
β-乳球蛋白自身極易受溫度與p H值的影響,根據受熱溫度不同其自身的變化也不同。中性溶液中,溫度在30℃以下時β-乳球蛋白以單體和二聚體的形式存在,兩者能夠相互轉化并維持在一個平衡狀態;溫度達到30℃以上,此時β-乳球蛋白的平衡會向單體形態轉變,最終以單體的形式存在[16];在溫度60℃以上時,β-乳球蛋白的空間折疊結構逐漸被打開,維持β-乳球蛋白基本結構的二硫鍵發生交換,發生不可逆的變化;當溫度高于85℃時,β-乳球蛋白的螺旋結構消失,巰基暴露,疏水性增強,分子之間通過二硫鍵與疏水作用折疊成熱變性聚合物如圖4所示。在高溫條件下熱變性聚合物的二硫鍵會發生斷裂,β-乳球蛋白會得到進一步伸展[17-19]。

圖4熱處理前后β-乳球蛋白結構變化
2.3 熱處理對蛋白之間相互作用的影響
在乳的加熱過程中,β-乳球蛋白的球狀結構先被打開,通過二硫鍵的交換進而形成聚集體;隨著溫度升高α-乳白蛋白空間結構也被打開與變性的β-乳球蛋白結合形成蛋白聚合體。乳清蛋白在受熱變性結構展開的過程中,其中的硫巰化合物與二硫鍵會與κ-酪蛋白相結合形成乳清蛋白-酪蛋白復合物[20]。
乳中另一部分重要的蛋白是酪蛋白,酪蛋白相較于乳清蛋白具有更高的熱穩定性,只有當溫度達到140℃時酪蛋白才會發生變性。酪蛋白對乳清蛋白熱聚合的保護性影響早在1964年就被發現,Kehoe等[21]發現β-酪蛋白能夠改變乳清蛋白在加熱過程中的熱聚集現象,β-酪蛋白并沒有改變乳清蛋白的變性溫度也不是通過減緩聚集過程發揮作用,而是以競爭的方式影響乳清蛋白的熱聚集,β-酪蛋白形成的聚集體比乳清蛋白自聚集形成的聚集體小。更小的聚集體的形成產生更不渾濁、更可溶的蛋白質溶液[22]。Arzuaga MR等[23]研究中發現在乳清蛋白加熱變性聚集過程中,酪蛋白的存在并沒有阻止變性行為的發生,但在酪蛋白-乳清蛋白體系中蛋白質的溶解度增加了100%,能夠防止蛋白加熱時的聚集行為。Liyanaa rachchi等[24]研究不同酪蛋白與乳清蛋白比例對乳清蛋白熱凝集的影響,在p H 7.5,酪蛋白與乳清蛋白(30∶70)時乳清蛋白的二級構象受加熱過程的影響最小,酪蛋白某個階段終止了乳清蛋白的變性和聚集過程。
3 乳清蛋白檢測方法
研究者針對配方乳粉中乳清蛋白各組分蛋白(α-La,β-Lg和BSA等)展開了一系列的方法研究,雖檢測對象略有不同,但乳清蛋白中各組分蛋白之間的檢測方法具有通用性。目前主要的檢測方法包括十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(Sodium dodecyl sulfate polyacrylamide gel electrophoresis)、氨基酸折算法、毛細管電泳(capillary electrophoresis,CE)、高效液相色譜(High Performance Liquid Chromatography,HPLC)和液相色譜-質譜聯用(liquid Chromatograph Mass Spectrometer,LC-MC)等,見表2。
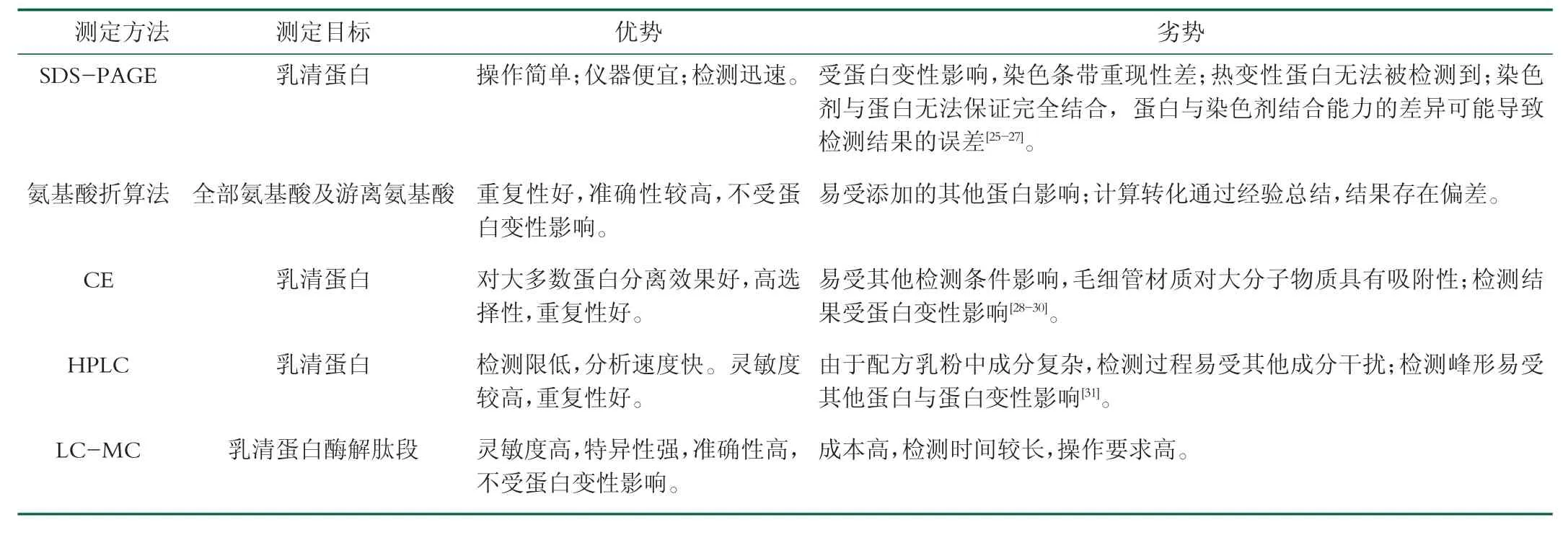
表2乳清蛋白各種檢測方法對比
3.1 毛細管電泳
1981年Jorgenson等人首先提出使用高壓電作為動力在毛細管中進行樣品分析,毛細管電泳技術誕生,由于其在生命科學領域對蛋白質等生物分子分離效果突出,得到迅速發展。最終發展成為在直流高壓場中以毛細管作為分離通道根據各檢測成分的淌度和分配行為差異進行分離的高效電泳技術[32]。目前解決毛細管吸附問題提高檢測準確性的方法主要是在毛細管內施加非共價鍵合涂層或共價鍵合涂層抑制內壁對大分子的吸附[33];此外調整電泳緩沖液,也能有效降低毛細管電泳的吸附[34]。
Zhao J等[35]使用帶有雙C4D/UV檢測器的毛細管電泳同時測定牛奶中的主要金屬陽離子和乳清蛋白,陽離子檢測分析過程中日內和日間的相對標準偏差(RSD%,n=5)分別為0.37%~0.55%和0.46%~0.79%,在乳清蛋白檢測分析中,β-Lg和α-La的檢測限分別為5 mg/L和3 mg/L,日內和日間相對標準偏差(RSD%,n=5)為0.29%~0.31%,遷移時間在0.43%~0.48%之間,峰面積為2.89%~3.25%和3.29%~4.18%。
Ping Feng等[36-38]將乳清蛋白與酪蛋白看作整體,通過對脫脂奶粉的檢測,即可確定乳清蛋白和酪蛋白的面積校正因子,從而建立了快速檢測配方奶粉中乳清蛋白和酪蛋白比例的方法。實驗對不含蛋白質的配方乳粉進行測定,從而證明在檢測配方乳粉時其他成分不會影響檢測結果。經過多次驗證已被國際標準化組織(ISO)設為檢測乳基嬰兒配方粉中乳清蛋白的標準檢測方法(標準號ISO 23293-2020)。
3.2 SDS-PAGE
1959年Raymond等人利用人工合成的凝膠進行電泳分析,創建了聚丙烯酰胺凝膠電泳。直至今日,聚丙烯酰胺凝膠電泳被廣泛應用于生命科學領域中對蛋白質、多肽、核酸等生物大分子的檢測鑒定。Robert G.E等[39]在SDS-PAGE過程中,使用陽離子染料結晶紫代替考馬斯亮藍進行染色,染色蛋白可以轉移到硝基纖維素上,western染色蛋白用酶偶聯抗體檢測。實驗中結晶紫能夠染色到16 ng的蛋白質且無需脫色過程,比考馬斯亮藍染色低5倍,兩者具有相同的線性動態范圍。賈宏信等[40]在實驗過程中,使用成像儀代替檢測凝膠條帶的光密度計,通過chemiDoc XRS與成像系統的Quantity One圖像處理軟件根據條帶顏色深淺計算蛋白含量,最終檢測值的RSD在1.85%~4.35%之間。
3.3 氨基酸折算法
氨基酸折算法是根據牛奶和乳清蛋白含有的獨特氨基酸圖譜,通過特定的氨基酸的差異來計算乳清蛋白含量的一種方法。Wesley等[41-42]對多種乳制品中乳清蛋白檢測的精確度進行檢測評估。比對實際值與檢測質,其重復性的估計值在0.3%~2.5%之間,平均回收率在97%~100%之間。
由于該方法的氨基酸含量對蛋白含量的計算轉化是通過經驗總結的,并沒有對蛋白進行直接的測定。李爽等[43]對氨基酸折算法計算奶粉中乳清蛋白含量的方法進行評估,對國內外品牌嬰幼兒配方粉檢測發現,一階段奶粉中乳清蛋白的檢測值高于標示值5%~10%,二、三段的奶粉乳清蛋白也與商品標示值有所偏差。實驗另一結果顯示,在對添加有大豆分離蛋白的奶粉使用該方法檢測時,乳清蛋白的檢測結果會發生明顯的升高,當配方奶粉中添加20%的大豆蛋白時,乳清蛋白的檢測量從27.78%增加至63.99%。
3.4 高效液相色譜
高效液相色譜是根據樣品混合物中各組分之間結構和性質的不同,在流動相和固定相之間作用大小不同,從而使各組分形成滯留時間的差異。在1971年由科克蘭提出之后,該方法被廣泛用于化工,環境,生物,藥物和食品等領域。HPLC對配方乳粉中乳清蛋白的檢測僅適用于某些蛋白,無法廣泛應用于全部乳清蛋白的分析,Xiaojing Ding等[44]在實驗過程中發現α-La與乳鐵蛋白在檢測中峰形會出現重疊從而干擾α-La檢測結果,建立了HPLC對乳制品中β-Lg的檢測,β-Lg A和β-Lg B的線性系數分別為0.9998和0.9997,濃度范圍內的回收率在90.7%至116.8%之間。Farid M等[45]開發了針對配方乳粉中骨橋蛋白檢測方法,通過反相色譜原理在HPLC上在214 nm處檢測分析,其結果線性大于0.999,檢出限與定量限分別為0.14 mg/L和0.41 mg/L,相對標準偏差(RSD)<0.2%。
3.5 液相色譜-質譜聯用法
20世紀80年代末,John Fenn發現了電噴霧電離(ESI),使液相色譜-質譜聯用(LC-MS)技術獲得巨大發展。LC-MS技術將LC的物理分離能力與MS的質量分析能力相結合,以其無與倫比的高靈敏度和高選擇性的混合分析能力成為蛋白質組學中最重要的一部分[46-48]。Ke Xing等[49]使用高效液相色譜-串聯質譜聯用,對以牛乳或羊奶為乳基的配方乳粉中兩種乳清蛋白(α-la,β-lg)與4種酪蛋白(αS1-cs,αS1-cs,β-cs,κ-cs)進行定量分析,目標蛋白的定量限為0.01%~0.05%日內和日間精密度的RSD分別為2.8%~6.2%和3.3%~9.8%,回收率范圍為82.3%~116.6%,在不同的加標水平下具有很好的重現性(RSD<12%)。Wang Z等[50]使用液相色譜-串聯質譜法評估乳清蛋白分析中牛α-La肽及其同位素標記的肽之間的相互干擾。其中α-La肽的濃度對其相應的同位素標記肽段在正電噴霧源(ESI)下的MS響應值有顯著影響,而β-Lg對其同位素標記肽段的MS強度影響不大。研究對實驗的前處理操作材料(移液器/注射器,過膜材料)進行評估,在經過注射器后α-La肽于其標記肽的信號強度降低了50%,在經過過濾器之后α-La肽與其標記肽信號強度變化不大,β-Lg信號強度降低了50%。
3.6 其他方法
近幾年研究者們提出了通過學科交叉開發蛋白檢測新技術。王士峰等[51]根據膠體金免疫層析技術,通過膠體金標記的β-Lg單克隆抗體和IgG制成免疫層析試紙,進而完成對配方羊奶粉中β-Lg的快速檢測。根據抗原抗體特異性結合的特點檢測目的蛋白的酶聯免疫吸附技術(ELISA)對乳清蛋白中的牛血清蛋白和乳鐵蛋白也具有很好的檢測效果[52-53]。
2005年,Indyk等[54-57]將生物感應器與乳清蛋白檢測相結合,提出通過光學生物傳感器檢測乳制品中蛋白的方法,使用表面等離子共振技術(Surface Plasmon Resonance,SPR)檢測乳制品中乳鐵蛋白和Ig的檢測方法。Jagan M.Billakanti等[58]在其之后對SPR檢測進一步優化調整,測定原料奶、加工奶和各種奶制品中的蛋白時具有相對較好的準確性。與光學生物傳感器檢測不同,Eissa等[59]針對乳制品中過敏原β-Lg的實時檢測,開發了一種基于適體/石墨烯的電化學生物傳感器,能夠同步,低成本的檢測β-Lg,且具有較高的靈敏度。除此之外,由于單一的檢測技術具有各自的優缺點,通過兩種或多種技術相結合也是研究者關注的熱點。De Carvalho等[60]將分光光度法與多元校正法相結合建立了快速檢測乳清蛋白中糖巨肽蛋白的檢測方法,實現了對奶粉中乳清摻假的快速、低成本檢測。
4 結果與展望
本文結合近幾年國內外文獻,綜述了目前配方乳粉中乳清蛋白定量檢測的研究進展,對各檢測方法優缺點以及各方法的優化改善研究進行了總結;歸納了乳清蛋白組成與其受熱條件下,蛋白空間結構的變化;解釋了乳清蛋白變性對其定量檢測的影響。以期為嬰幼兒配方乳粉加工前后乳清蛋白定量檢測提供參考。
當前可用于生產實踐中的乳清蛋白檢測技術并不多,大多數的檢測技術由于其成本,操作和儀器等問題僅能在實驗室內進行。各定量方法中質譜檢測技術被大多數研究者認可,在其基礎上進一步降低成本,簡化操作,應是乳清蛋白定量研究的一個方向;另外乳清蛋白作為一個蛋白組,檢測過程中往往僅是對其主要的幾種子蛋白進行單獨定量,最終計算乳清蛋白含量。不定量單個蛋白,直接將乳清蛋白當作整體來進行定量分析(如Ping Feng,毛細管電泳法)或許是種不錯的選擇;另一方面對乳清蛋白的檢測應盡量在肽段或者氨基酸的水平進行,使其能夠避免蛋白質自身結構變化對檢測結果的影響。以質譜技術為基礎,在不使用同位素標記的情況下對乳清蛋白整體進行相對定量,有可能得到我們所期待的方法。

