黃芩苷通過Ebf3基因調控骨髓間充質干細胞成骨分化
李博樂 江長青 劉振鵬 夏冰
(1浙江中醫藥大學研究生院,浙江 杭州 310053;浙江骨傷醫院 2創二病區;3關節病區;4浙江省人民醫院骨科)
骨質疏松是一種以骨丟失和骨組織結構退化為特征的慢性骨代謝紊亂,隨著老年人口的增長,骨質疏松已成為世界范圍內的主要公共衛生問題〔1,2〕。由于骨質疏松是一種慢性疾病,而天然類黃酮具有副作用少且適合長期使用的優勢〔3,4〕。黃酮類化合物,黃芩苷(BC)在中藥配方中用于抗感染已有數千年的臨床治療歷史。研究發現,BC在骨質形成、成骨分化中具有調控作用,但其作用機制仍有待繼續研究〔5~8〕。本研究旨在探究BC在骨髓間充質干細胞(BMSC)增殖和成骨分化中的作用機制。
1 材料與方法
1.1材料 1代人BMSCs細胞購自Scien Cell;堿性磷酸酶(ALP)檢測試劑盒購自北京綠源博德生物科技有限公司;BC(純度≥99%)、β-甘油磷酸鈉、地塞米松、二磷酸抗壞血酸均購自中國醫藥生物制品控制所。細胞計數試劑盒(CCK)-8購自日本同仁化學研究所;實時熒光定量逆轉錄-聚合酶鏈反應(RT-qPCR)試劑盒購自日本TaKaRa;實驗中所涉及的所有質粒、引物送至蘇州金唯智生物公司完成。
1.2方法
1.2.1細胞處理 1代人BMSCs細胞用含20%胎牛血清的DMEM完全培養基培養,培養條件為37℃、5%CO2、飽和適度的恒溫細胞培養箱中培養、傳代,培養至第3代用于實驗研究。
1.2.2細胞分組 成骨誘導液(100 nmol/L地塞米松、0.05 mmol/L二磷酸抗壞血酸,10 mmol/L β-甘油磷酸鈉溶解于含有100 ml/L胎牛血清的DMEM培養液)處理BMSCs細胞6 d,3 d更換1次新鮮培養液,至第6天的細胞標記為BMSCs組。將BC(50、100、500 ng/ml)處理BMSCs細胞6 d,標記為50、100、500 ng/ml組。需要注意的是所有培養液中需要含有0.01%的DMSO。從中選取最適濃度的BC記為BC組(100 ng/ml)。使用脂質體將質粒或者DNA轉染至BMSCs細胞(脂質體與質粒量的比例為3∶1),具體方法為:先將脂質體和質粒或DNA混合均勻,再加入細胞共培養6 h,然后再更換新培養基繼續培養48 h。結束后再用RT-qPCR檢測轉染的效率,確認轉染成功后再用于后續實驗的操作。具體轉染的質粒或DNA為:pcDNA組(轉染pcDNA)、pcDNA-早期B細胞因子(Ebf)3組(轉染pcDNA-Ebf3)、si-NC組(轉染si-NC)、si-Ebf3組(轉染si-Ebf3)、BC+si-NC組(轉染si-NC再用BC處理)、BC+si-Ebf3組(轉染si-Ebf3再用BC處理)。
1.2.3CCK-8實驗 將需要檢測的細胞調整至適當濃度(105個/ml),按照CCK-8試劑盒要求操作,加入細胞樣本后,再加入CCK-8反應液,孵育后在酶標儀上測量細胞吸光度(A490)。細胞存活率(%)=(1-A490樣本/A490對照)×100%。每個樣本做3個平行復孔,實驗重復3次。
1.2.4酶聯免疫吸附試驗(ELISA) 將需要檢測的細胞先用磷酸鹽緩沖液(PBS)洗滌,再按照ALP檢測試劑盒要求操作,加入基質液、顯色液,最后檢測細胞的吸光度(A450)并進行分析。每個樣本做3個平行復孔,實驗重復3次。
1.2.5RT-qPCR 將需要檢測的細胞收集后,用RNA抽提試劑盒提取總RNA,在將其合成cDMA,以此為模板。用RT-qPCR試劑盒進行骨鈣素(Osteocalcin)、Ebf3的檢測。結果用2-△△Ct法計算Osteocalcin、Ebf3的表達。引物序列為:Osteocalcin:上游引物5′-CAGCGGCCCTGATACGGAAATCG-3′,下游引物:5′-GCCGGAGTCTGTTCACTACCTTA-3′;Eb-f3:上游引物5′-CAGATATCGTGCCTCTTAGTGC-3′,下游引物:5′-TCTCAGTGCGTCCATGTGAGTC-3′;GAPDH:上游引物:5′-CACCGACACCCACTCCTC-3′,下游引物:5′-TGAGGTCCACCACCCTGT-3′。每個樣本做3個平行復孔,實驗重復3次。
1.2.6Western印跡 收集細胞,對細胞進行裂解并提取總蛋白。將蛋白進行十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(SDS-PAGE),將分離的蛋白用轉膜儀轉移至NC膜。將膜用脫脂奶粉封閉處理2 h。在將膜用一抗(1∶1 500)孵育過夜(4℃),第2天將膜再次用二抗(1∶2 000)孵育2 h(37℃)。結束后,將膜用電化學發光(ECL)試劑盒進行顯影、曝光。每個樣本做3個平行復孔,實驗重復3次。
1.3統計學方法 采用SPSS22.0軟件進行方差分析、SNK-q檢驗、t檢驗。
2 結 果
2.1BC對成骨誘導液誘導的BMSCs增殖、成骨分化的影響 與BMSCs組相比,100、500 ng/ml組誘導的BMSCs細胞存活率、ALP活性,Osteocalcin mRNA表達顯著升高(P<0.05)。見表1。可見,BC可促進成骨誘導液誘導的BMSCs增殖和骨向分化。其中100 ng/ml BC處理的效果最佳,故選用該濃度用于后續實驗。
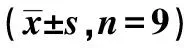
表1 BC處理的成骨誘導液誘導的 BMSCs增殖和成骨分化
2.2BC對成骨誘導液誘導的BMSCs細胞Ebf3表達的影響 與BMSCs組相比,BC組細胞中Ebf3的mRNA和蛋白表達均顯著升高(P<0.05)。見圖1、表2。可見,BC可上調成骨誘導液誘導的BMSCs細胞中Ebf3表達。

圖1 BC處理的BMSCs細胞Ebf3蛋白的表達
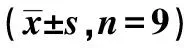
表2 BC處理后的成骨誘導液誘導的 BMSCs細胞Ebf3的表達
2.3過表達Ebf3對成骨誘導液誘導的BMSCs細胞增殖、成骨分化的影響 與pcDNA組相比,pcDNA-Ebf3組細胞中Ebf3 mRNA和蛋白表達、細胞存活率、ALP活性、Osteocalcin mRNA表達均顯著升高(P<0.05)。見圖2、表3。提示過表達Ebf3可促進成骨誘導液誘導的BMSCs細胞增殖和成骨分化。

圖2 過表達Ebf3的BMSCs細胞Ebf3蛋白的表達
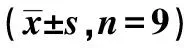
表3 過表達Ebf3的成骨誘導液誘導BMSCs細胞的增殖和成骨分化
2.4敲減Ebf3對成骨誘導液誘導的BMSCs細胞增殖、成骨分化的影響 與si-NC組相比,si-Ebf3組細胞中Ebf3 mRNA和蛋白表達、細胞存活率、ALP活性和Osteocalcin mRNA表達均顯著降低(P<0.05)。見圖3、表4。可見,敲減Ebf3抑制成骨誘導液誘導的BMSCs細胞增殖和成骨分化。

圖3 敲減Ebf3的BMSCs細胞Ebf3蛋白的表達
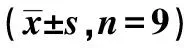
表4 敲減Ebf3的成骨誘導液誘導的BMSCs細胞的增殖和成骨分化
2.5敲減Ebf3對BC處理的成骨誘導液誘導BMSCs細胞增殖、成骨分化的影響 與BC組及BC+si-NC組相比,BC+si-Ebf3組細胞中Ebf3的mRNA和蛋白表達、細胞存活率、ALP活性和Osteocalcin mRNA表達均顯著降低(P<0.05)。見圖4、表5。可見,下調Ebf3可明顯減弱BC對成骨誘導液誘導的BMSCs細胞增殖和成骨分化作用。

圖4 不同處理組的BMSCs細胞Ebf3蛋白的表達
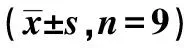
表5 敲減Ebf3對黃芩素處理的成骨誘導液誘導的BMSCs細胞增殖、成骨分化
3 討 論
Zhao等〔9〕研究報道,BC增強了地塞米松誘導的斑馬魚幼蟲骨質疏松的生長和發育。通過鈣黃綠素染色和鈣磷測定表明,BC改善了地塞米松誘導的骨質疏松斑馬魚幼蟲的礦化作用。BC還調節核因子κB受體活化因子配體(RANKL)和骨保護素(OPG)的表達,并阻止在DEX誘導下在斑馬魚中與骨形成和吸收相關的基因表達的變化,又通過分子對接推斷出BC可直接與RANKL的胞外域相互作用,揭示了BC通過調節核因子κB受體活化因子(RANK)/RANKL/OPG信號傳導通路改善了DEX誘導的骨質疏松。Zhu等〔10〕發現,BC抑制脂多糖(LPS)誘導的間充質干細胞(MSC)白細胞介素(IL)-1β、IL-8和腫瘤壞死因子(TNF)-α的表達水平,而絲裂原活化蛋白激酶(ERK)抑制劑能夠恢復炎癥作用,說明BC在MSC中具有促進上皮分化、細胞增殖的作用,其機制與ERK通路活性有關。研究顯示BC可以通過Wnt/β-catenin信號通路增加成骨細胞礦化作用并促進成骨細胞分化〔11〕。
本研究結果說明Ebf3在BMSCs細胞的增殖和成骨分化中具有重要的促進作用,敲減Ebf3還可明顯的減弱BC對成骨誘導BMSCs細胞的增殖、成骨分化促進作用。這是國內外首次發現BC通過Ebf3調控BMSCs細胞的增殖和成骨分化,為BC在骨質疏松治療中的應用提供理論支持。Seike等〔12〕發現,Ebf3在間充質細胞中的表達異常升高,并且表達Ebf3的細胞在成年骨髓的自我更新中發揮重要作用;當MSC中Ebf3表達缺失時,造血干細胞的微環境會受到嚴重破壞,并且在老年小鼠中骨髓發生骨質硬化。EBF能夠與非典型的鋅指和螺旋-環-螺旋基序結合的高度保守DNA相結合的轉錄因子,其與相關的蛋白質(Ebf2、Ebf3、Ebf4、Collier/Knot和Unc-3)構成一個新的轉錄因子家族,稱為EBF家族〔13〕。Ebf3為該家族成員之一,其參與人類神經系統疾病和多種腫瘤的發展〔14〕。

