lncRNA NKILA靶向miR-22-3p調控高糖誘導的人足細胞增殖和凋亡
張艷秋 翟鐵 劉丹 郝鳳杰 王曉軍 (承德市中心醫院,河北 承德 067000)
足細胞在糖尿病腎病(DN)的發病機制中起關鍵作用,高糖可誘導足細胞凋亡和脫落,最終導致腎小球硬化〔1〕。研究足細胞凋亡和損傷機制有助于治療DN。核因子(NF)-κB相關長鏈非編碼RNA(lncRNA NKILA)在10 mg/脂多糖( LPS)誘導8 h的膿毒癥腎損傷的HK-2細胞中表達顯著升高〔2〕。而本研究通過StarBase預測顯示,miR-22-3p可能是lncRNA NKILA的靶基因。miR-22-3p在腎小管損傷模型細胞〔3〕和膿毒癥誘導的急性腎損傷〔4〕中表達下調。且有研究表明miR-22-3p可通過磷脂酰肌醇-3-激酶(PI3K)/蛋白激酶B(AKT)途徑影響腎癌細胞活力和遷移〔5〕。根據上述研究結論和預測結果本研究假設,在高糖誘導的人足細胞HPC中,lncRNA NKILA靶向miR-22-3p通過PI3K/AKT途徑影響高糖誘導的人足細胞HPC增殖和凋亡,并對此假設進行驗證。
1 材料與方法
1.1材料 人永生性腎臟足細胞系HPC購自北京北納生物;McCoy 5a培養基和胎牛血清(FBS)購自美國Gibco公司;胰蛋白酶Trypsin購自Sigma-Aldrich公司;細胞周期蛋白(cyclin)D1抗體、cleaved-caspase-3抗體、磷酸化(p)-PI3K、p-AKT抗體和β-actin抗體購自英國Abcam公司;Lipofectamine 2000轉染試劑、總RNA提取試劑Trizol、 real-time PCR試劑盒、反轉錄試劑盒(RT-PCR)購自美國Invitrogen公司;流式細胞凋亡檢測試劑盒購自美國BD公司;lncRNA NKILA抑制劑(anti-lncRNA NKILA)、lncRNA NKILA過表達載體(pcDNA-NKILA)、miR-22-3p mimics、miR-22-3p抑制物(anti-miR-22-3p)、陰性對照(si-NC、pcDNA-NC、miR-NC和anti-miR-NC)、lncRNA NKILA的野生型(WT-NKILA)和突變型(MUT-NKILA)雙熒光報告載體購自上海吉瑪基因;雙熒光素酶報告系統購自美國Promega公司;流式細胞儀購自美國BD公司,real-time PCR儀購自美國Bio-Rad公司。
1.2方法
1.2.1細胞培養、分化和分組〔6〕細胞培養和分化:將HPC培養在含10%FBS、100 U/ml青霉素和100 mg/ml鏈霉素的McCoy 5a培養基中,置37℃ 5%CO2、濕度95%的培養箱中培養,2 d傳代一次,細胞傳代時將細胞培養于33℃ 5%CO2培養箱中,細胞基本融合為一層時,將傳代的HPC細胞轉入37℃ 5% CO2培養箱培養10~14 d,細胞分化成熟。
實驗分組:正常對照(NC)組:McCoy 5a培養基+D-葡萄糖11.1 mmol/L培養48 h;高糖刺激(HG)組:McCoy 5a培養基+D-葡萄糖25 mmol/L培養48 h;高糖刺激+轉染(HG+轉染)組:轉染48 h后用McCoy 5a培養基+D-葡萄糖25 mmol/L處理48 h。
1.2.2細胞轉染 轉染前24 h將HPC以5×105個細胞/孔接種于6孔板中,培養至細胞融合度為50%~60%時根據轉染說明書進行轉染。轉染分組:lncRNA NKILA低表達組(轉染si-NKILA,以si-NC為對照),miR-22-3p高表達組(轉染miR-22-3p,以miR-NC為對照),lncRNA NKILA和miR-22-3p雙抑制組(轉染si-NKILA+anti-miR-22-3p,以si-NKILA+anti-miR-NC為對照)。將無血清培養液稀釋的等體積脂質體和各組載體混合,室溫孵育20 min,加入到培養好的HPC細胞中,培養6 h,棄無血清培養液,加入McCoy 5a完全培養基,轉染48 h,收集細胞。
1.2.3real-timePCR檢測lncRNA NKILA和miR-22-3p 的表達 收集NC組、HG組或轉染的各組HPC細胞,按照總RNA提取試劑盒的說明書提取細胞總RNA,反轉錄合成cDNA,取cDNA為模板按照 real-time PCR的說明書進行反應合成lncRNA NKILA和miR-22-3p,反應程序為:95℃ 2 min;95℃30 s、60℃ 40 s、72℃ 45 s,40個循環;72℃ 5 min。用2-ΔΔCt方法進行數據分析。
1.2.4CCK-8實驗檢測細胞存活率 收集轉染后和(或)高糖處理的HPC細胞,消化并稀釋,以2×103個細胞/孔(100 μl細胞/孔)接種于96微孔板中,在細胞培養至48 h進行 CCK-8實驗,每孔加入10 μl CCK-8溶液,置于37℃繼續培養2 h,酶標儀檢測450 nm 處的吸光度(A)值。細胞存活率(%)=實驗組A值/陰性對照組A值×100%。
1.2.5Western印跡檢測蛋白表達 收集各組HPC細胞,裂解破碎細胞,收集細胞中的蛋白,測定蛋白濃度。將蛋白樣本進行十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(SDS-PAGE),轉聚偏氟乙烯(PVDF)膜,封閉2 h,加入稀釋的各個一抗(cyclinD1抗體1∶2 000、cleaved-caspase-3抗體1∶1 000、p-PI3K抗體1∶1 000、p-AKT抗體1∶1 000、和β-actin抗體1∶4 000),4℃過夜孵育,洗膜2次,加入稀釋的酶標記二抗,室溫孵育2 h,以β-actin為內參,分析蛋白表達水平。
1.2.6流式細胞術測定細胞凋亡率 收集經高糖或(和)轉染后各組HPC細胞,胰酶消化,離心收集細胞,按照膜聯蛋白(Annexin)V/碘化丙啶(PI)試劑盒說明書進行操作,Annexin V-FITC和PI各5 μl,混勻,室溫避光15 min,流式細胞儀檢測凋亡率。
1.2.7雙熒光素酶報告實驗 根據1.2.2進行HPC細胞培養和轉染,將構建的WT-NKILA和MUT-NKILA雙熒光素酶報告載體分別與miR-NC或miR-22-3p共轉染HPC細胞,轉染后培養48 h,收集細胞并進行裂解,離心收集上清,根據試劑盒說明書進行操作,以海腎熒光素酶活性為內參照,檢測分析相對螢火蟲熒光素酶活性。
1.3統計學處理 采用SPSS21.0軟件進行單因素方差分析和t檢驗。
2 結 果
2.1NC組和HG組中lncRNA NKILA和miR-22-3p表達情況 與NC組相比,HG組的HPC細胞lncRNA NKILA含量顯著升高(P<0.05),miR-22-3p顯著降低(P<0.05),見表1。
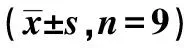
表1 NC組和HG組中lncRNA NKILA和 miR-22-3p表達情況
2.2低表達NKILA對高糖處理的HPC增殖和凋亡影響 與NC組相比,HG組的HPC細胞存活率和cyclinD1含量降低,凋亡率和cleaved-caspase-3蛋白含量上升,差異均具有統計學意義(P<0.05);與HG+si-NC組相比,HG+si-NKILA組HPC細胞中NKILA含量降低,細胞存活率和cyclinD1含量升高,凋亡率和cleaved-caspase-3蛋白含量降低,差異均具有統計學意義(P<0.05),見圖1、圖2和表2。

圖1 Western印跡檢測cyclinD1和cleaved-caspase-3 蛋白表達

圖2 流式細胞儀檢測細胞凋亡
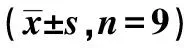
表2 低表達NKILA對高糖誘導的HPC增殖和凋亡影響
2.3高表達miR-22-3p對HPC增殖和凋亡的影響 與HG+miR-NC組相比,HG+miR-22-3p組HPC細胞中miR-22-3p含量、細胞存活率和cyclinD1含量升高,凋亡率和cleaved-caspase-3蛋白含量降低,差異均具有統計學意義(P<0.05),見圖3和表3。
2.4lncRNA NKILA靶向調控miR-22-3p的表達 通過StarBase預測顯示,miR-22-3p序列中含有與lncRNA NKILA互補的位點,見圖4。與miR-NC組相比,miR-22-3p組WT-NKILA的螢火蟲熒光素酶相對活性顯著降低(P<0.05),而MUT-NKILA的熒光素酶相對活性無明顯變化(P>0.05)。見表4。qRT-PCR結果表明,si-NC組、si-NKILA組、pcDNA-NC組、pcDNA-NKILA組miR-22-3p分別為:1.02±0.11、2.69±0.27、1.05±0.10、0.42±0.04。抑制lncRNA NKILA可上調miR-22-3p含量,過表達lncRNA NKILA可下調miR-22-3p含量(F=353.702,P<0.001)。
2.5低表達miR-22-3p可以部分逆轉NKILA低表達對HPC增殖和凋亡的影響 與HG+si-NKILA+anti-miR-NC組相比,HG+si-NKILA+anti-miR-22-3p組HPC細胞中miR-22-3p、細胞存活率和cyclinD1含量均降低,凋亡率和cleaved-caspase-3蛋白含量升高,均具有統計學意義(P<0.05),見圖5和表5。

A:流式細胞儀檢測細胞凋亡;B:Western印跡檢測cyclinD1和cleaved-caspase-3蛋白的表達圖3 高表達miR-22-3p對HPC的增殖和凋亡的影響

表3 高表達miR-22-3p對HPC的增殖和凋亡的影響

圖4 通過Starbase預測miR-22-3p和 NKILA結合示意圖
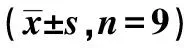
表4 miR-NC或miR-22-3p與報告質粒共轉染HPC 細胞后雙熒光素酶活性檢測

A:流式細胞儀檢測細胞凋亡;B:Western印跡檢測cyclinD1和cleaved-caspase-3蛋白的表達;1、2:HG+si-NKILA+anti-miR-NC組、HG+si-NKILA+anti-miR-22-3p組圖5 低表達miR-22-3p可以部分逆轉NKILA低表達對HPC增殖和凋亡的影響
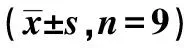
表5 低表達miR-22-3p可以部分逆轉NKILA低表達對HPC增殖和凋亡的影響
2.6PI3K/AKT信號通路相關蛋白的表達 與HG+si-NC組相比,HG+si-NKILA組HPC細胞中p-PI3K和p-AKT含量均顯著升高(P<0.05);與HG+si-NKILA+anti-miR-NC組相比,HG+si-NKILA+anti-miR-22-3p組p-PI3K和p-AKT含量均顯著下降(P<0.05),見圖6和表6。

1~4:HG+si-NC組、HG+si-NKILA組、HG+si-NKILA+anti-miR-NC組、HG+si-NKILA+anti-miR-22-3p組圖6 Western印跡檢測p-PI3K、p-AKT蛋白的表達
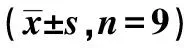
表6 PI3K/AKT信號通路相關蛋白的表達
3 討 論
大量lncRNA在DN中表達失調,可能通過轉化生長因子(TGF)-β1/NF-κB/信號轉導及轉錄激活蛋白(STAT)3/糖原合成酶激酶(GSK)-3β信號通路參與DN的發展和進展,可能是疾病的早期診斷或預后的標志物或作為減緩DN進展的治療靶點〔7,8〕。
lncRNA NKILA通過抑制NF-κB活動,使T細胞對活化誘導的細胞死亡(AICD)敏感而促進腫瘤免疫逃避〔9〕。NKILA在非小細胞肺癌(NSCLC)〔10〕、惡性黑色素瘤〔11〕、乳腺癌〔12〕和食管鱗狀細胞癌(ESCC)〔13〕中均可通過阻斷NF-κB信號通路抑制癌細胞的遷移、侵襲或上皮間質轉化。目前針對NKILA的主要研究集中腫瘤等方面,還有研究表明,lncRNA NKILA對膿毒癥腎損傷后自噬具有調節作用〔2〕。本研究說明抑制lncRNA NKILA對足細胞具有潛在的保護作用。
本研究通過StarBase預測顯示,miR-22-3p與lncRNA NKILA存在結合位點,可能參與lncRNA NKILA對足細胞凋亡和增殖的調控。miR-22-3p在糖尿病心肌病(DCM)大鼠模型中表達下調,通過MIAT/miR-22-3p/DAPK2信號通路調控心肌細胞的凋亡〔10,14〕。且miR-22-3p在膿毒癥急性腎損傷中表達下調〔4〕,在草酸鈣誘導腎結石模型中參與腎小管上皮細胞的凋亡〔3〕。但其對DN足細胞中的表達和作用尚不清楚。本研究結果表明低表達miR-22-3p可部分逆轉抑制lncRNA NKILA對高糖誘導的HPC增殖和凋亡的作用。
PI3K/Akt/NF-κB軸可能在足細胞損傷中起關鍵作用,PI3K/AKT途徑的激活可阻止高糖誘導的足細胞凋亡〔15,16〕。本研究發現,抑制lncRNA NKILA表達可激活PI3K/AKT信號通路,下調miR-22-3p則逆轉了抑制lncRNA NKILA對高糖誘導的HPC細胞PI3K/AKT信號通路的激活作用。說明lncRNA NKILA靶向miR-22-3p可能通過PI3K/AKT信號通路發揮對足細胞的保護作用。
綜上,在高糖誘導的HPC細胞中,lncRNA NKILA通過調控miR-22-3p激活PI3K/AKT信號通路,抑制高糖誘導的足細胞凋亡,提高細胞存活率。lncRNA NKILA可能是DN潛在的靶點。

