神經毒素BMAA 對球等鞭金藻(Isochrysis galbana)的生長抑制作用研究*
李愛峰 劉建偉 胡 楊 付藝蕾 邱江兵
(1. 中國海洋大學環境科學與工程學院 山東青島 266100; 2. 海洋環境與生態教育部重點實驗室 中國海洋大學 山東青島 266100)
二十世紀五六十年代, 在西太平洋關島地區當地土著居民查莫羅人群中流行一種地方病——肌萎縮側索硬化-帕金森癡呆綜合癥(ALS-PDC), 其發病率是其他地區平均水平的50~100 倍。但該疾病的發病率在移居到其他地區的查莫羅人的后代人群中明顯降低, 說明某些環境因素可能誘導該疾病的發生(李愛峰等, 2009; 牛琦等, 2012)。科學家推測關島地區高發的ALS-PDC 疾病可能與查莫羅人食譜中的蘇鐵(Cycasmicronesica)種子和果蝠(Pteropusmariannus)有關, 其中含有一種神經毒性的非蛋白氨基酸——β-N-甲氨基-L-丙氨酸(β-N-methylamino-L-alanine, BMAA),其沿食物鏈具有顯著的生物放大作用(Coxetal, 2003;Murchetal, 2004a)。隨后人們在死于阿爾茨海默癥的2 名加拿大患者和12 名美國患者及死于ALS 疾病的13 名美國患者的腦組織中也檢出了BMAA, 說明環境中分布的BMAA 可能與全球散發的這類神經退行性疾病有關(Murchetal, 2004b; Pabloetal, 2009)。我國學者在中國近海尤其是北方沿海采集的多種貝類軟體動物樣品中普遍檢出 BMAA (Lietal, 2016,2018), 且發現BMAA 在膠州灣生態系統中也具有明顯的生物放大作用(Wangetal, 2021)。由于BMAA 分子在生物體內既能以游離態形式存在, 也可與低分子量的多肽結合, 或直接嵌入蛋白質分子中以蛋白結合態存在(Rosénetal, 2016), 通常生物樣品中游離態BMAA 與蛋白結合態BMAA 含量的比值范圍為1∶60~1∶120 (Inceet al, 2005)。因此, 目前研究工作中通常將BMAA 劃分為三種形態定量描述: 經三氯乙酸等極性溶劑提取離心后, 溶解于上清液中的“游離態BMAA”; 在上清液中與多肽或小分子蛋白結合,經鹽酸水解后釋放出來的“溶解結合態BMAA”; 在沉淀中與大分子蛋白結合, 經鹽酸水解后釋放出來的“沉淀結合態BMAA”(Lanceetal, 2018)。
目前有關人神經退行性疾病的發病機制尚無定論, 但有關BMAA 對神經元的毒性作用已得到普遍認同。離體實驗結果表明, BMAA 可通過多種途徑導致運動神經元的損傷, 主要包括: (1) BMAA 能夠與碳酸氫鹽結合生成與谷氨酸相似結構的β-氨基甲酸鹽(Weissetal, 1988), 能夠競爭性地與神經細胞膜上的離子型和促代謝型谷氨酸受體結合(Cucchiaroniet al, 2010), 導致神經細胞內Na+和Ca2+濃度升高, K+濃度降低, 從而破壞了細胞穩態; (2) 細胞內Ca2+濃度的升高破壞線粒體功能, 導致活性氧的釋放, 造成氧化損傷(Raoetal, 2006); (3)谷氨酸受體的激活導致神經細胞去極化, 使得神經細胞膜的通透性增加, 并釋放去甲腎上腺素, 造成興奮性中毒(Lindstr?metal,1990; Nedeljkovetal, 2005); (4) BMAA 還能抑制神經細胞膜上的半胱氨酸/谷氨酸反轉運系統(cystine/glutamate antiporter system, Xc-), 抑制抗氧化劑谷胱甘肽的合成(Liuetal, 2009)。近年的活體實驗表明,長期喂食含有BMAA 的水果導致綠猴(Chlorocebus sabaeus)腦組織中形成與ALS-PDC 患者腦組織中相似的神經元纖維纏結和β-淀粉樣蛋白(Coxetal, 2016);BMAA 暴露(≥50 mg/kg)也會導致成年大鼠出現輕度短期行為改變和海馬神經元丟失, 并出現β-淀粉樣蛋白沉積(Scottet al, 2019)。這些發現進一步證實了BMAA 毒素對人神經退行性疾病的誘導作用。
毒理學研究表明, BMAA 對多種微藻、高等水生植物、水生動物等水生生物也具有一定的毒害作用。研究發現, 4.2 μmol/L 的外源 BMAA 對集胞藻Synechocystissp. PCC6803 的生長和光合作用能力具有明顯的抑制作用(Downingetal, 2012); 20 μmol/L外源BMAA 導致固氮念珠藻Nodulariasp. PCC7120生長停滯和細胞內糖原的積累(Berntzonetal, 2013),也可抑制魚腥藻Anabaenasp. PCC7120 細胞分化過程相關的hetR基因和hepA基因的表達和固氮酶活性(Popovaetal, 2018); 0.5 μmol/L 的BMAA 可導致三角褐指藻(Phaeodactylumtricornutum)和威氏海鏈藻(Thalassiosiraweissflogii)細胞內葉綠素a的含量降低,且干擾藻細胞內氮的代謝過程(Lageetal, 2016)。有關BMAA 與水生植物的暴露實驗表明, BMAA 能夠引起羅蔓藤蕨(Lomariopsislineata)、水蘚(Fontinalis antipyretica)、鹿角苔(Ricciafluitans)、爪哇莫絲(Taxiphyllumbarbieri) 和金魚藻(Ceratophyllum demersum)等水生植物組織中抗氧化酶活性降低, 且在短時間內不能恢復(Esterhuizen-Londtet al, 2011;Contardo-Jaraet al, 2013)。另外, BMAA 可影響大型蚤(Daphniamagna)的存活、運動和繁殖能力(Lürlinget al, 2011); 導致斑馬魚(Daniorerio)胚胎心率減慢、心包水腫、脊髓軸異常和痙攣驚厥等癥狀(Purdieet al,2009; Wang, 2015); 抑制海膽(Lytechinuspictus)胚胎的受精和發育, 出現細胞分裂異常和畸形發育(Liet al, 2020)。由此來看, BMAA 毒素對多種水生生物具有普遍的毒性作用, 威脅海洋生物的健康和生態系統的結構與功能。
海洋微藻作為海洋生態系統最主要的初級生產者, 對海洋生態系統的物質循環和能量流動起著重要作用。海洋硅藻作為BMAA 毒素的重要來源, 在正常生長代謝或細胞死亡后會將水溶性的BMAA 毒素釋放到胞外, 直接與海洋生物暴露接觸, 并可通過化學生態學作用影響海洋生態系統的演化。然而目前有關BMAA 對海洋微藻毒性效應的研究較少, 對其致毒機理的認識也很有限, 有關外源BMAA 跨膜進入微藻細胞的過程及環境中氨基酸的影響尚不清楚。本研究選擇我國近海分布的典型餌料藻——球等鞭金藻(Isochrysisgalbana)為研究對象, 對其在BMAA暴露條件下的生長狀況和吸收毒素的情況進行了分析, 并比較分析了不同氨基酸單獨及其與BMAA 聯合暴露條件下對球等鞭金藻的影響, 以期揭示BMAA 對海洋浮游植物的化學生態學作用。
1 材料與方法
1.1 實驗材料
球等鞭金藻(3011)由中國海洋大學水產學院藻種庫提供。BMAA 標準物質(L-BMAA hydrochloride,B107-10 mg)和DAB 標準物質(DL-2,4-diaminobutyric acid dihydrochloride, D3758-1 g)購自美國Sigma 公司,AEG 標準物質[N-(2-aminoethyl) glycine, A608975-1 g]購自加拿大TRC 公司。氨基酸標準物質和優級純鹽酸購自國藥集團化學試劑有限公司。分析純三氯乙酸和色譜純乙腈購自德國Merck 公司, 色譜純甲酸購自美國Sigma 公司。新鮮海水取自青島市嶗山區流清河附近海域。超純水是由Direct-Q?8 UV-R 純水系統(美國 Millipore)制備。毒素分析用色譜柱 TSK-Gel Amide-80?(250 mm × 2 mm, 5 μm)購自日本Tosoh 生物科技有限公司。
1.2 BMAA 單獨暴露條件下球等鞭金藻的生長狀況
1.2.1 球等鞭金藻的室內培養 將新鮮海水經0.45 μm 混合纖維濾膜過濾, 按照不含硅的f/2 培養基配方(Guillardet al, 1993)添加氮磷營養液, 然后在高壓滅菌鍋中進行高溫滅菌(121 °C, 20 min), 待冷卻至室溫后添加維生素和微量元素, 用于球等鞭金藻的批次培養。選用250 mL錐形瓶, 培養體系100 mL, 在無菌環境中接種藻液, 初始密度為3×105cells/mL 左右, 接種后立刻添加相應的BMAA 毒素。根據BMAA暴露對球等鞭金藻的預實驗結果, 分別設置空白對照組和200、250、300、350、400 μg/L BMAA·HCl染毒組進行毒理學實驗, 每組設置3 個平行。將培養液放置在光照培養箱(HDL HPG-280BX, 哈爾濱東聯電子技術開發有限公司)內, 設置溫度18 °C, 光照強度6 000 lx, 光暗比12 h∶12 h, 每天分3 次定時輕輕搖勻微藻培養液, 并隨機更換培養箱中藻液的位置。
1.2.2 球等鞭金藻的生長曲線及96 h 半效應濃度(96 h-EC50)的計算 染毒培養實驗開始后每天取1 mL 藻液, 使用血球計數板在倒置顯微鏡(CKX53,日本Olympus)下計數, 每瓶藻液搖勻后重復計數3 次,取平均值記錄藻細胞的生長密度并繪制生長曲線。在96 h 后, 根據《化學品: 藻類生長抑制試驗(GB/T 21805—2008)》中的相關計算方法計算比生長率和抑制率, 以體系中BMAA·HCl 濃度的對數值為橫坐標,以抑制率為縱坐標, 繪制劑量—效應曲線, 采用直線內插法確定BMAA·HCl 對球等鞭金藻的96 h-EC50值。比生長率按照下列公式計算:
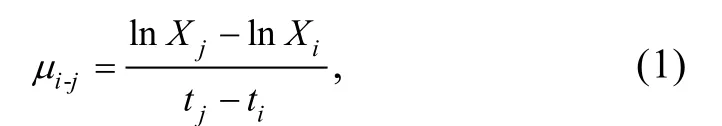
式中,μi-j: 從i時刻到j時刻的比生長率, 單位: d-1;Xi:i時刻的藻細胞密度;Xj:j時刻的藻細胞密度。
抑制率按照下列公式計算:
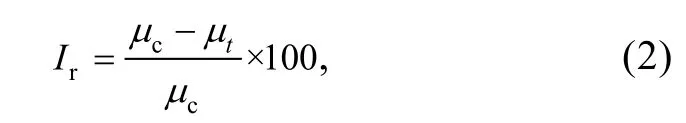
式中,Ir: 以比生長率為基礎的抑制率, 單位: %;μc:對照組中各平行處理的比生長率的平均值;μt: 染毒組中各平行處理的比生長率的平均值。
1.3 球等鞭金藻對外源BMAA 的吸收及其氨基酸含量的測定
1.3.1 球等鞭金藻的室內培養與藻細胞的收集 采用1.2.1 部分相同的方法準備微藻培養液, 選用1 L錐形瓶, 培養體系500 mL, 接種的初始密度為5×105cells/mL 左右, 設置空白對照組和100、300、700 μg/L BMAA·HCl 染毒組共4 組, 每組3 個平行。在溫度18 °C, 光照強度6 000 lx, 光暗比12 h∶12 h條件下培養, 每天分3 次定時搖勻藻液, 并隨機更換藻液的位置, 降低光照條件的影響。采用1.2.1 部分相同的方法計數微藻的細胞密度。在球等鞭金藻染毒培養96 h 后, 充分搖勻藻液, 每組取100 mL 于4 °C下以8 000 r/min 轉速離心10 min 收集藻細胞, 用于測定藻細胞中BMAA 的含量。另取空白對照組和300 μg/L BMAA·HCl 組每瓶藻液各400 mL, 于4 °C下以8 000 r/min 轉速離心10 min 收集藻細胞, 盡量去除上清液, 記錄藻泥濕重, 用于測定藻細胞中氨基酸的含量。將收集到的藻泥置于-20 °C 冰箱中保存待測。
1.3.2 藻細胞中BMAA 的提取 向含有藻泥的離心管中加入3 mL 0.1 mol/L 的三氯乙酸, 渦旋混勻,于冰浴中超聲破碎10 min, 最后在4 °C 條件下以8 000 r/min 轉速離心5 min。取離心后的上清液1 mL,經0.22 μm 水系濾膜過濾至1.5 mL 進樣瓶, 得到的游離態BMAA 提取液置于-20 °C 冰箱中保存。取離心后的上清液1 mL 轉移至4 mL 進樣瓶中, 在55 °C 條件下氮吹, 吹干后加入1 mL 6 mol/L 鹽酸溶解, 渦旋混勻后在110 °C 下水解24 h, 冷卻至室溫后再次氮吹, 吹干后加入1 mL 20 mmol/L 鹽酸重新溶解, 經0.22 μm 水系濾膜過濾至1.5 mL 進樣瓶中, 得到的總溶解態BMAA 提取液置于-20 °C 冰箱中保存。移除上清液后, 向沉淀中加入2 mL 6 mol/L 鹽酸, 渦旋混勻后轉移至4 mL 進樣瓶中, 在110 °C 條件下水解24 h, 冷卻至室溫后在55 °C 條件下氮吹, 吹干后加入1 mL 20 mmol/L 鹽酸重新溶解, 經0.22 μm 水系濾膜過濾至1.5 mL 進樣瓶中, 將得到的沉淀結合態BMAA 提取液置于-20 °C 冰箱中保存。
1.3.3 藻細胞中氨基酸的提取 參考《食品中氨基酸的測定(GB/T 5009.124—2016)》, 稍作修改。向含有藻泥的離心管中加入5 mL 6 mol/L HCl, 渦旋混勻,轉移至10 mL 消解管中, 充入高純氮氣, 在110 °C 條件下水解22 h。水解結束后冷卻至室溫, 將水解液用濾紙過濾到25 mL 容量瓶中, 用超純水多次沖洗水解管, 經濾紙過濾后合并轉移至25 mL 容量瓶內, 用超純水定容, 混勻。取2 mL 定容后的溶液至4 mL 樣品瓶中, 55 °C 條件下用氮氣吹干, 然后加入 1 mL 20 mmol/L 鹽酸重新溶解, 經0.22 μm 水系濾膜過濾至1.5 mL 進樣瓶中, 得到的氨基酸提取液置于-20 °C 冰箱中保存。
1.3.4 BMAA 毒素分析 使用Agilent 1290 高效液相色譜串聯Agilent 6430 三重四極桿質譜儀系統(美國Agilent 公司), 不經衍生直接測定BMAA 的含量, 具體參數如下:
色譜柱為 TSK-Gel Amide-80?HILIC 色譜柱(250 mm × 2 mm, 5 μm), 柱溫40 °C, 進樣體積5 μL,流速 350 μL/min, 采用梯度洗脫, 流動相A 為含有50 mmol/L 甲酸的水溶液, 流動相B 為含有50 mmol/L甲酸的乙腈溶液。在0~15 min 內, 流動相A 由10%升高至40%, 保持4 min 后, 在19.01 min 切換為45%并保持至27 min, 在27.01 min 切換到10%并保持至30 min。
質譜聯接接口為電噴霧離子源, 霧化器壓力40 psi,毛細管電壓4 000 V, 電噴霧電壓5 500 V, 霧化氣為N2, 霧化溫度450 °C, 干燥氣體溫度350 °C, 干燥氣體流速10 L/min。根據毒素的保留時間和質譜參數,采用多反應監測模式進行定性和定量分析。使用的變遷離子為119→102、119→101、119→88、119→56和119→44, 碎裂電壓60 V, 碰撞能分別為8、5、8、15 和20 V。在使用的5 個變遷離子中, BMAA、DAB和AEG 分別缺少119→101、119→88 和119→88, 均具有4 個不同的變遷離子用于定性分析。在定量計算BMAA、DAB 和AEG 濃度時, 分別采用變遷離子119→88、119→101 和119→102 的峰面積進行計算。
1.3.5 藻細胞中氨基酸的分析 應用 Hitachi L-8800 氨基酸自動分析儀測定藻細胞中天冬氨酸、蘇氨酸、絲氨酸、谷氨酸、甘氨酸、丙氨酸、纈氨酸、蛋氨酸、異亮氨酸、亮氨酸、酪氨酸、苯丙氨酸、賴氨酸、組氨酸、精氨酸和脯氨酸共16 種氨基酸的含量。參照《食品中氨基酸的測定(GB/T5009.124-2016)》中的要求, 色譜柱選用磺酸型陽離子樹脂, 柱溫50 °C, 反應器溫度135 °C, 進樣量20 μL, 泵1 流速0.40 mL/min, 泵2 流速0.35 mL/min, 檢測波長570和440 nm, 采用外標法通過峰面積計算樣品測定溶液中氨基酸的濃度。
樣品中氨基酸含量Xi(%)按照下列公式計算:
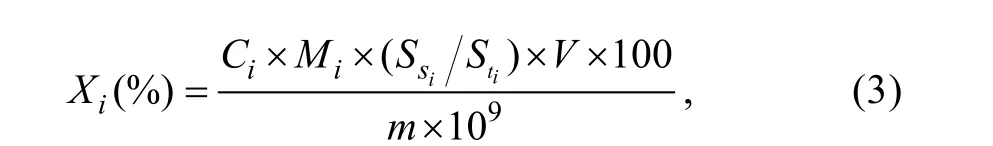
式中,Ci: 標準氨基酸濃度(nmol/mL);Mi: 氨基酸分子量;Sis: 標準品的峰面積;Sti: 樣品的峰面積;V:樣品水解液轉移定容的體積(mL);m: 樣品濕重(g)。
1.4 BMAA 與氨基酸聯合作用對球等鞭金藻生長狀況的影響
1.4.1 球等鞭金藻的室內培養及96 h 抑制率的計算采用1.2.1 部分相同的方法配制微藻培養液, 選用250 mL 錐形瓶, 培養體系150 mL, 接種的初始密度在5×105cells/mL 左右。參考前面的研究結果, 選取BMAA 對球等鞭金藻的96 h-EC50值(2 μmol/L)為暴露濃度, 設置空白對照組、2 μmol/L 單一氨基酸組(20種氨基酸對應20 組)、2 μmol/L 20 種氨基酸組、2 μmol/L BMAA 組、2 μmol/L (BMAA+單一氨基酸)組(20 種氨基酸對應20 組)、2 μmol/L (BMAA+20 種氨基酸)組共44 組, 每組3 個平行。設置光照培養箱溫度18 °C, 光照強度6 000 lx, 光暗比12 h∶12 h,每天分3 次定時搖勻藻液, 并隨機更換藻液的位置。采用1.2.2 部分相同的方法, 計數藻細胞密度, 并計算比生長率和抑制率。
1.4.2 藻細胞中BMAA 的提取和分析 球等鞭金藻染毒培養96 h 后, 充分搖勻藻液, 選取空白對照組、2 μmol/L BMAA 組、2 μmol/L (BMAA+色氨酸)組、2 μmol/L (BMAA+谷氨酰胺)組、2 μmol/L(BMAA+蛋氨酸)組、2 μmol/L (BMAA+精氨酸)組、2 μmol/L (BMAA+絲氨酸)組共 7 組, 每瓶藻液取100 mL 于4 °C 條件下以8 000 r/min 轉速離心10 min收集藻細胞, 離心后的上清液用于提取總溶解態BMAA。BMAA 毒素提取和分析方法分別見1.3.2 和1.3.4 部分。
1.5 數據統計分析
全部數據采用SPSS 20.0 軟件進行分析, 在P<0.05 水平下通過單因素方差分析(One way ANOVA)對不同處理組的數據進行兩兩比較, 用不同的字母表示兩組數據間具有顯著性差異。
2 結果與討論
2.1 BMAA 對球等鞭金藻生長的抑制效應
不同濃度的BMAA 與球等鞭金藻暴露接觸96 h后微藻的生長曲線如圖1 所示。從圖中可以看出, 球等鞭金藻與不同濃度的BMAA 暴露接觸24 h 后即表現出生長密度的差異, 隨著培養時間的延長這種差異越來越明顯。在96 h 內, BMAA 對球等鞭金藻生長的抑制效應與培養體系中BMAA 的濃度呈正相關關系。暴露接觸 96 h 后, 與對照組相比, 200 μg/L BMAA·HCl 對球等鞭金藻的生長抑制率僅為5%, 表現為輕微抑制; 而當濃度增加至250 μg/L 時, 生長抑制率迅速提高至36%; 在最高暴露濃度400 μg/L 時,生長抑制率達到88%, 球等鞭金藻的生長幾乎被完全抑制。需要指出的是, 在前期實驗中已經驗證了毒素溶劑中2 mmol/L HCl 對球等鞭金藻的生長未見影響, 因此可以確定外源BMAA 對球等鞭金藻的比生長率產生了抑制效應。
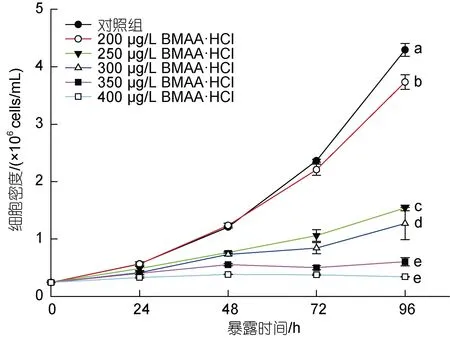
圖1 不同濃度BMAA 暴露條件下球等鞭金藻的生長曲線Fig.1 Growth curves of Isochrysis galbana (3011) under different concentrations of BMAA during 96-hours exposure period
參考《化學品: 藻類生長抑制試驗(GB/T 21805—2008)》中繪制受試微藻劑量-效應曲線的方法, 使用染毒96 h 后不同濃度BMAA 實驗組中微藻的抑制率和對應的BMAA 毒素濃度的對數值做相關性分析,得到擬合曲線Y=2.638 6X-6.023 8,R2=0.970 1, 說明劑量-效應曲線的線性關系良好。最后計算得BMAA毒素對球等鞭金藻的 96 h-EC50值為 297 μg/L BMAA·HCl, 約為2 μmol/L BMAA。
本研究首次發現了外源BMAA 毒素對球等鞭金藻生長的抑制效應, 這種毒性效應與前期報道的藍藻藻株的 BMAA 毒素暴露實驗的結果相似。在向BG11 培養基中加入 4.2 μmol/L (約合 649 μg/L BMAA·HCl) 和 42 μmol/L ( 約 合 6 493 μg/L BMAA·HCl)的外源BMAA 后, 48 h 內BMAA 對集胞藻PCC6803 的生長具有明顯的抑制作用, 染毒組藻液顏色明顯淺于對照組, 表現出萎黃病的癥狀, 平均比生長率也始終低于對照組(高濃度染毒組的平均比生長率甚至為負數, 呈現負增長), 在192 h 內無法恢復至對照組的藻細胞密度(Downingetal, 2012)。另一項研究表明, 20 μmol/L 外源BMAA (約合3 092 μg/L BMAA·HCl)能夠造成固氮念珠藻PCC7120 在48 h 內生長完全停滯, 并出現類似萎黃病的癥狀, 但這種抑制效應在染毒7 d 后逐漸消失, 表明藍藻細胞內的BMAA 能夠被代謝或降解(Berntzonetal, 2013)。此外,20 μmol/L 外源BMAA 在48 h 內顯著抑制魚腥藻PCC7120 的生長, 當毒素濃度增加至50 μmol/L 和100 μmol/L 時受試藻細胞生長完全停滯, 并出現了細胞裂解的現象(Popovaetal, 2018)。本研究中使用的BMAA 暴露濃度遠低于這些毒性實驗中使用的劑量,但在暴露濃度400 μg/L BMAA·HCl 時, 球等鞭金藻的比生長率的抑制率已高達88%, 說明球等鞭金藻對BMAA 的毒性效應相對藍藻而言更敏感。本研究中各實驗組的藻液顏色在染毒8 d 后也逐漸加深, 表明BMAA 對球等鞭金藻的抑制效應隨時間延長逐漸減弱。
2.2 球等鞭金藻對外源BMAA 的吸收及其氨基酸含量分析
2.2.1 球等鞭金藻對外源BMAA 的吸收 本研究采用LC-MS/MS 方法分析了球等鞭金藻與BMAA 毒素暴露培養96 h 后藻細胞內的BMAA 及其同分異構體DAB 和AEG 的含量, 色譜圖如圖2 所示。從圖中可以看出, 空白對照組培養的球等鞭金藻細胞內未檢出BMAA 和AEG, 但含有少量的DAB 毒素, 而在與BMAA 暴露培養96 h 后的球等鞭金藻細胞內檢出BMAA, 說明外源BMAA 可以進入藻細胞內抑制球等鞭金藻的有絲分裂過程。關于DAB 的檢出并不意外, 已有大量研究報道藍藻、硅藻、貝類及其他水生動物樣品中檢出DAB, 且未見明顯的種間差異, 總體含量較低(Réveillonetal, 2014; Fanetal, 2015; Lietal, 2018; Wangetal, 2021)。該毒素不是本研究的重點, 在此不作詳細討論。

圖2 LC-MS/MS 分析BMAA、DAB 和AEG 的色譜圖Fig.2 LC-MS/MS chromatograms of (a) BMAA, DAB and AEG mixed standards, (b) total soluble bound extract of Isochrysis galbana(3011) from the control group, and (c) total soluble bound extract of I. galbana (3011) after 96-hours exposure to 300 μg/L BMAA·HCl
染毒96 h 后球等鞭金藻單位細胞中BMAA 和DAB 含量如圖3 所示。從圖中可以看出, 染毒后細胞中BMAA 主要以總溶解態形式(>99%)存在, 沉淀結合態BMAA 的含量很低; 在總溶解態BMAA 中, 約有36%~51%的BMAA 是以游離態形式存在, 并且單位細胞內游離態和總溶解態BMAA 的含量與體系中外源BMAA 的加入量呈正相關, 進一步說明細胞內的BMAA 來自于培養基中的外源毒素。球等鞭金藻細胞中DAB 的本底值為0.12 fg/cell, DAB 在球等鞭金藻細胞中主要以溶解結合態為主, 幾乎不含沉淀結合態形式; 僅在濃度最高的700 μg/L BMAA·HCl實驗組中檢出游離態DAB。雖然所有實驗組中球等鞭金藻細胞中DAB 含量普遍較低(<6 fg/cell), 但單位細胞內DAB 含量也隨著BMAA 暴露濃度的增加而升高, 與體系中外源BMAA 的加入量呈正相關。目前尚無法解釋這種現象, 推測可能是球等鞭金藻在吸收外源BMAA 的過程中, 轉化產生了少量的DAB,也可能是由于球等鞭金藻受到BMAA 毒素的抑制脅迫后, 使得DAB 的合成量升高。

圖3 BMAA 暴露接觸96 h 后球等鞭金藻單位細胞中BMAA (a) 和DAB (b) 的含量Fig.3 Concentrations of BMAA (a) and DAB (b) detected in Isochrysis galbana (3011) after 96-hours exposure to BMAA
據報道, 集胞藻PCC6803 在含有0.5 和5 μmol/L的BMAA 培養基中暴露接觸10 min 后, 單位細胞內游離態和沉淀結合態BMAA 含量明顯上升, 且表現出明顯的濃度依賴性, 但在24 h 后單位細胞中游離態和蛋白結合態BMAA 含量逐漸下降, 蛋白結合態BMAA 在72 h 時已無法檢出, 表明藍藻能夠迅速吸收體系中的BMAA 并逐漸將其代謝排出或轉化為其他物質(Downingetal, 2012)。念珠藻PCC7120 在1 min 內也能夠迅速吸收體系中的10 μmol/L 外源14C-BMAA, 且單位細胞內14C-BMAA 在30 min 內持續增加(Berntzonetal, 2013)。海洋硅藻三角褐指藻和威氏海鏈藻在添加0.05 μmol/L 外源BMAA 的培養體系中, 單位細胞內游離態和蛋白結合態BMAA 的含量在96 h 內呈現先升高后降低的趨勢(Lageetal,2016)。另外在細菌與外源 BMAA 的暴露實驗中(100 μM BMAA), 發 現Escherichiacoli、Staphylococcusepidermis、Lactobacilluscasei、Bacillus subtilis、Pseudomonasaeruginosa和Micrococcus luteus6 種細菌均檢出游離態和沉淀結合態BMAA(van Onselenetal, 2015)。但這些研究中均未檢測BMAA 的其他同系物成分。
2.2.2 球等鞭金藻與BMAA 暴露接觸后細胞內氨基酸含量的變化 球等鞭金藻與BMAA 暴露接觸96 h 后細胞中16 種氨基酸含量與空白對照組的對比如圖4 所示。需要指出的是, 本研究采用鹽酸水解法提取球等鞭金藻細胞內的氨基酸, 由于色氨酸和半胱氨酸在水解過程中被破壞, 天冬酰胺和谷氨酰胺在水解過程中轉化為天冬氨酸和谷氨酸, 因此本方法只能檢測其他16 種氨基酸的含量。從圖4 可以看出, 除纈氨酸(Val)外, 其余15 種氨基酸在球等鞭金藻細胞中均被檢出, 對照組和 2 μmol/L BMAA(300 μg/L BMAA·HCl)組中含量最高的氨基酸均為絲氨酸, 分別占藻細胞氨基酸總量的74.2%和54.7%。早期人們對球等鞭金藻主要營養成分的分析結果顯示, 氨基酸總量占藻細胞干重的33.74%, 必需氨基酸總量占藻細胞干重的16.26% (陳椒芬等, 1987)。鄢朝(2012)對球等鞭金藻的測定結果顯示, 谷氨酸的含量最高, 占細胞干重的5.09%, 氨基酸總量占細胞干重的32.15%, 必需氨基酸總量占細胞干重的13.41%。假定離心收集后的藻細胞含水率在80%左右, 換算后本研究中對照組球等鞭金藻氨基酸總量占藻細胞干重的26.15%, 基本與上述研究結果一致。此外, 與對照組相比, 300 μg/L BMAA·HCl 未顯著影響球等鞭金藻細胞內氨基酸的種類和組成比例(P>0.05), 但除組氨酸(His)外, 其余14 種氨基酸的含量均明顯降低(P<0.05), 其中以酪氨酸(Tyr)、丙氨酸(Ala)和絲氨酸(Ser)最為明顯, 分別降低了36%、34%和26%, 表明BMAA 在抑制球等鞭金藻細胞分裂的過程中也降低了細胞內的氨基酸合成。
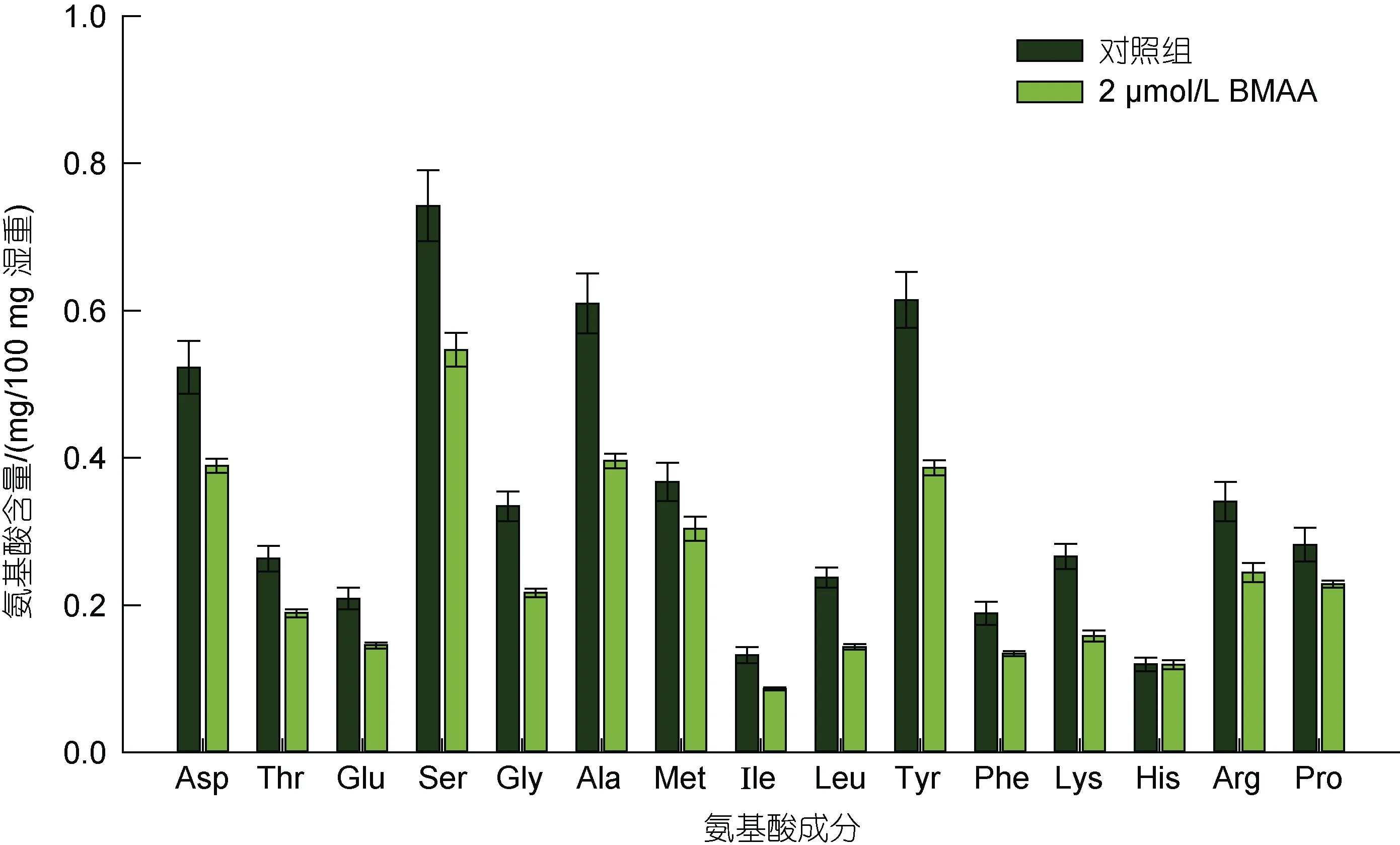
圖4 BMAA 暴露接觸96 h 實驗組與對照組中球等鞭金藻細胞中氨基酸含量的對比(mg/100 mg 濕重)Fig.4 Comparison in the content of amino acids (mg/100 mg wet weight) in Isochrysis galbana (3011) after 96-hours exposure to BMAA and control groups
2.3 氨基酸和BMAA 聯合作用對球等鞭金藻生長狀況的影響
2.3.1 氨基酸可促進BMAA 對球等鞭金藻生長的抑制效應 氨基酸單獨或與BMAA 聯合作用于球等鞭金藻96 h 后的生長抑制率如表1 所示。從表中可以看出, 20 種氨基酸單獨作用于球等鞭金藻的生長抑制率均在±3%以內, 表明外加2 μmol/L 的氨基酸對球等鞭金藻的生長沒有明顯的影響。除溶解性無機氮(dissolved inorganic nitrogen, DIN)外, 溶解性有機氮(dissolved organic nitrogen, DON)也是海洋微藻的重要氮源, 其中溶解性游離態氨基酸(dissolved free amino acid, DFAA)在海洋中的濃度通常低于5 μmol/L (徐寧等, 2013)。部分海洋微藻在DIN 含量不足的情況下能夠通過多種方式利用環境中的DFAA, 如通過細胞膜上的氨基酸轉運系統, 將與Na+形成絡合物的DFAA和Na+一起轉運進入細胞, 同時將K+排出細胞, 從而吸收環境中部分帶有電荷的特定DFAA (Johnet al,1999)。此外, 部分微藻能夠與細菌相互作用, 利用細菌產生的多肽水解酶將海洋環境中的多肽分解為DFAA, 同時釋放L-氨基酸氧化酶, 將DFAA 氧化為銨鹽, 從而間接利用DFAA(Mulhollandetal, 2003)。氨基酸在藻細胞生命活動中起著重要作用, 通常不會對微藻產生毒害作用, 有時微藻吸收利用環境中DFAA 的量甚至達到總氮吸收量的50%以上(徐寧等,2013)。前期研究發現, 4.2 和42 μmol/L 的外源精氨酸、天冬酰胺、谷氨酸和甘氨酸在192 h 內未對集胞藻 PCC6803 的生長產生抑制作用(Downingetal,2012); 羊角月牙藻(Selenastrumcarpricornutum)能夠直接吸收利用培養體系中10 μmol/L 的游離態絲氨酸、天冬氨酸、谷氨酸、甘氨酸、丙氨酸和精氨酸作為唯一氮源進行快速生長(翟天恩等, 2017); 銅綠微囊藻(Microcystisaeruginosa)能夠利用100 μmol/L 精氨酸、丙氨酸和亮氨酸作為氮源進行生長, 而谷氨酸、天冬氨酸和賴氨酸雖然不能被細胞利用, 但對藻細胞也未表現出毒害作用(Daietal, 2009)。本研究中添加的20 種外源氨基酸對球等鞭金藻的生長均沒有明顯的促進作用, 這可能是因為培養體系中含有較充足的DIN, 球等鞭金藻尚未啟動利用DFAA 的機制。
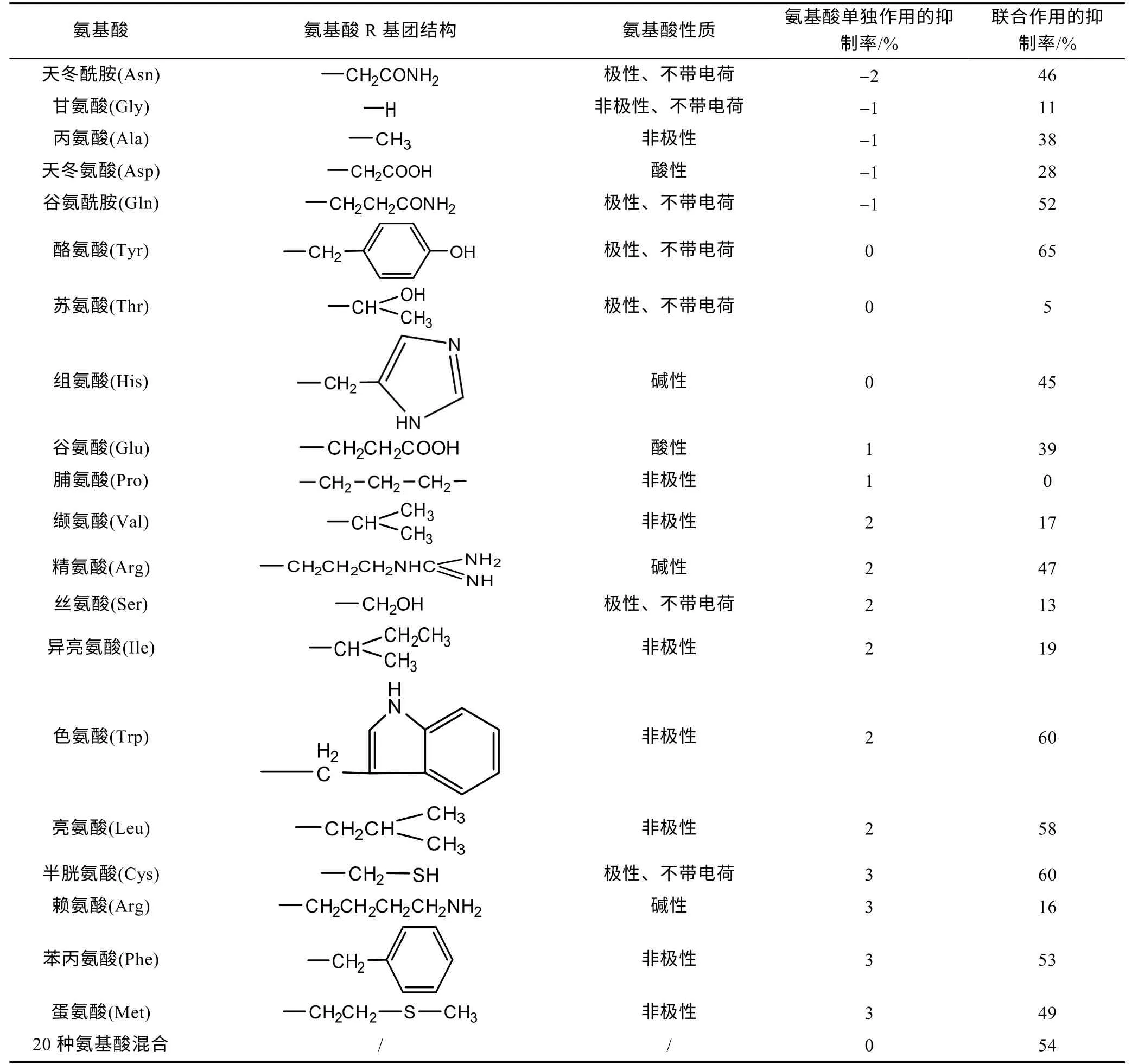
表1 氨基酸單獨作用(2 μmol/L)及其與BMAA 聯合作用(2 μmol/L BMAA+2 μmol/L 氨基酸) 96 h 后球等鞭金藻生長的抑制率Tab.1 The inhibition rates of Isochrysis galbana (3011) after 96-hours exposure to 2 μmol/L amino acids and mixed solution of 2μmol/L amino acids and 2 μmol/L BMAA
但本研究發現大部分氨基酸與BMAA 聯合作用時對球等鞭金藻的生長產生了明顯的抑制效應, 除2 μmol/L (BMAA+脯氨酸)組、2 μmol/L (BMAA+蘇氨酸)組和2 μmol/L (BMAA+甘氨酸)組, 其余18 個實驗組的96 h 生長抑制率均高于BMAA 單獨作用組(11%), 其中 2 μmol/L (BMAA+半胱氨酸)組、2 μmol/L (BMAA+色氨酸)組和2 μmol/L (BMAA+酪氨酸)組的96 h 生長抑制率高達60%。從氨基酸R 基的結構來看, 聯合毒性作用下96 h 生長抑制率超過50%的氨基酸均為非極性氨基酸和極性、不帶電荷的氨基酸, 而酸性氨基酸與堿性氨基酸的96 h 生長抑制率均未超過50%, 似乎表明非極性氨基酸和極性、不帶電荷的氨基酸與BMAA 聯合作用時對生長的抑制作用更強。需要指出的是, 在這批聯合毒性實驗中2 μmol/L BMAA 組的96 h 生長抑制率并沒有達到預期的50% (2.1 部分), 這可能與此次實驗所用的天然海水或者藻細胞初始生長狀況等因素有關。目前有關BMAA 與其他污染物對微藻聯合毒性作用的研究較少。據報道, 80 μg/L 的BMAA 與20 μg/L 的微囊藻毒素(MC-LR)聯合作用于一種淡水綠藻——毯藻Aegagropilalinnaei, 發現兩種毒素單獨作用下的抗氧化酶活性在染毒1 和7 d 后沒有明顯變化(P>0.05),聯合作用下也只有過氧化氫酶的活性明顯升高(P<0.001), 表明這兩種毒素的聯合作用毒性較弱(Contardo-Jaraetal, 2015)。
2.3.2 氨基酸和BMAA 聯合作用下球等鞭金藻對BMAA 的吸收情況 本研究2.2 部分已表明球等鞭金藻細胞中BMAA 和DAB 主要以總溶解態的形式存在, 因此該部分實驗中只分析了部分實驗組染毒96 h后單位細胞中總溶解態BMAA 和DAB 的含量, 結果如圖 5 所示。結果表明, 聯合毒性作用較強的2 μmol/L (BMAA+色氨酸)組、2 μmol/L (BMAA+谷氨酰胺)組、2 μmol/L (BMAA+蛋氨酸)組和2 μmol/L(BMAA+精氨酸)組中單位細胞內總溶解態BMAA 和DAB 的含量均明顯高于對照組和2 μmol/L BMAA 單獨作用組(P<0.05), 而聯合毒性作用較弱的2 μmol/L(BMAA+絲氨酸)組(96 h 生長抑制率為13%)中單位細胞內總溶解態BMAA 和DAB 的含量與2 μmol/L BMAA 單獨作用組(96 h 生長抑制率為11%)相近, 表明單位細胞內總溶解態BMAA 和DAB 含量與96 h生長抑制率之間具有一定的正相關性。由此來看, 氨基酸與BMAA 聯合暴露的過程中, 氨基酸促進了球等鞭金藻對外源BMAA 毒素的吸收, 從而使得聯合作用實驗組中球等鞭金藻的96 h 抑制率明顯升高。這可能是因為當培養基中額外添加氨基酸時, 球等鞭金藻細胞上更多的氨基酸通道被打開, 使得更多的BMAA 分子通過這些氨基酸通道進入細胞內。但有關BMAA 抑制球等鞭金藻細胞分裂的機制尚不清楚, 有待深入研究。
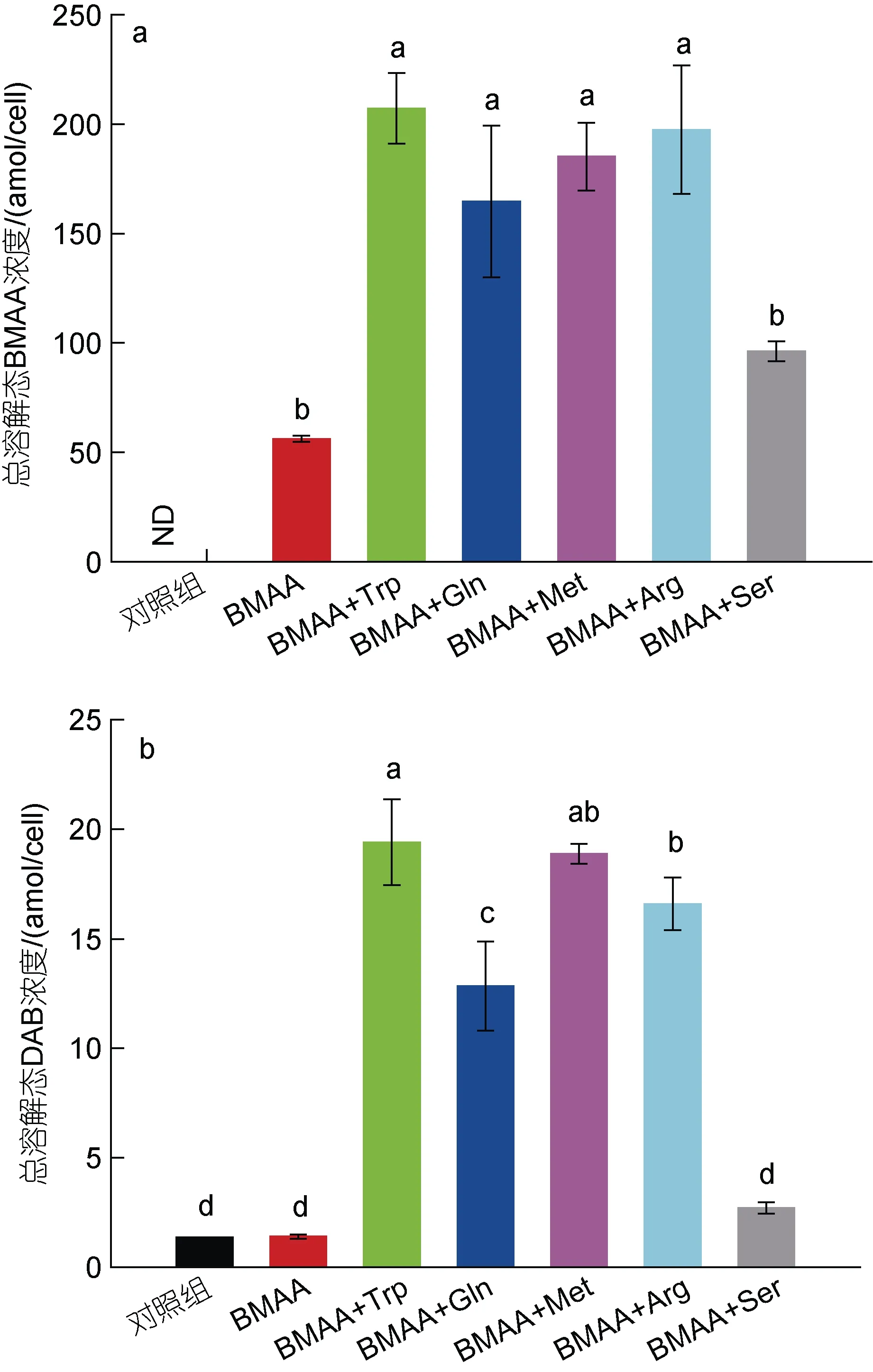
圖5 染毒96 h 后球等鞭金藻單位細胞總溶解態BMAA (a)和DAB (b)的含量Fig.5 Contents of total soluble BMAA (a) and DAB (b) in Isochrysis galbana (3011) after 96-hours exposure
3 結論
本研究首次探究了神經毒素BMAA 對海洋球等鞭金藻的毒性作用, 其對球等鞭金藻比生長率的抑制效應濃度96 h-EC50約為2 μmol/L。球等鞭金藻能夠吸收培養體系中的外源BMAA 毒素, 且吸收量與BMAA 的添加濃度呈正相關; 進入藻細胞內的BMAA 毒素多半以溶解結合態的形式存在, 且DAB的含量也隨著 BMAA 暴露濃度的增加而升高; 在BMAA 毒素暴露實驗組中, 球等鞭金藻細胞中除纈氨酸外, 所測的其他15 種氨基酸的合成量明顯降低。大多數氨基酸在與BMAA 聯合作用的過程中, 促進了球等鞭金藻對外源BMAA 的吸收, 增強了BMAA對球等鞭金藻生長的抑制效應。

