精辨析 巧突破
張波


陰陽離子的判斷、元素周期表單元格的理解、溶解度曲線及其應用是初中化學非常重要的基礎內容,常以選擇題的形式進行考查。
一、原子和離子
1. 易錯指數:★★★
2. 易錯點辨析:
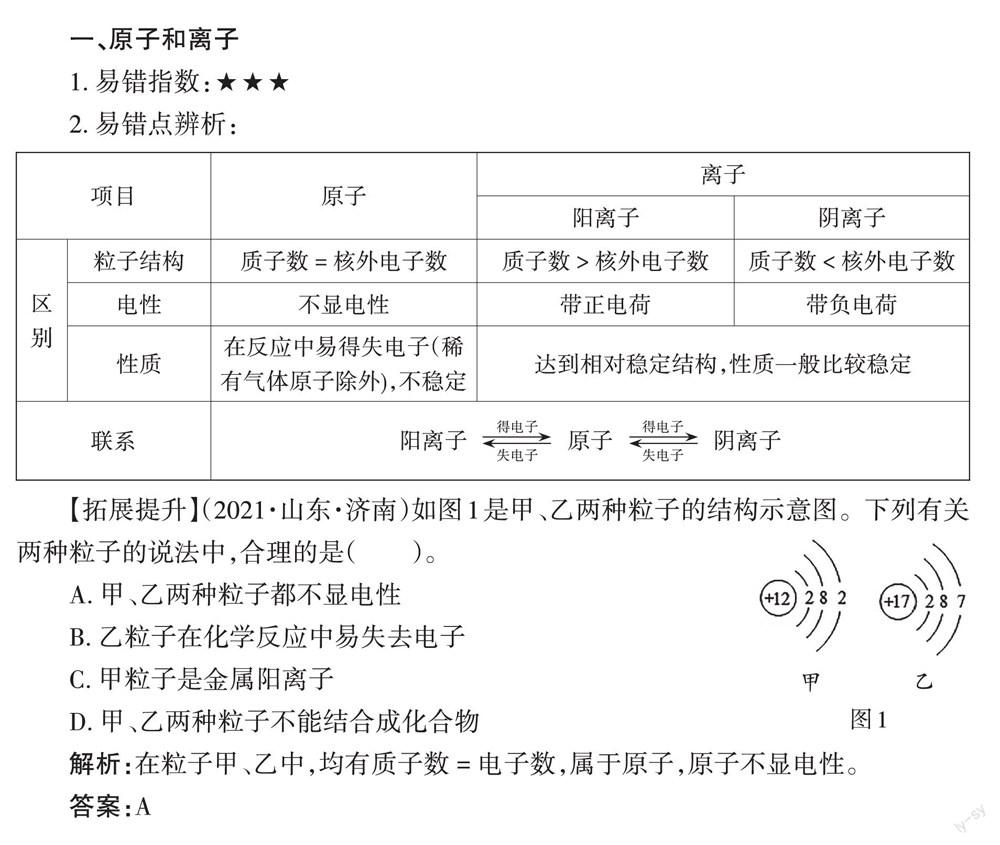
【拓展提升】(2021·山東·濟南)如圖1是甲、乙兩種粒子的結構示意圖。下列有關兩種粒子的說法中,合理的是()。
A. 甲、乙兩種粒子都不顯電性
B. 乙粒子在化學反應中易失去電子
C. 甲粒子是金屬陽離子
D. 甲、乙兩種粒子不能結合成化合物
解析:在粒子甲、乙中,均有質子數 = 電子數,屬于原子,原子不顯電性。
答案:A
二、元素周期表
1. 易錯指數:★★★
2. 易錯點辨析:
(1)元素周期表單元格信息
在原子中,原子序數 = 核電荷數 = 質子數 = 核外電子數。
(2)元素周期表規律
①同一周期元素的原子核外電子層數相同;
②同一周期(除第一周期)元素的最外層電子數從左到右由1逐漸增至8,元素種類變化為金屬元素→非金屬元素→稀有氣體元素;
③同一族元素的原子最外層電子數相同,電子層數從上到下逐漸增加。
【拓展提升】(2021·四川·內江)2021年5月15日07時18分,我國“祝融號”火星車成功著陸火星。火星車采用了鈦合金等多種材料,鈦元素在元素周期表中的信息如圖2所示。下列有關鈦的說法錯誤的是()。
A. 鈦元素屬于金屬元素
B. 鈦原子的質量主要集中在其原子核上
C. 鈦原子的質子數為22
D. 鈦元素的相對原子質量為47. 87 g
解析:漢字下面的數字表示相對原子質量,是沒有單位的。
答案:D
三、溶解度曲線及其應用
1. 易錯指數:★★★★
2. 易錯點辨析:
(1)溶解度曲線的意義及應用:
①點:
a. 曲線上的點表示物質在該溫度下的溶解度的值。如圖3,P點表示t1℃時,A物質的溶解度為m2 g。
b. 兩條曲線的交點表示兩物質在該溫度下的溶解度相等或兩物質在該溫度下的飽和溶液的質量分數相同。如圖3,M點表示t2℃時,A、B兩種物質的溶解度相等,且都是m1 g。
②線:
a. 曲線表示物質的溶解度隨溫度變化而變化的趨勢。如圖3,A、B兩物質的溶解度都隨溫度的升高而增大。
b. 曲線的傾斜程度可表示物質的溶解度受溫度變化的影響程度。如圖3,相比之下,A物質的溶解度受溫度影響較大,B物質的溶解度受溫度影響較小。
c. 判斷結晶的方法:如圖3,若要從A的飽和溶液中析出晶體A,宜采用降溫結晶(冷卻熱飽和溶液)的方法;若要從B的飽和溶液中析出晶體B,宜采用蒸發結晶(恒溫蒸發溶劑)的方法。
d. 混合物的分離方法:分離可溶物和難溶物,用過濾法;分離幾種可溶性物質,用結晶法。結晶法分為蒸發結晶(恒溫蒸發溶劑)和降溫結晶(冷卻熱飽和溶液)兩種,如NaCl溶液中混有少量KNO3,為得到NaCl,可采用蒸發結晶(恒溫蒸發溶劑)的方法;KNO3溶液中混有少量NaCl,為得到KNO3,可采用降溫結晶(冷卻熱飽和溶液)的方法。
③面:
a. 溶解度曲線上方的區域表示該溫度下的飽和溶液,且有未溶解完的物質存在。
b. 溶解度曲線下方的區域表示該溫度下的不飽和溶液。
(2)溶解度與飽和溶液溶質質量分數的關系:
①在一定溫度下,同一種溶質的飽和溶液的溶質質量分數最大,計算式為:
溶質質量分數 = [溶解度溶解度+100 g] × 100%
②溶解度越大,則該溫度下該物質的飽和溶液溶質質量分數越大。
(3)飽和溶液與不飽和溶液的轉化:
不飽和溶液 [降溫、蒸發溶劑、加溶質][升溫、加溶劑] 飽和溶液
注意:①熟石灰和氣體等除外,它們的溶解度隨溫度升高而降低;②最可靠的轉化方法是:加溶質、蒸發溶劑。
【拓展提升】(2021·陜西)如圖4是甲、乙兩種固體物質的溶解度曲線,下列說法正確的是()。
A. 甲的溶解度大于乙
B. ?t1℃時,甲、乙飽和溶液中的溶質質量相等
C. 將t2℃的甲、乙飽和溶液降溫至t1℃時,析出固體質量甲大于乙
D. 將t1℃的甲、乙飽和溶液升溫至t2℃時,所得溶液中溶質的質量分數相等
解析:A選項比較溶解度大小時沒有指明溫度,錯誤;B選項沒有指明飽和溶液的質量,無法比較甲、乙飽和溶液中的溶質質量,錯誤;C選項將t2℃的甲、乙飽和溶液降溫至t1℃時,析出固體的質量大小無法判定(因為沒有指明飽和溶液的質量),錯誤;D選項將t1℃的甲、乙飽和溶液升溫至t2℃時,所得溶液中溶質的質量分數相等(因為溶質和溶劑的質量都不變),正確。
答案:D
(作者單位:大連南金實驗學校)

