神經調節輔助通氣對慢性阻塞性肺疾病急性加重期患者呼吸力學指標、肺順應性及機械通氣觸發延遲時間的影響
牟志芳,張趁英,康秀文,李勇,沈葉菊,董躍福
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一種具有氣流受限特征的呼吸系統疾病,其病情反復發作且病程遷延,嚴重影響患者的呼吸功能[1]。慢性阻塞性肺疾病急性加重期(acute exacerbation of chronic obstructive pulmonary disease,AECOPD)指患者在原有疾病基礎上,肺部受到外界刺激或感染導致病情短期內加重的征象,嚴重時可導致患者出現呼吸衰竭或休克,進而威脅患者的生命安全[2]。目前,臨床上缺乏治療AECOPD的特效藥物,常以血管活性藥物聯合抗感染藥物作為基礎治療,同時輔以機械通氣,以改善患者的臨床癥狀[3]。壓力支持通氣(pressure support ventilation,PSV)是一種傳統的有創機械通氣模式,其可在一定程度上改善患者的呼吸困難癥狀,在臨床上應用較為廣泛[4]。研究發現,PSV模式下呼吸衰竭患者存在不同程度的吸氣觸發延遲及吸呼氣切換延遲,從而增加呼吸機相關氣道反應及呼吸機依賴性[5]。神經調節輔助通氣(neuromodulation assisted ventilation,NAVA)可通過膈肌電活動(electrical activity of the diaphragm,EAdi)而觸發吸氣及吸呼氣切換,理論上可有效縮短或避免吸呼氣延遲或吸氣觸發延遲,繼而降低呼吸機相關并發癥發生率[6-7],但目前相關臨床研究有限,尚未達成共識或制定指南,仍處于探索階段。基于此,本研究旨在探討NAVA對AECOPD患者呼吸力學指標、肺順應性及機械通氣觸發延遲時間的影響,以期為NAVA在AECOPD中的應用提供證據。
1 對象與方法
1.1 研究對象 選取2016年5月至2021年2月連云港市第一人民醫院收治的72例AECOPD患者作為研究對象,采用隨機數字表法將其分為對照組和觀察組,各36例。對照組中男20例,女16例;年齡44~72歲,平均(61.0±4.7)歲;平均序貫器官衰竭評分(8.69±2.43)分;吸煙史14例;合并癥:高血壓12例,糖尿病3例。觀察組中男17例,女19例;年齡45~72歲,平均(61.2±4.9)歲;平均序貫器官衰竭評分(8.71±2.47)分;吸煙史11例;合并癥:高血壓13例,糖尿病4例。兩組患者性別(χ2=0.500,P=0.479)、年齡(t=0.186,P=0.853)、序貫器官衰竭評分(t=0.035,P=0.972)、吸煙史(χ2=0.551,P=0.458)、高血壓發生率(χ2=0.061,P=0.804)、糖尿病發生率(χ2=0.158,P=0.691)比較,差異無統計學意義。本研究經連云港市第一人民醫院醫學倫理委員會審批通過(KY-20160418001),所有患者家屬簽署知情同意書。
1.2 納入與排除標準 納入標準:(1)符合《慢性阻塞性肺疾病診治指南(2013年修訂版)》[8]中AECOPD的臨床診斷;(2)經無創輔助通氣等治療后患者呼吸衰竭癥狀仍無法減輕,呼吸中樞過度通氣(呼吸頻率≥40次/min)或抑制(呼吸頻率<8次/min),符合有創機械通氣的臨床指征;(3)年齡≥18歲;(4)內源性呼氣末正壓(endogenous positive end expiratory pressure,PEEP)≥3 cm H2O(1 cm H2O=0.098 kPa)。排除標準:(1)合并肺部或其他器官、組織惡性病變者;(2)合并消化性潰瘍出血、腸穿孔等急性消化道疾病者;(3)合并心、腦血管疾病者;(4)伴有凝血功能障礙或自身免疫性疾病者;(5)合并中樞神經病變、精神病或嚴重意識障礙者;(6)合并肝腎功能障礙者;(7)死亡者。
1.3 治療方法 所有患者行經口氣管插管,連接呼吸機(邁柯唯MAQUET SERVO-s),設定通氣模式。通氣前,將EAdi導管用0.9%氯化鈉溶液浸潤后,在呼吸機EAdi模塊檢測下經鼻腔置入,檢測信號顯示無P波、QRS復合波振幅衰減時,表明接近胃部,準確安放電極。通氣過程中結合患者實際血氣分析情況微調吸氧濃度,待自主呼吸試驗通過后嘗試撤機,撤機后轉為無創輔助通氣,若失敗則繼續行有創機械通氣。自主呼吸試驗評估標準[9]:無或小劑量血管活性藥物(如去甲腎上腺素<0.1 μg?kg-1·min-1)即可維持血流動力學穩定;在PEEP≤5 cm H2O且吸入氧濃度(fraction of inspire O2,FiO2)≤50%時,pH值>7.3、氧合指數>150 mm Hg(1 mm Hg=0.133 kPa),動脈血二氧化碳分壓(arterial carbon dioxide partial pressure,PaCO2)達到緩解期;意識狀態良好,自主呼吸能力和咳痰能力明顯好轉。
1.3.1 對照組 對照組患者通氣模式為PSV模式:呼吸機調整至PSV模式,PEEP自0 cm H2O開始,間隔180 s上調2 cm H2O,待達到一定程度后,潮氣量由增加轉為減少,將PEEP調整至潮氣量減少前的上一次數值,潮氣量以6 ml/kg左右作為上調支持壓力的標準,PEEP較為適宜。
1.3.2 觀察組 觀察組患者通氣模式為NAVA模式:呼吸機調整至NAVA模式,PEEP自10 cm H2O開始,間隔180 s下調2 cm H2O,EAdi模式檢測EAdi明顯升高后,將PEEP調整至EAdi升高前水平。NAVA參數設定:自開始上調NAVA水平,同期檢測氣道壓力變化,待氣道壓力由增加轉為平穩后,作為NAVA適宜水準,相關參數FiO2為50%、EAdi觸發敏感度為0.5 μV、吸呼氣轉換時機調整為EAdi信號強度峰值的0.7倍。
1.4 觀察指標
1.4.1 呼吸力學指標 通過邁柯唯MAQUET SERVO-s呼吸機記錄兩組患者通氣前及通氣24 h后吸氣壓力(參考范圍:≤20 cm H2O)、氣道峰壓(參考范圍:10~40 cm H2O)、平臺壓(參考范圍:5~13 cm H2O)。呼吸機持續檢測兩組患者通氣過程中分鐘通氣量(ventilation,VE,其參考范圍:6~9 L/min)、吸入潮氣量(inhalation tidal volume,VTi,其參考范圍:0.30~0.42 L)、呼吸頻率(參考范圍:12~20次/min)及EAdi峰值。
1.4.2 肺順應性 通過呼吸機記錄兩組患者通氣前及通氣24 h后肺順應性(參考范圍:816~1 428 ml/kPa)。
1.4.3 機械通氣時間及機械通氣觸發延遲時間 記錄兩組患者機械通氣時間及機械通氣24 h機械通氣觸發延遲時間〔包括吸氣觸發延遲時間(吸氣觸發延遲時間=EAdi起始時間-呼氣流速起始點時間)和吸呼氣切換延遲時間(吸呼氣切換延遲時間=EAdi峰值降至70%時的時間-呼氣流速起始點時間)〕。
1.4.4 并發癥 記錄兩組患者撤機后48 h內胸腔積氣、縱隔積氣、低血壓、肺部感染及氣道痙攣或氣管黏膜損傷等并發癥發生情況。
1.5 統計學方法 應用SPSS 23.0統計學軟件進行數據處理。計量資料以(±s)表示,組間比較采用成組t檢驗,組內比較采用配對t檢驗;計數資料以相對數表示,組間比較采用χ2檢驗。以P<0.05為差異有統計學意義。
2 結果
2.1 呼吸力學指標 通氣前,兩組患者吸氣壓力、氣道峰壓、平臺壓比較,差異無統計學意義(P>0.05);通氣24 h后,兩組患者吸氣壓力、氣道峰壓、平臺壓分別低于本組通氣前,且觀察組低于對照組,差異有統計學意義(P<0.05),見表1。兩組患者通氣過程中呼吸頻率比較,差異無統計學意義(P>0.05);觀察組患者通氣過程中VE、VTi及EAdi峰值低于對照組,差異有統計學意義(P<0.05),見表2。
表1 兩組患者通氣前和通氣24 h后呼吸力學指標比較(±s,cm H2O)Table 1 Comparison of respiratory mechanics indexes between the two groups before ventilation and 24 hours after ventilation
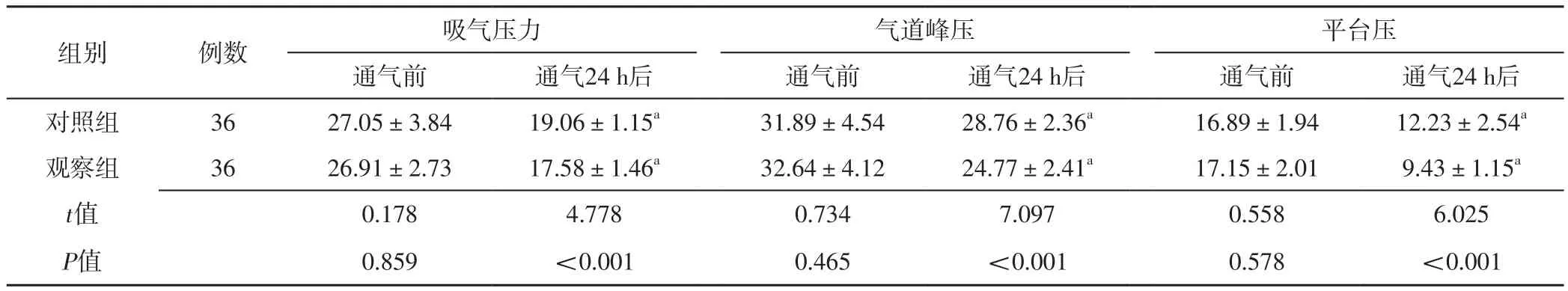
表1 兩組患者通氣前和通氣24 h后呼吸力學指標比較(±s,cm H2O)Table 1 Comparison of respiratory mechanics indexes between the two groups before ventilation and 24 hours after ventilation
注:a表示與本組通氣前比較,P<0.05
組別 例數 吸氣壓力 氣道峰壓 平臺壓通氣前 通氣24 h后 通氣前 通氣24 h后 通氣前 通氣24 h后對照組 36 27.05±3.84 19.06±1.15a 31.89±4.54 28.76±2.36a 16.89±1.94 12.23±2.54a觀察組 36 26.91±2.73 17.58±1.46a 32.64±4.12 24.77±2.41a 17.15±2.01 9.43±1.15a t值 0.178 4.778 0.734 7.097 0.558 6.025 P值 0.859 <0.001 0.465 <0.001 0.578 <0.001
表2 兩組患者通氣過程中呼吸力學指標比較(±s)Table 2 Comparison of respiratory mechanics indexes between the two groups during ventilation
注:VE=分鐘通氣量,Vti=吸入潮氣量,EAdi=膈肌電活動
組別 例數 VE(L/min) VTi(L) 呼吸頻率(次/min) EAdi峰值(μV)對照組 36 8.46±1.53 0.44±0.11 18.76±3.71 15.29±3.14觀察組 36 7.65±1.15 0.38±0.09 19.83±3.54 11.90±2.01 t值 2.539 2.533 1.252 5.456 P值 0.013 0.013 0.215 <0.001
2.2 肺順應性 對照組患者通氣前肺順應性為(534.6±69.8)ml/kPa,通氣24 h后為(817.5±92.4)ml/kPa;觀察組患者通氣前肺順應性為(539.5±74.0)ml/kPa,通氣24 h后為(746.4±80.5)ml/kPa。通氣前,兩組患者肺順應性比較,差異無統計學意義(t=0.289,P=0.773);通氣24 h后,兩組患者肺順應性分別低于本組通氣前(t配對值分別為14.654、11.349),且觀察組低于對照組(t=3.481),差異有統計學意義(P值均<0.001)。
2.3 機械通氣時間及機械通氣觸發延遲時間 觀察組患者機械通氣時間、吸氣觸發延遲時間及吸呼氣切換延遲時間均短于對照組,差異有統計學意義(P<0.05),見表3。
表3 兩組患者機械通氣時間及機械通氣觸發延遲時間比較(±s)Table 3 Comparison of mechanical ventilation time and trigger delay time of mechanical ventilation between the two groups

表3 兩組患者機械通氣時間及機械通氣觸發延遲時間比較(±s)Table 3 Comparison of mechanical ventilation time and trigger delay time of mechanical ventilation between the two groups
組別 例數 機械通氣時間(d) 吸氣觸發延遲時間(ms) 吸呼氣切換延遲時間(ms)對照組 36 8.71±1.13 107.96±29.63 101.34±8.74觀察組 36 8.09±1.02 63.51±7.89 49.71±6.25 t值 2.444 8.698 28.831 P值 0.017 <0.001 <0.001
2.4 并發癥發生率 對照組患者并發癥發生率為11.1%(4/36),與觀察組患者的8.3%(3/36)比較,差異無統計學意義(χ2=0.158,P=0.691),見表4。
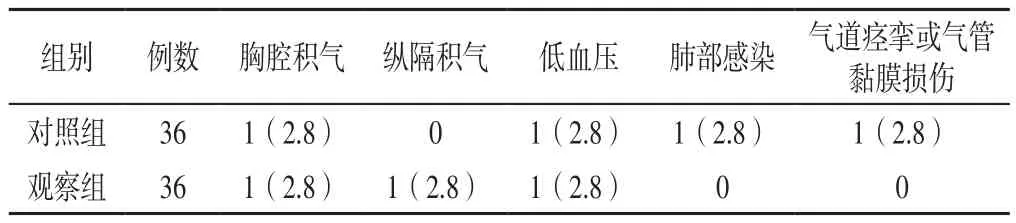
表4 兩組患者并發癥發生情況〔n(%)〕Table 4 Complications of the two groups
3 討論
AECOPD作為臨床常見的急危重癥,在臨床治療中常建立人工氣道以部分或全部替代呼吸肌功能,進而緩解患者的呼吸困難癥狀,在保證安全的前提下,幫助患者渡過危險期[10-11]。PSV是一種傳統的機械通氣模式,其可通過預設呼吸機參數而控制呼氣和吸氣過程,從而緩解患者的呼吸困難癥狀[12]。但近年隨著研究不斷深入,發現傳統PSV模式存在一定弊端,如患者吸氣時首先要克服內源性PEEP,待肺泡壓力低于大氣壓力后才可保證通氣順暢[13]。而隨著通氣壓力水平增加,通氣潮氣量隨之增加,繼而誘發中樞反饋調節機制,迫使吸氣驅動降低以減少潮氣量,從而導致吸氣觸發延遲,進而增加呼吸機依賴發生風險[14-15]。徐曉婷等[16]研究亦證實,PSV模式下隨著壓力支持水平增加,吸氣觸發延遲時間隨之延長。因此,尋找新的機械通氣模式以改變吸氣觸發反應機制,縮短或避免吸氣觸發延遲,提高人機交互性,已成為臨床學者不斷探索的難點。
本研究結果顯示,通氣24 h后,兩組患者吸氣壓力、氣道峰壓、平臺壓分別低于本組通氣前,且觀察組低于對照組;觀察組患者通氣過程中VE、VTi及EAdi峰值均低于對照組,提示相較于PSV模式,NAVA模式更有利于改善AECOPD患者呼吸力學指標。王奎等[17]研究表明,NAVA模式在調節重癥呼吸系統疾病患者呼吸力學指標方面具有明顯優勢。分析其原因可能與NAVA模式是通過呼吸中樞反饋調節機制自主調節EAdi水平有關,進而有效避免了VE、VTi過大[18]。
本研究結果顯示,觀察組患者機械通氣時間、吸氣觸發延遲時間及吸呼氣切換延遲時間均短于對照組,提示相較于PSV模式,NAVA模式能更有效地縮短AECOPD患者機械通氣觸發延遲時間。分析其原因可能為:NAVA模式通過作用于EAdi信號傳導通路,可調節吸氣或吸呼氣切換的機械通氣模式[19]。在呼吸周期初始階段,呼吸中樞可通過作用神經沖動而誘導呼吸機收縮耦聯機制,進而增加胸腔內負壓,保證通氣順暢[20];同期,可介導膈肌神經信號向呼吸機送氣的機械動作轉化。此外,NAVA模式由NAVA水平和EAdi共同介導,呼吸中樞可根據呼吸負荷的微變化而及時調整EAdi信號強度,從而有助于縮短吸氣觸發延遲時間,提高人機交互性[21]。再者,PSV模式下吸氣觸發延遲時間隨著患者內源性PEEP增加而延長[22]。劉智達等[23]研究提出,NAVA模式理論上依賴EAdi信號通路即可完成呼吸機送氣和吸呼氣切換轉化,不受內源性PEEP的影響,故更有助于縮短吸氣觸發延遲時間,本研究結果與之基本一致。
本研究結果顯示,通氣24 h后,兩組患者肺順應性分別低于本組通氣前,且觀察組低于對照組,提示相較于PSV模式,NAVA模式能更有效地提高AECOPD患者肺順應性。分析其機制可能為:NAVA模式下AECOPD患者吸呼氣切換時間縮短,吸呼氣切換時氣流在呼吸中樞由吸氣向呼氣轉化的瞬間仍未停止,此時呼吸機仍處于送氣狀態,待氣流流速下降至0時可直接轉化為呼氣動作[24]。而PSV模式下,管道內吸氣流速降至一定程度后即刻結束送氣,而相關參數通過呼氣時間常數計算得出,但患者存在個體差異,從而導致預設流速常無法及時匹配中樞神經活動,增加了肺順應性[25]。本研究結果還顯示,兩組患者并發癥發生率比較差異無統計學意義,提示NAVA模式用于AECOPD患者中的安全性良好。
綜上所述,相較于PSV模式,NAVA模式能更有效地改善AECOPD患者呼吸力學指標,提高肺順應性,縮短機械通氣觸發延遲時間,且安全性良好,臨床應用前景較好。
作者貢獻:牟志芳進行文章的構思與設計,負責撰寫、修訂論文;董躍福進行研究的實施與可行性分析;康秀文進行數據收集、整理、分析;李勇、沈葉菊進行結果分析與解釋;張趁英負責文章的質量控制及審校,對文章整體負責、監督管理。
本文無利益沖突。

