豬瘟病毒免疫過氧化物酶單層細(xì)胞試驗檢測方法的建立
朱海俠 陳 雷 查代燦 張惠云 胡曉涵 包松英
(兆豐華生物科技(福州)有限公司 福州 350014)
豬瘟(Classical swine fever,CSF)是由豬瘟病毒(CSFV)引起的豬和野豬高接觸性、高致病性的傳染病[1],給我國養(yǎng)豬業(yè)造成巨大經(jīng)濟(jì)損失。該病一年四季均可發(fā)生,但以春、夏等多雨季節(jié)多發(fā)。不同日齡、不同品種的家豬和野豬對豬瘟病毒均易感。該病被世界動物衛(wèi)生組織列為A類烈性傳染病,被我國農(nóng)業(yè)部列為一類傳染病,是目前阻礙我國養(yǎng)豬業(yè)健康發(fā)展的首要動物傳染病[2]。疫苗免疫接種是防控該病的主要措施,豬瘟大流行現(xiàn)狀已經(jīng)得到根除,但仍存在區(qū)域性、點狀散發(fā)性流行[3]。究其原因,豬瘟疫苗的抗原含量是影響豬群免疫效果的重要因素之一。
目前針對豬瘟病毒的檢測主要有RT-PCR檢測技術(shù)、熒光定量PCR檢測方法、LAMP方法、免疫熒光技術(shù)(IFA)、兔體定型熱反應(yīng)等。PCR相關(guān)技術(shù)主要針對的是病毒核酸,因此,在弱毒疫苗的評定過程中很難準(zhǔn)確確定其活病毒的含量。由于豬瘟病毒感染細(xì)胞后不產(chǎn)生細(xì)胞病變,其病毒含量的測定主要依賴于傳統(tǒng)的免疫熒光技術(shù)或兔體定型熱反應(yīng)進(jìn)行判定。兔體定型熱反應(yīng)作為一種檢測豬瘟弱毒疫苗效價的傳統(tǒng)方法,受大兔個體差異影響較大,且耗時較長,費用較高。IFA檢測方法是目前檢測CSFV的一種重要的輔助方法,但該方法對設(shè)備要求較高,不利于推廣應(yīng)用。
免疫過氧化物酶單層細(xì)胞試驗(IPMA),其主要原理是通過抗原抗體的相互作用,產(chǎn)生特異性顯色反應(yīng),通過光學(xué)顯微鏡肉眼即可觀察并判定結(jié)果[4]。此外,制備的細(xì)胞板可以在4℃條件下長期保存,反應(yīng)結(jié)果也可以長期儲存,隨時觀察[5]。本研究采用免疫過氧化物酶單層細(xì)胞試驗,建立一種能夠快速應(yīng)用于生產(chǎn)中的病毒含量檢測方法,旨在為豬瘟疫苗生產(chǎn)提供快速的評價工具。
1 材料與方法
1.1 毒株、細(xì)胞系豬瘟病毒C株、ST細(xì)胞系由兆豐華生物科技(福州)有限公司保存。
1.2 主要耗材3-氨基-9-乙基咪唑(AEC)、羊抗兔HPR-IgG購自Sigma公司;試驗用陽性血清為豬瘟病毒(C株)免疫家兔后制備的高免血清樣品;陰性血清為健康家兔血清樣品;PEDV陽性、PRRSV陽性及PCV2陽性血清均由本公司保存?zhèn)溆茫?6孔細(xì)胞培養(yǎng)板購自costar公司;DMEM培養(yǎng)基購自GBICO;BSA購自Biosharp;其余分析純試劑購自國藥公司。
1.3 IPMA步驟將生長狀況良好的ST細(xì)胞鋪于96孔細(xì)胞培養(yǎng)板,置37℃、5%CO2培養(yǎng)箱中進(jìn)行培養(yǎng),細(xì)胞長至70%~80%時,棄去培養(yǎng)液,接種一定濃度的豬瘟病毒,37℃、5%CO2培養(yǎng)箱孵育1 h,期間每20 min搖晃一次,同時設(shè)立未接毒的對照組。吸附結(jié)束后,加入一定量DMEM液體繼續(xù)培養(yǎng)一段時間;棄去培養(yǎng)液,用一定量PBS進(jìn)行潤洗,洗滌3次,干燥后加入含0.3%H2O2的甲醇溶液進(jìn)行固定,作用10 min;棄去液體,用一定量PBS進(jìn)行潤洗后干燥處理,加入0.02%trition作用10 min;棄去液體,用一定量PBS進(jìn)行潤洗后干燥處理,加入一定量5%BSA(Bovine serum albumin)進(jìn)行封閉2 h;棄去液體,用一定量PBS進(jìn)行潤洗后干燥處理,加入一定濃度的高免血清作為一抗,37℃作用一段時間;棄去液體,用一定量PBS進(jìn)行潤洗后干燥處理,加入一定濃度羊抗兔HRP-IgG二抗,37℃作用一段時間;棄去液體,用一定量PBS進(jìn)行潤洗后干燥處理,加入AEC,37℃作用15 min,ddH2O終止,光學(xué)顯微鏡下觀察結(jié)果。
1.3.1 IPMA反應(yīng)條件的優(yōu)化
1.3.1.1 最佳一抗、二抗工作濃度及病毒作用時間的確定 取細(xì)胞長至70%~80%的96孔細(xì)胞培養(yǎng)板,加入已知濃度的豬瘟病毒,設(shè)置不加病毒對照孔,孵育1 h后,加入DMEM液體培養(yǎng)基,37℃、5%CO2培養(yǎng)箱分別作用24 h、48 h,72 h后進(jìn)行固定處理, 加 入1∶50、1∶100、1∶150、1∶200、1∶300、1∶400、1∶800、1∶1 600、1∶3 200稀釋的一抗,每個稀釋度加一縱列,將羊抗兔HRP-IgG抗體按照1∶250、1∶500、1∶1 000、1∶2 000比例進(jìn)行稀釋,每個稀釋度加一橫列,100 uL/孔,每個濃度設(shè)2個重復(fù)孔,同時設(shè)置陰性對照和空白對照,按照上述步驟,觀察染色結(jié)果,確定最佳一抗、二抗及病毒作用時間。
1.3.1.2 固定液的選擇 棄去細(xì)胞培養(yǎng)液,用PBS潤洗3次,分別加入含0.3%H2O2的甲醇、80%丙酮、33%丙酮溶液進(jìn)行固定,室溫固定10 min后,棄去固定液,用PBS潤洗2次,按照上述步驟進(jìn)行測定,顯微鏡下觀察結(jié)果,確定最佳固定液。
1.3.1.3 最優(yōu)二抗工作時間的確定 將辣根過氧化物酶(HPR)標(biāo)記的羊抗兔IgG按照1∶1 000比例進(jìn)行稀釋,100 uL/孔,置37℃分別孵育0.75 h、1 h、2 h,PBST洗滌3次,按照上述步驟進(jìn)行測定,顯微鏡下觀察結(jié)果,確定最優(yōu)二抗工作時間。
1.3.1.4 顯色時間確定 AEC試劑根據(jù)配比要求進(jìn)行配制,100 uL/孔,置室溫和37℃分別作用15 min、20 min、30 min,按照上述步驟進(jìn)行測定,顯微鏡下觀察結(jié)果,確定最佳顯色時間。
1.3.2 IPMA檢測方法的特異性分析 用PEDV、PRRSV、PCV2陽性血清和豬瘟病毒(CSFV)陽性高免血清進(jìn)行特異性檢測,判定該方法的特異性。
1.3.3 IPMA檢測方法重復(fù)性分析 分別制備3個批次的96孔細(xì)胞培養(yǎng)板,選用已知濃度的病毒按照一定比例進(jìn)行稀釋后,接種于96孔細(xì)胞培養(yǎng)板中,同時設(shè)置不接病毒的空白對照,每個樣本做3個重復(fù),分別進(jìn)行組內(nèi)及組間的重復(fù)性測定。
1.3.4 IPMA檢測方法與IFA方法符合率分析 對建立的IPMA檢測方法與IFA方法進(jìn)行對比,分析同一批次、相同稀釋度豬瘟病毒檢測情況。
2 結(jié)果與分析
2.1 IPMA條件優(yōu)化本研究確定最優(yōu)反應(yīng)條件為:豬瘟病毒接種后繼續(xù)培養(yǎng)72 h,用含0.3%H2O2甲醇溶液室溫固定10 min,5%BSA 37℃作用2 h,一抗按照1∶200進(jìn)行稀釋,37℃孵育2 h,二抗按照1∶1 000進(jìn)行稀釋,37℃孵育45 min,置37℃顯色20 min具有較好的顯色效果(見圖1)。
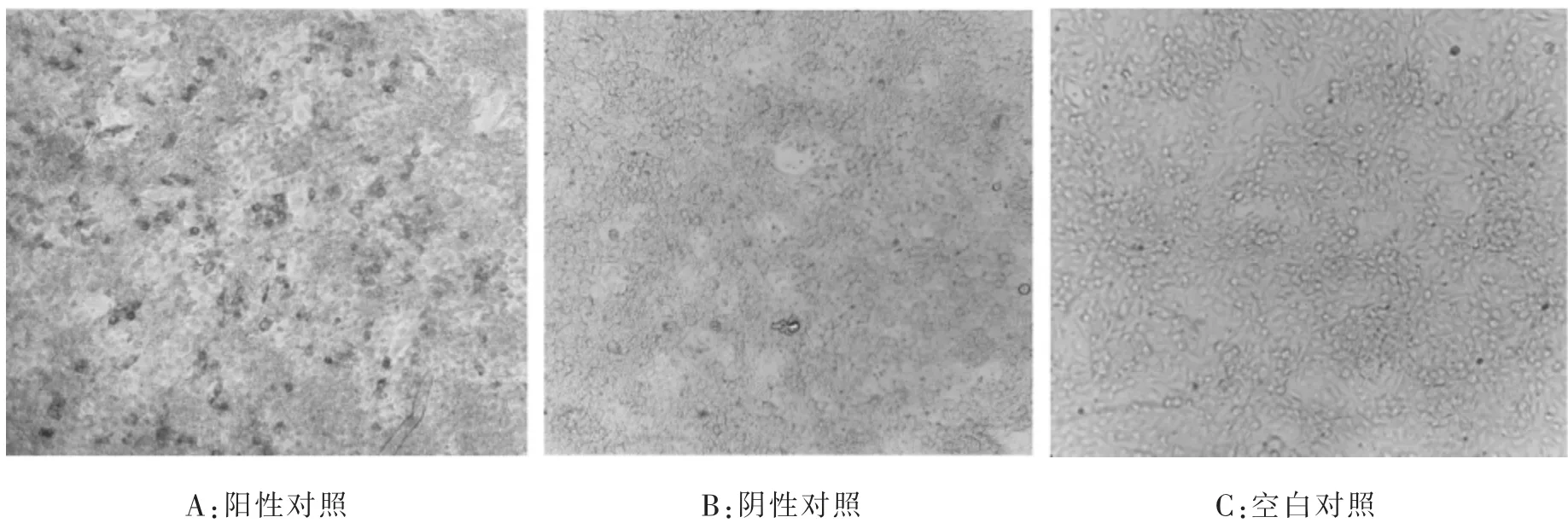
圖1 不同樣品AEC染色效果
2.2 最佳固定液的確定選用不同類型的固定液進(jìn)行固定,結(jié)果發(fā)現(xiàn)33%丙酮溶液進(jìn)行固定時會導(dǎo)致細(xì)胞迅速脫落,采用80%丙酮溶液與0.3%H2O2甲醇溶液相比,細(xì)胞會出現(xiàn)脫落現(xiàn)象,且染色后細(xì)胞邊界模糊,效果稍差于0.3%H2O2甲醇溶液(見圖2)。
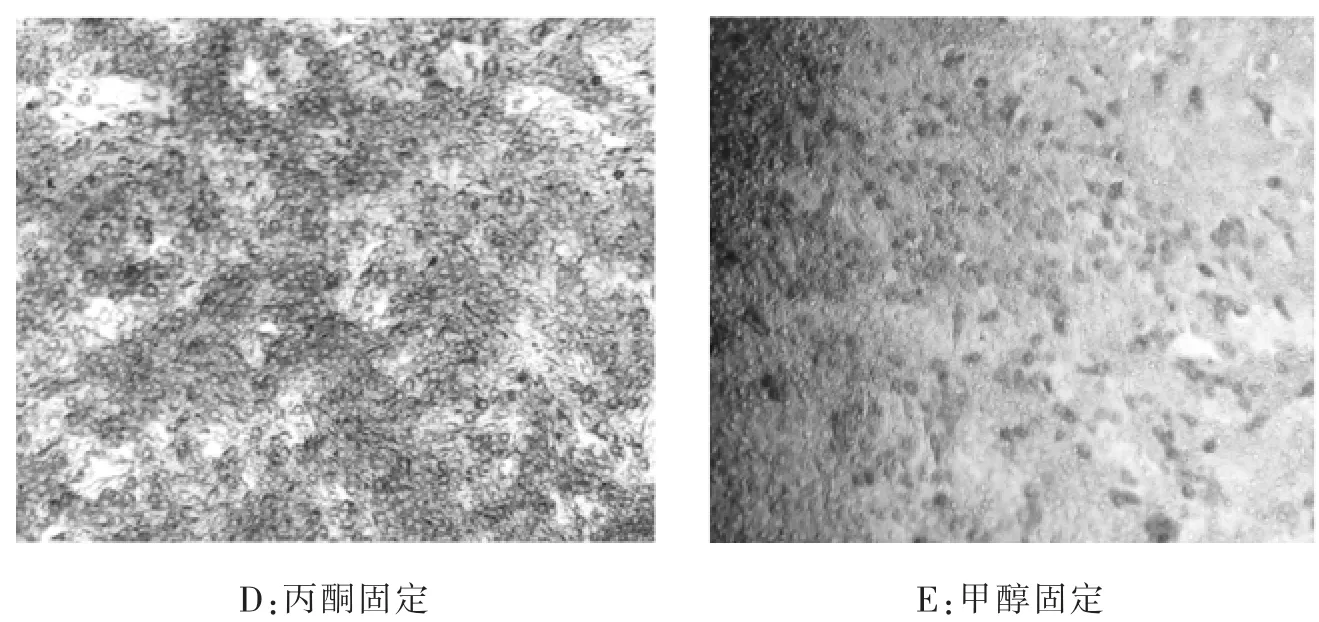
圖2 不同固定液處理后細(xì)胞染色效果
2.3 IPMA檢測方法的特異性分析采用上述方法對PEDV、PRRSV、PCV2、CSFV陽性血清樣品進(jìn)行測定,結(jié)果表明:除豬瘟病毒陽性血清出現(xiàn)特異性顏色反應(yīng)外,其余病毒陽性血清均無染色反應(yīng)。
2.4 IPMA檢測方法的重復(fù)性分析采用上述方法對不同批次制備的細(xì)胞進(jìn)行豬瘟病毒含量測定,結(jié)果無明顯差異,表明建立的方法具有很好的重復(fù)穩(wěn)定性。
2.5 IPMA檢測方法與IFA比較分析采用同一批細(xì)胞不同試驗方法對同一批次、相同稀釋度的豬瘟病毒進(jìn)行測定,IPMA檢測結(jié)果與IFA方法相符合(見圖3)。
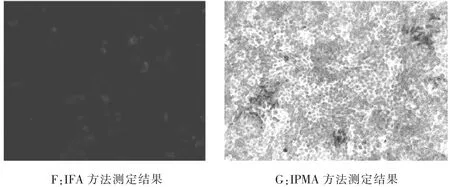
圖3 不同試驗方法對比分析
3 討 論
IPMA與IFA檢測方法一樣,具有良好的特異性、敏感性等特點,解決了病毒感染細(xì)胞無細(xì)胞病變、難以判定細(xì)胞是否感染的難題[6]。該方法因操作簡便、能夠長期保存試驗結(jié)果等優(yōu)勢在疫病檢測中得到廣泛應(yīng)用[7-9]。本研究通過病毒感染時間、固定液選擇、一抗和二抗、顯色的最優(yōu)工作條件確定,建立了豬瘟病毒的IPMA檢測方法。通過加入一定量的Trition和BSA進(jìn)行細(xì)胞通透和封閉,極大提高病毒侵染細(xì)胞的效果和降低背景的干擾,降低非特異性反應(yīng)的發(fā)生,為建立豬瘟病毒的IPMA檢測方法奠定基礎(chǔ)。
疫苗免疫是預(yù)防疫病發(fā)生和流行的重要途徑,雖然豬瘟弱毒疫苗的應(yīng)用在一定程度上控制了豬瘟的流行,但仍出現(xiàn)免疫失敗的情況。OIE-WAHIS實時數(shù)據(jù)顯示,我國豬瘟疫情仍處于散發(fā)、流行的情況。王琴等[10]澄清了“由野毒株變異引起免疫失敗”的學(xué)術(shù)爭端,指出豬瘟弱毒疫苗(C株)能抵抗全世界流行的三個基因型野毒的攻擊。CFSV在細(xì)胞增殖中效價高低及最終疫苗生產(chǎn)質(zhì)量與動物免疫效果密切相關(guān)[11]。黃寶學(xué)等[12]指出,不同病毒含量豬瘟疫苗的免疫效果存在一定差異,疫苗中病毒含量過高會導(dǎo)致免疫耐受,病毒含量過低則不能誘導(dǎo)機體產(chǎn)生足夠的抗體水平。因此,豬瘟弱毒疫苗中病毒含量是影響疫苗使用效果的關(guān)鍵。
本研究建立了能夠快速檢測豬瘟病毒復(fù)制情況的IPMA方法。雖然該方法已有在豬瘟病毒效價測定方面應(yīng)用的報道[6,9],但本研究中主要采用極易獲取的高免血清作為一抗,解決了單克隆抗體難以篩選的難題。采用特異性HRP-IgG作為二抗,極大提高了檢測方法的特異性和推廣的可行性。通過固定液的篩選及封閉條件的加入,大大降低了細(xì)胞脫落的幾率及本底反應(yīng),降低了主觀誤判的概率。

