大豆異黃酮通過NF-κB p65信號通路抑制Aβ1-42誘導的海馬神經元炎癥和凋亡
邵曉潔,管文婕,洪占梅,陳 明,王 凡,呂東來,3,張旭東
(1. 中國人民解放軍聯勤保障部隊第九〇一醫院藥劑科,安徽 合肥 230031;2.安徽醫科大學基礎醫學院藥理學教研室,安徽 合肥 230032;3. 陸軍軍醫大學西南癌癥中心,重慶 400038)
1 材料與方法
1.1 材料
1.1.1動物 SPF級,♂,新生24 h SD大鼠,體質量(6.02 ± 0.01)g,購買于上海斯萊克實驗動物有限公司,SCXK(滬)2018-0002,飼養于安徽醫科大學實驗動物學部,SYXK(皖)2020-0019。
1.1.2藥物與試劑 大豆異黃酮(華北制藥股份有限公司,批號:060104);Aβ1-42[翌圣生物科技(上海)股份有限公司,貨號:20602ES03];DMEM/F12培養基(Gibco公司,貨號:C11330500BT);胎牛血清(fetal bovine serum,FBS)(上海慧穎生物科技有限公司,貨號:FB15015);二甲基亞砜(dimethyl sulfoxide,DMSO,濟南世紀通達化工有限公司,貨號:CAS67-68-5 ) MTT檢測試劑盒(上海生工生物工程有限公司,貨號:E606334);Annexin V-FITC/PI凋亡檢測試劑盒(北京索萊寶科技有限公司,貨號:CA1020);BCA蛋白濃度測定試劑盒(上海碧云天生物技術,貨號:P0012S);顯影定影試劑盒(上海碧云天生物技術,貨號:P0019);山羊抗兔(上海碧云天生物技術,貨號:A0408);山羊抗小鼠(上海碧云天生物技術,貨號:A0412);一抗稀釋液(上海碧云天生物技術,貨號:P0256);二抗稀釋液(上海碧云天生物技術,貨號:P0258);環氧合酶-2(cyclooxygenase-2,COX-2)一抗(Cell Signaling Technology,貨號;4842);TNF-ɑ一抗(Cell Signaling Technology,貨號;8643);IκBα一抗(Santa Cruz Biotechnology,貨號:sc-52900);p-IκBα一抗(Santa Cruz Biotechnology,貨號:sc-8404);NF-κB p65一抗(Santa Cruz Biotechnology,貨號:sc-8008);p-NF-κB p65一抗(Santa Cruz Biotechnology,貨號:sc-398442);cleaved-caspase-3一抗(Cell Signaling Technology,貨號:9664);Bcl-2一抗(Cell Signaling Technology,貨號:15071);β-actin一抗(上海碧云天生物技術,貨號:AF5001)。
1.1.3主要儀器 TWK-FST32型組織勻漿儀(武漢泰普拓科技有限公司);Micro17R型高速冷凍離心機(離心半徑:6 cm)、FC型全自動多功能酶標檢測儀[賽默飛世爾科技(中國)有限公司];GPJ9-TS100-F型倒置熒光顯微鏡(日本Nikon公司);1658033型電泳儀、ChemiDoc XRS+成像系統(美國Bio-Rad公司)。
1.2 方法
1.2.1大鼠海馬神經元原代培養與鑒定 新生24 h大鼠采用酒精消毒、斷頭處理,并在無菌條件下取出大腦并分離海馬組織;海馬組織剪碎并加入0.25%的胰蛋白酶消化30 min;加入DEME/F12培養基終止消化,將細胞懸液放置離心機內,設置轉速度1 200 r·min-1離心5 min,靜置2 min后吸去上清液,加入新鮮的細胞培養基吹打并將其懸液過200目篩網進行過濾,調整好細胞濃度并接種至經過L-多聚賴氨酸處理后6孔板內,放置于37 ℃,5% CO2細胞培養箱內常規培養48 h;加入5 g·L-1阿糖胞苷抑制非神經細胞活性。期間每3 d對原細胞培養基進行1/2體積更換。海馬神經元培養10 d,采用免疫熒光染色法鑒定神經元,神經元神經絲蛋白(NF)2000抗體結合山羊抗兔免疫熒光二抗熒光染色鑒定。
1.2.2海馬神經元分組與給藥處理 實驗分為對照組(Control)、Aβ1-42處理組、SI低、中、高給藥濃度組。其中Cotrol組與含有10% FBS的DMEM/F12培養基共培養48 h;Aβ1-42處理組海馬神經元加入30 μmol·L-1的Aβ1-42處理48 h;SI低、中、高劑量組(SI-L、SI-M、SI-H)海馬神經元首先分別加入終濃度10、20和40 mg·L-1的SI預處理2 h,然后加入30 μmol·L-1的Aβ1-42處理48 h。
1.2.3MTT檢測海馬神經元存活率 大鼠海馬神經元原代細胞按照96孔板密度為:1×107·L-1密度接種,按照實驗分組進行對應處理,培養48 h,每組設置6個復孔,重復實驗3次,每孔加入MTT溶液10 μL(5 g·L-1)繼續培養4 h,終止培養,棄去細胞上清,每孔加入150 μL的DMSO震蕩10 min,使得充分溶解,酶標儀設定波長為570 nm檢測各孔的吸光度值,以光密度(optical density,OD)值反映海馬神經元活力。海馬神經元存活率/%=各處理組細胞OD/對照組OD值×100%。
智慧商圈系統中商圈客流分析的核心是對商圈的靜態數據和動態數據進行分析,分析的維度決定分析的價值。客流分析不僅僅是獲取總客流量,還需根據各區域、各樓層的客流分布、變化情況和成交率[1],通過正確的數據清洗和分析,利用專業的可視化分析工具得出對商圈有較高價值的數據結果。
1.2.4TUNEL染色檢測海馬神經元凋亡率 海馬神經元按照1×107·L-1密度接種于12孔板內,按照TUNEL染色檢測試劑盒進行海馬神經元凋亡檢測。于200倍光學顯微鏡下隨機性選取3個視野觀察各組海馬神經元凋亡情況。TUNEL陽性細胞(凋亡細胞)染色呈棕色。海馬神經元凋亡率/%=TUNEL陽性細胞數目/總細胞數目×100%。
1.2.5Western blot檢測海馬神經元相關蛋白表達 海馬神經元加入細胞裂解液后于冰上裂解40 min;4 ℃,12 000 r·min-1,離心10 min,吸取細胞上清液;BCA法測定各組海馬神經元蛋白質濃度;上樣(按照每孔上樣量30 μg計算得出上樣體積);凝膠電泳(80 V,30 min后120 V,60 min);濕轉法轉膜90 min;5%脫脂牛奶室溫封閉2 h;分別加COX-2一抗(1 ∶1 000)、TNF-ɑ一抗(1 ∶1 000)、IκBα一抗(1 ∶1 000)、p-IκBα一抗(1 ∶1 000)、NF-κB p65一抗(1 ∶1000)、p-NF-κB p65一抗(1 ∶1 000)及β-actin抗體(1 ∶2 000),4 ℃孵育過夜;加對應的山羊抗兔二抗或者山羊抗鼠二抗(1 ∶5 000),室溫孵育1~2 h;加吐溫20磷酸鹽緩沖溶液洗滌3次,每次5 min,加入顯影液,顯影并拍照。以目的蛋白條帶灰度值與β-actin條帶灰度值的比值反映目的蛋白的相對表達量。
2 結果
2.1 原代海馬神經元培養與鑒定光學顯微鏡下觀察海馬神經元生長情況。10 d可見海馬神經元之間的突起形成網狀,胞體呈錐體狀和紡錘狀,伴有長軸突和樹突形成。熒光顯微鏡下觀察神經元NF200染色呈紅色,細胞核染色呈藍色,大約90%以上呈NF200陽性,表明原代海馬神經元培養與鑒定獲得成功(Fig 1)。
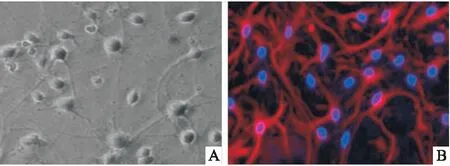
Fig 1 Culture and identification of primary hippocampal neurons (200×)
2.2 各組海馬神經元存活率情況MTT檢測顯示,與Control組相比,Model組海馬神經元存活率明顯降低(P<0.01)。與Model組相比,SI-L、SI-M、SI-H組海馬神經元存活率明顯升高(P<0.05或P<0.01)(Fig 2)。
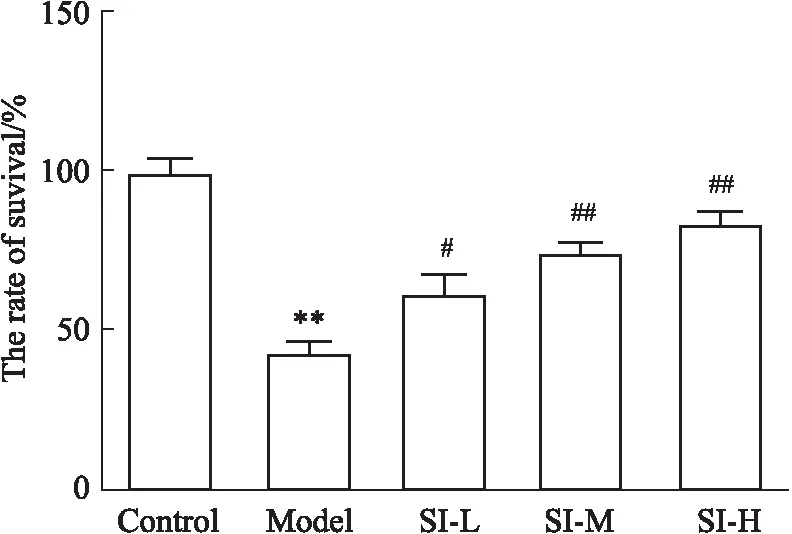
Fig 2 Comparison of survival rate of
2.3 SI對Aβ1-42誘導海馬神經元炎癥因子表達的影響Western blot檢測海馬神經元COX-2和TNF-ɑ蛋白表達水平。結果顯示,與Control相比,Model組細胞TNF-ɑ和COX-2蛋白表達明顯升高(P<0.05或P<0.01)。與Model組相比,SI-H組細胞TNF-ɑ和COX-2蛋白表達明顯降低(P<0.05或P<0.01)(Fig 3)。
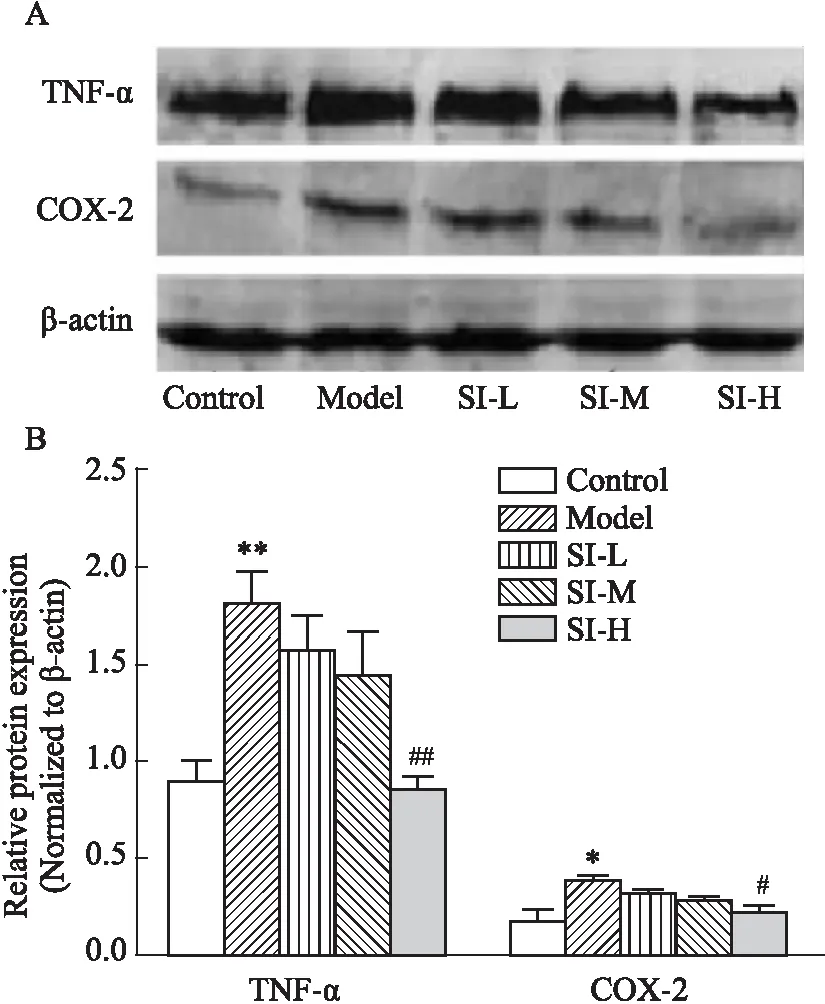
Fig 3 The expression levels of TNF-ɑ andCOX-2 in hippocampal neurons n=3)
2.4 SI對Aβ1-42誘導海馬神經元凋亡的影響TUNEL染色檢測海馬神經元凋亡情況。結果顯示,與Control組相比,Model組海馬神經元凋亡率明顯增加(P<0.01)。與Model組相比,SI-M、SI-H組海馬神經元凋亡率明顯降低(P<0.05或P<0.01)(Fig 4)。進一步Western blot檢測海馬神經元凋亡相關蛋白表達,結果顯示,與Control組相比,Model組cleaved-caspase-3蛋白表達明顯升高,Bcl-2蛋白表達明顯降低(P<0.01)。與Model組相比,SI-L、SI-M、SI-H組cleaved-caspase-3蛋白表達降低,Bcl-2蛋白表達升高(P<0.05或P<0.01)(Fig 5)。

Fig 4 Comparison of apoptotic rate of hippocampal neurons
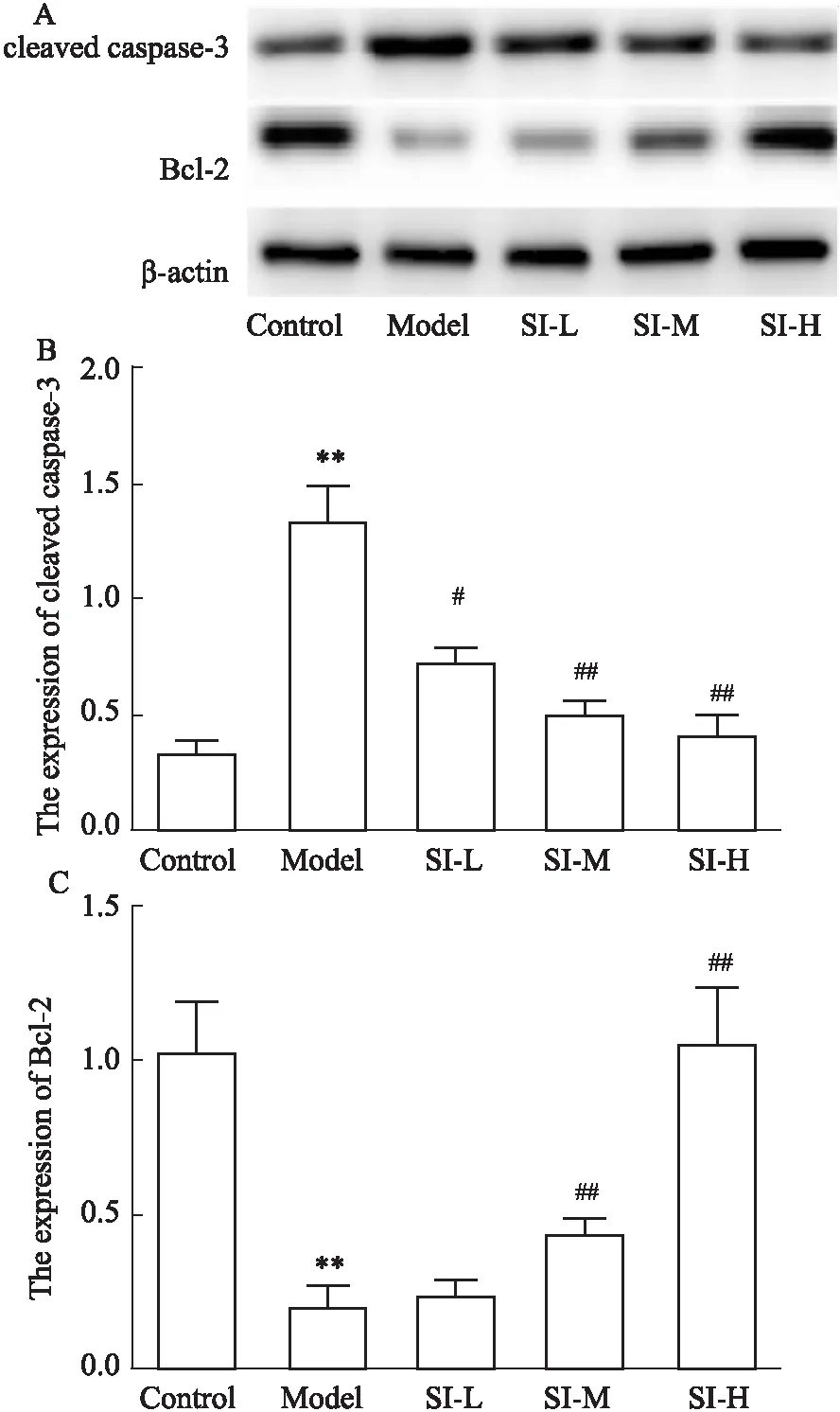
Fig 5 The expression levels of cleaved-caspase-3 and Bcl-2 in hippocampal neurons n=3)
2.5 SI對海馬神經元NF-κB p65信號通路相關蛋白表達影響Western blot檢測海馬神經元NF-κB p65信號通路相關蛋白表達。結果顯示,與Control組相比,Model組p-IκBα、p-NF-κB p65蛋白表達均明顯升高(P<0.01)。與Model組相比,SI-L、SI-M、SI-H組p-IκBα、p-NF-κB p65蛋白表達均明顯降低(P<0.05或P<0.01)(Fig 6)。

Fig 6 The expression of NF-κB p65 signaling pathway proteins in hippocampal neurons
3 討論
AD是老年人常見的神經退行性疾病,臨床主要表現記憶力損害。AD發病機制復雜,主要包括Aβ神經病毒學說、膽堿能神經功能抑制、Tau蛋白學說以及神經炎癥機制等[11]。其中Aβ神經病毒學說在AD的發生、發展中被廣泛研究,研究學者認為淀粉前體樣蛋白酶切代謝產物Aβ是AD發病早期發揮主要誘因[12]。研究發現,Aβ能夠誘導海馬神經元炎癥和凋亡,導致神經元細胞丟失[13]。神經元細胞大量丟失是AD典型病理特征之一,海馬神經元凋亡則是神經元丟失的表現形式。因此,以Aβ誘導海馬神經元凋亡為基礎,探究AD發生、發展中的分子調節機制尤為重要。既往研究證實,NF-κB/p65信號傳導在神經元炎癥反應和凋亡中發揮重要作用[5]。NF-κB共有5種蛋白組成,靜息狀態下在細胞質內NF-κB與IκBα結合形成復合物。當IκBα被激活形成p-IκBα后,IκBα會發生泛素化并降解,從而釋放結合NF-κB p65。而釋放的NF-κB p65會被進一步磷酸化形成p-NF-κB p65,增強其和定位信號,進入細胞核促進下游基因表達[14]。研究顯示Aβ25-35能夠通過激活IκBα/NF-κB通路,誘導海馬神經炎癥,增加神經元凋亡,進而導致海馬神經元存活率降低[15]。另外,抑制NF-κB活化能夠明顯降低Aβ誘導的海馬神經炎癥和神經元凋亡,改善神經元細胞丟失[16]。因此,抑制NF-κB p65信號激活已逐漸成為阻止Aβ誘導海馬神經炎癥和神經元凋亡的目標。SI是一類與神經系統疾病密切相關的異黃酮類化合物總稱。研究發現SI能夠增加去卵巢大鼠海馬突觸密度,改善海馬功能[17]。另外,研究也證實SI能夠通過調控AD大鼠海馬組織caspase-3活性,改善AD大鼠學習記憶能力[18]。在腦缺血/再灌注損傷大鼠模型,SI能夠通過抑制NF-κB活化降低海馬神經炎癥反應,減少海馬神經元凋亡[10]。基于以上研究,我們推測SI可能通過調控NF-κB p65信號通路影響AD海馬神經炎癥和神經元凋亡。為此,本實驗通過體外培養原代海馬神經元,觀察SI對Aβ誘導海馬神經炎癥和神經元凋亡的影響。
本實驗首先通過體外原代海馬神經元分離培養與鑒定,結果顯示10 d可見海馬神經元之間的突起形成網狀,胞體呈錐體狀和紡錘狀,伴有長軸突和樹突形成。熒光顯微鏡下觀察神經元NF200染色呈紅色,細胞核染色呈藍色,表明原代海馬神經元培養與鑒定成功。Aβ1-42是常用于AD體外細胞模型研究。眾多研究已證實Aβ1-42能夠明顯促進海馬神經元凋亡。為此,本研究以海馬神經元終濃度30 μmol·L-1的Aβ1-42處理48 h構建體外細胞模型。結果顯示,與Control組相比,Model組海馬神經元存活率明顯減低,凋亡率明顯升高,表明Aβ1-42誘導海馬神經元凋亡模型構建成功。為明確SI對Aβ1-42誘導海馬神經炎癥和神經元凋亡的影響及作用機制。本實驗通過設置SI-L、SI-M和SI-H濃度,觀察海馬神經元存活率、炎癥、凋亡率以及NF-κB信號活化情況。MTT和TUNEL染色檢測顯示,與Model相比,SI-L、SI-M和SI-H組海馬神經元存活率明顯升高,凋亡率降低。Western blot檢查顯示,與Control組相比,Model組海馬神經元COX-2、TNF-ɑ、p-IκBα、p-NF-κB p65、cleaved-caspase-3蛋白表達均明顯升高,Bcl-2蛋白表達明顯降低,表明Aβ1-42能夠通過活化NF-κB p65,誘導海馬神經炎癥和神經元凋亡。與Model組相比,SI處理后能夠明顯抑制NF-κB p65信號活化,降低COX-2、TNF-ɑ、cleaved-caspase-3表達,促進Bcl-2蛋白表達。以往研究顯示COX-2啟動子含有NF-κB結合位點。在炎癥激活狀態下,p-NF-κB與COX-2生成呈正相關[15]。TNF-α是NF-κB強烈的激活劑,而NF-κB的激活能夠誘導細胞釋放TNF-α,從而形成一個正反饋NF-κB活化途徑[10]。
綜上所述,SI能夠抑制Aβ1-42誘導的海馬神經炎癥和神經元凋亡,其機制與調控NF-κB p65信號通路相關。本實驗初次在細胞層面上證實了SI在海馬神經炎癥和神經元凋亡中的保護作用,后續將在體內動物實驗中進一步探究SI在AD大鼠海馬神經炎癥和神經元凋亡中的保護作用以及NF-κB p65信號的上游調控機制,以期為AD的SI防治提供更多參考依據。
(致謝:感謝安徽醫科大學科研中心的老師給予的幫助!)

