NBED對鈾的促排效果及HK-2細胞損傷的保護作用
周文華,高 潔,尹晶晶,黃立群,李曙芳,李建國
(1. 山西中醫藥大學,山西 晉中 030619;2. 中國輻射防護研究院,藥物毒理與放射損傷藥物山西省重點實驗室,中核放射毒理與放射性藥物臨床前評價重點實驗室,山西 太原 030000)
近年來隨著核技術的廣泛應用,核安全問題受到廣泛關注。環境中的鈾主要通過吸入、傷口等途徑隨血液進入全身循環并造成一定的毒性[1]。流行病學和實驗室研究發現,鈾毒性主要體現在腎臟(36.22%)、骨骼(19.48%)、肝臟(17.58%)、生殖系統(13.90%)、肺(7.24%)、神經系統(5.58%)[2]。腎臟中的鈾主要沉積在腎近端小管S3段[3],胞吞進入細胞與磷酸根離子結合形成磷酸鈾酰針形結晶,沉淀在細胞質中破壞細胞,造成近端腎小管損傷或壞死[4-5]。而使用促排劑形成穩定可排泄的絡合物是治療鈾內污染的唯一實用方法。
放射性核素促排劑研究至今,FDA僅批準Ca/Na-DTPA、普魯士藍、碘化鉀3種藥物可以治療放射性核素中毒,其余尚在結構優化、藥效確證和臨床前研究階段。而目前臨床治療鈾內污染的對策為靜脈注射1.4%碳酸氫鈉直至尿液pH達到8.0~9.05,并持續3 d,但低劑量效果并不明顯,臨床用量過多極易造成體內酸堿不平衡和電解質紊亂[6]。中國輻射防護研究院設計合成的鄰苯二酚類促排劑(FZ-82-4)對钚、銅、鉛等具有較好的促排效果[7]。近年來,本研究所為提高藥物穩定性、改善水溶性自主設計合成了N1,N2-雙(2,3-二羥基-4,6-二磺酸芐基)亞乙基二胺鈉鹽(N1,N2-bis (2,3-dihydroxy-4,6-disulfonic acid benzyl) ethylenediamine sodium salt , NBED)(FZ-82-4鈉鹽)。本研究將從動物、細胞水平研究NBED對鈾的促排效果,采用鈾誘導的人腎近曲小管上皮細胞(HK-2)損傷模型,研究NBED對HK-2急性鈾損傷的保護作用,并與目前臨床使用的廣譜核素促排劑DTPA-CaNa3進行比較。
1 材料與方法
1.1 材料
1.1.1動物 SPF級ICR ♂小鼠48只,體質量(18~22)g(北京維通利華實驗動物技術有限公司),質量合格證號:110011200110859381,實驗動物許可證號:SCXK(京)2016-0006。實驗單位為中國輻射防護研究院藥物安全評價中心SPF級動物房。
1.1.2細胞 人腎小管上皮細胞(HK-2),購自BNCC細胞庫,用含10%胎牛血清和1%青霉素鏈霉素溶液的DMEM/F12的完全培養基,培養于37 ℃、5%CO2培養箱中,待細胞融合至80%~90%時,胰酶消化傳代并進行后續實驗。
1.1.3試劑 NBED由本所合成,相對分子量為712.52。該化合物為黃色粉末,相對純度大于95%[7]。促排靈注射液(DTPA-CaNa3,批號:20190605)購自軍事醫學研究院輻射醫學研究所;醋酸鈾酰[C4H6O6U(H2O)2,批號:U3873101B]購自上海吉至生化科技有限公司;胎牛血清(批號:2138109RP)、DMEM/F12培養基(批號:8121244)購自美國Gibco公司;細胞增殖毒性檢測(CCK-8)試劑盒(批號:BJ05203090)、Annexin V-FITC細胞凋亡檢測試劑盒(批號:BA01283496)、細胞周期檢測試劑盒(批號:BA04278147)購自北京博奧森生物技術有限公司;超氧化物歧化酶(SOD)試劑盒(批號:20201226)、還原型谷胱甘肽(GSH,批號:20210126)測定試劑盒、乳酸脫氫酶(LDH)測試盒(批號:20201124)購自南京建成生物工程研究所;活性氧檢測試劑盒(批號:20201212)購自北京索萊寶科技有限公司;硝酸(優級純,批號:20200911)購自國藥集團化學試劑有限公司;H2O2(分析純,批號:20200531)購自天津歐博凱化工有限公司;超純水(Milli-Q超純水處理系統)。
1.1.4儀器 LY26-1FD型超凈工作臺(上海龍躍儀器設備有限公司),Forma 3111型直熱式CO2培養箱、Countess Ⅱ型全自動細胞計數儀、Multiskan GO型全波長酶標儀、5424R高速冷凍離心機(Thermo Fisher);Milli-Q超純水處理系統(美國Millipore);FC500型流式細胞分析儀(Beckman coulter)。NexION-5000電感耦合等離子體質譜儀(PerkinElmer)。ICP-MS測定主要條件:射頻入射功率:1 600 W,霧化氣流速:1.03 L·min-1,輔助氣流速:1.3 L·min-1,等離子氣流速:16.25 L·min-1,重復采集3次,溶液穩定時間50 s。
1.2 方法
1.2.1動物分組及給藥 實驗動物分為6組:空白對照組、鈾染毒組[U(VI)](0.03mg)[8]、鈾染毒+DTPA-CaNa3組(300 mg·kg-1)、鈾染毒+NBED組(300、150、75 mg·kg-1)。
給藥,實驗前適應性喂養1周后,d 8開始給藥,小鼠尾靜脈注射醋酸鈾酰后立即灌胃不同劑量NBED,DTPA-CaNa3作為陽性對照;鈾染毒組于染鈾后灌胃等體積生理鹽水;空白對照組小鼠尾靜脈注射生理鹽水后立即灌胃生理鹽水。給藥前禁食過夜,給藥2 h后給食與飲水。注射螯合劑后24 h脫臼處死小鼠,取兩側腎臟、股骨、脾臟、肝臟和肌肉。80 ℃烘至恒重,研磨均勻后,分別取0.02 g于燒杯中(因肝、脾、肌肉中鈾蓄積量較少,所以肝、脾、肌肉作為一組樣本處理),加入5 mL硝酸、150 ℃消解澄清后,加入1 mL H2O2繼續消解至無色透明,約剩0.5~1.0 mL左右,經稀硝酸稀釋后,采用ICP-MS測定各個樣本中的鈾含量,并轉化為μg·g-1干組織。
1.2.2醋酸鈾酰誘導HK-2細胞損傷模型 取對數生長期的HK-2細胞,以5×103/孔接種于96孔板中,37 ℃、5% CO2細胞培養箱中培養24 h(融合至50%~60%),去掉培養基。分別加入20、40、80、160、320、640 μmol·L-1的醋酸鈾酰作用48 h,以及80 μmol·L-1的醋酸鈾酰作用24、48、72 h,棄去培養液,每孔加入含10%的CCK-8培養基100 μL,37 ℃培養箱中孵育1 h,酶標儀450 nm測每孔的吸光度A并計算存活率。細胞存活率/%=(OD測定孔-OD空白孔)/(OD對照孔-OD空白孔)×100%。
1.2.3NBED對鈾損傷的HK-2細胞活性影響 取對數生長期的HK-2細胞,以5×103/孔接種于96孔板中,37 ℃、5% CO2細胞培養箱中培養24 h(融合至50%~60%),去掉培養基。實驗分為空白對照組、鈾(80 μmol·L-1)模型組、80 μmol·L-1鈾分別與不同濃度NBED(10、20、40、80、160、320 μmol·L-1)組,各組處理細胞48 h后,采用CCK-8法檢測細胞活性。
1.2.4NBED對鈾損傷的HK-2細胞形態變化的影響 取對數生長期的HK-2細胞,以5×105/孔接種于6孔板中,37 ℃、5% CO2細胞培養箱中培養24 h。根據“1.2.2”、“1.2.3”結果選用醋酸鈾酰、NBED最適宜濃度,后續實驗分為空白對照組、鈾模型組(80 μmol·L-1)、陽性對照組(80 μmol·L-1U+80 μmol·L-1DTPA-CaNa3)、80 μmol·L-1鈾分別與不同濃度NBED(80、40、20 μmol·L-1)組,繼續培養48 h后,光鏡下觀察細胞形態變化并拍照。
1.2.5NBED對HK-2細胞內吞和外排鈾的影響 取對數生長期的HK-2細胞,以5×105/孔接種于6孔板中,37 ℃、5% CO2細胞培養箱中培養24 h,實驗分組同“1.2.4”。內吞實驗:細胞染鈾后立即給藥后作用48 h;外排實驗:除對照組外各組別用80 μmol·L-1鈾作用24 h后,棄去培養基,PBS沖洗3次,對照組和鈾模型組,加無血清培養基,其余各組加不同濃度含藥培養基作用細胞24 h。藥物作用結束后,分別收集各組培養上清和細胞,置燒杯中,加入5 mL硝酸、150 ℃消解澄清后,加入1 mL H2O2繼續消解至無色透明,約剩0.5~1.0 mL左右,經稀硝酸稀釋后,用ICP-MS測樣本中鈾含量,將測得的各處理組的數值減去空白對照組的本底值,乘以稀釋倍數得各樣本鈾含量。內吞率/%=細胞鈾含量/(細胞+培基鈾總量),外排率/%=培基鈾含量/(細胞+培基鈾總量)。
1.2.6檢測細胞SOD、GSH、ROS水平和上清LDH活力 收集細胞上清液和細胞,根據LDH活性測定試劑盒說明書在450 nm處檢測LDH活性。細胞冰水浴中制備勻漿,按照SOD和GSH說明書檢測SOD活力和GSH水平。流式法檢測細胞內ROS,棄去細胞上清液。收集細胞加入DCFH-DA使其終濃度為10 μmol·L-1,置細胞培養箱內20 min。用無血清培養液洗滌細胞3次后,采用流式細胞儀在488 nm、525 nm處檢測熒光強度即反應細胞內ROS含量。
1.2.7流式細胞儀檢測細胞凋亡 各組別藥物作用結束后,用不含EDTA的胰酶消化收集5×105個細胞,用預冷的PBS洗滌2次,1 000 r·min-1離心5 min,棄上清,重懸于100 μL binding buffer中,每組分別加入5 μL Annexin V-FITC和PI,37 ℃避光反應15 min后,冰上加400 μL binding buffer,1 h內上流式細胞儀進行檢測。
1.2.8流式細胞儀檢測細胞周期 各組別藥物作用結束后,用不含EDTA的胰酶消化收集細胞,用預冷的PBS洗滌2次,1 000 r·min-1離心5 min,棄上清,重懸于70%乙醇中,-20 ℃固定過夜,檢測前離心,棄乙醇,PBS洗滌后加入PI,37 ℃避光反應30 min后,1 h內上流式細胞儀進行檢測。
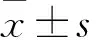
2 結果
2.1 NBED對鈾中毒小鼠的促排效果與鈾染毒組相比,300、150 mg·kg-1NBED和300 mg·kg-1DTPA-CaNa3可明顯降低腎內鈾含量,300 mg·kg-1NBED和DTPA-CaNa3可明顯降低骨內鈾含量(P<0.05)。300 mg·kg-1NBED分別減少腎、骨內44.3%、18.8%的鈾含量,而同濃度DTPA-CaNa3則減少16.6%和13.9%的腎、骨內鈾含量,見Fig 1。

Fig 1 Efficacy of uranium removal from mice by
2.2 醋酸鈾酰對HK-2細胞生長的影響與對照組相比,20、40、80、160、320、640 μmol·L-1的醋酸鈾酰作用HK-2細胞48 h,以及80 μmol·L-1的醋酸鈾酰作用HK-2細胞24、48、72 h后,細胞活性明顯下降(P<0.01),且呈濃度和時間依賴性(Fig 2)。當醋酸鈾酰濃度為80 μmol·L-1,作用時間為48 h時,細胞存活率為60.51%左右,本實驗選用80 μmol·L-1、48 h作為后續誘導HK-2細胞損傷模型的濃度。

Fig 2 Effect of C4H6O6(H2O)2 on growth of HK-2
2.3 NBED對鈾損傷的HK-2細胞活性影響以及形態的變化與鈾模型組相比,NBED(40、80 μmol·L-1)處理組提高了細胞存活率(P<0.01),見Fig 3A。因此,選擇20、40、80 μmol·L-1作為NBED給藥濃度,80 μmol·L-1作為DTPA-CaNa3給藥濃度。如Fig 3B所示,與空白對照組比較,鈾模型組細胞數目減少、部分細胞碎片以及損傷細胞漂浮于培養基中,部分細胞變成不規則長條形。與鈾模型組相比,陽性對照組和40、20 μmol·L-1NBED處理組,細胞損傷在鏡下未見明顯改善。80 μmol·L-1NBED組細胞數量明顯比鈾模型組和陽性對照組多,且大部分細胞形態正常,培養基中漂浮的損傷細胞或碎片均減少。

Fig 3 Effect of NBED on activity and morphology of HK-2 cells
2.4 NBED對HK-2細胞內吞和外排鈾的影響醋酸鈾酰和不同濃度藥物作用細胞48 h,由Fig 4A可知,陽性藥組和NBED組明顯抑制鈾內吞(P<0.05)。與鈾模型組69%的內吞率相比,陽性藥組和80、40、20 μmol·L-1NBED組鈾內吞率分別為56%、27%、49%、58%。醋酸鈾酰作用細胞24 h后,不同濃度藥物作用細胞24 h,由Fig 4B可知,NBED組顯著促進鈾外排(P<0.01),而陽性藥組沒有促排效果。與鈾模型組12%的外排率相比,80、40、20 μmol·L-1NBED組鈾外排率分別為60%、44%、30%。以上結果表明,NBED可以抑制細胞對鈾的攝取,并促進細胞內鈾的釋放。

Fig 4 Effect of NBED on endocytosis and exocytosis of
2.5 NBED對細胞SOD、GSH、ROS水平和上清LDH活力的影響由Fig 5可知,與鈾模型組相比,80 μmol·L-1NBED組的SOD、GSH釋放量明顯升高(P<0.01),ROS的表達水平和LDH活力明顯下降(P<0.01);陽性對照組的SOD、GSH釋放量無明顯差異,ROS的表達水平升高(P<0.05),LDH活力明顯升高(P<0.01)。與陽性對照組相比,80 μmol·L-1NBED組的SOD、GSH釋放量明顯升高(P<0.01),ROS的表達水平、LDH活力明顯下降(P<0.01);40、20 μmol·L-1NBED組的SOD、GSH釋放量升高(P<0.05),ROS的表達水平和LDH活力明顯下降(P<0.01)。由此可見,80 μmol·L-1的NBED對鈾誘導的細胞損傷具有保護作用,而同濃度陽性藥DTPA-CaNa3并沒有發揮保護作用,反而加劇了細胞的損傷。
2.6 NBED對鈾誘導細胞凋亡的影響與對照組相比,80 μmol·L-1的鈾作用HK-2細胞48 h后,有(15.80±0.51)%的細胞發生凋亡。而80 μmol·L-1的DTPA-CaNa3和80、40、20 μmol·L-1的NBED和鈾作用48 h后(30.8±1.2)%、(12.6±0.6)%、(21.0±0.7)%、(20.9±0.4)%的細胞發生凋亡。陽性藥組凋亡率顯著高于鈾模型組(P<0.01),80 μmol·L-1NBED組凋亡率明顯低于鈾模型組和陽性藥組(P<0.01)(Fig 6)。由此可見,鈾誘導HK-2細胞凋亡,80 μmol·L-1DTPA-CaNa3處理后加劇了細胞的凋亡,80 μmol·L-1NBED明顯降低了細胞凋亡率。
2.7 NBED對鈾誘導細胞周期的影響各組分別作用HK-2細胞48 h后,流式細胞儀檢測結果顯示如Fig 7所示,與對照組相比,鈾模型組S期細胞比例增加,G0/G1、G2/M期細胞比例下降。40、80 μmol·L-1的NBED可明顯降低S期細胞比例(P<0.01),而80 μmol·L-1的DTPA、20 μmol·L-1的NBED與模型組相比差異無顯著性。

Fig 7 Effect of NBED on cell cycle of HK-2 n=3)
3 討論
鈾進入機體后會產生腎毒性、肝毒性、骨毒性、肺毒性等,并造成器官損傷、壞死和癌癥等一系列疾病,除手術切除治療外,藥物螯合是目前最有效的治療途徑[9]。本所自主設計合成的NBED(FZ-82-4鈉鹽),前期實驗表明對钚、銅、鉛等具有良好的促排效果,但未見報道對鈾的促排效果。本實驗首次在動物水平證實NBED對鈾具有較好的促排效果,且效果優于FDA批準用藥DTPA-CaNa3。動物水平研究發現,300 mg·kg-1NBED對腎、骨具有較好的促排效果,可顯著減少腎、骨內44.3%、18.8%的鈾含量,而300 mg·kg-1DTPA-CaNa3則減少16.6%和13.9%的腎、骨內鈾含量。
細胞水平采用醋酸鈾酰誘導HK-2細胞急性損傷模型,研究發現醋酸鈾酰作用HK-2細胞后,20、40和80 μmol·L-1的NBED立刻給藥共同作用48 h,分別比模型組減少了11%、20%、42%的鈾進入細胞內;20、40和80 μmol·L-1的NBED延遲24 h后給藥,分別比模型組增加了18%、32%、48%的排放量。而DTPA-CaNa3僅減少了13%的鈾進入細胞,外排無效果。動物、細胞水平促排研究結果顯示,NBED對急性鈾損傷HK-2細胞具有較好的促排效果,而DTPA-CaNa3僅在細胞外發揮螯合作用,對細胞內的鈾無促排效果。這可能與DTPA-CaNa3對鈾和釷幾乎無效,并且口服DTPA-CaNa3后大量存在于體液或血液中,很少能透過細胞膜進入細胞內發揮作用有關[10-11]。
腎是鈾的主要靶器官之一,研究表明,胞吞進入腎近端小管S3段細胞內的鈾酰離子,破壞細胞膜結構、抑制LDH來抑制細胞ATP含量和糖異生,并通過消耗細胞內酶類或非酶類抗氧化劑,增加活性氧含量,使細胞發生氧化應激反應[12-13]。并通過誘導凋亡因子Bcl-2、Bid、Bax和caspase家族的表達,引起細胞凋亡級聯反應,導致DNA降解和細胞死亡[14]。本研究還發現NBED與醋酸鈾酰1 ∶1作用時,對鈾誘導的HK-2細胞損傷具有明顯的保護作用,可以提高HK-2細胞的存活率,降低細胞膜損傷,降低活性氧產生,增加抗氧化物SOD、GSH含量,減輕細胞凋亡和細胞周期S期的阻滯。而DTPA-CaNa3與醋酸鈾酰1 ∶1作用時,加劇了細胞的損傷。NBED屬于鄰苯二酚類化合物,且有研究報道含有鄰苯二酚基團的螯合劑體外抗氧化實驗表明具有較高的自由基清除率[15]。而DTPA-CaNa3屬于多胺多羧酸類化合物,未見研究報道其具有清除自由基作用,且因其不能透過細胞膜,加之藥物本身的細胞毒性使之加劇了細胞的損傷。
綜上所述,新型促排劑NBED能明顯降低腎、骨內鈾含量,對急性鈾損傷的HK-2細胞具有一定的保護作用,且優于FDA批準用藥DTPA-CaNa3,通過抑制細胞對鈾的攝取,并促進細胞內鈾的釋放,提高細胞存活率,抑制細胞內ROS生成,提高抗氧化物SOD、GSH含量發揮抗氧化作用,并減輕鈾誘導細胞損傷后S期的阻滯和凋亡。本研究首次證實NBED對鈾中毒具有較好的促排效果,且能清除氧自由基,對鈾損傷的HK-2細胞具有保護作用,并為后續的研究提供一定的依據。

