蒼耳亭抗大鼠肺癌機制研究
孔順,王菲菲,張少楠,張葉明
(蕪湖市第二人民醫院,安徽蕪湖 241000)
肺癌是呼吸系統常見的惡性腫瘤,臨床上有較高的發病率和死亡率,且呈現逐年上升的趨勢,對患者生命造成嚴重的威脅[1]。目前,臨床根治肺癌的唯一方法是手術切除,但對于不適合行手術切除的患者,其化療、放療療效尚不能令人十分滿意。因此,尋求一種可重復、創傷小、便捷的治療方法是目前具有重要意義的策略。越來越多的研究表明,中藥單體化合物由于其易合成、毒副作用較低、療效穩定等特點,有望成為未來抗腫瘤理想的藥物。蒼耳子為菊科植物蒼耳Xanthium sibiricumPatr.干燥成熟帶總苞的果實,味甘,性溫,入肺、肝經,可祛風濕、通鼻竅,主治風濕痹痛、頭痛鼻淵、皮膚癢疹、麻風病,主要含有水溶性苷類、倍半萜內酯類、揮發油類、脂肪油類、酚酸類及其他化合物,有降血糖、抗過敏、抗菌、抗炎、鎮痛、抗腫瘤的藥理作用[2]。蒼耳亭(Xanthatin)為蒼耳的主要活性成分之一,屬于蒼耳屬植物中倍半萜內酯類化學成分[3]。有研究表明,蒼耳亭對非小細胞肺癌的生長存在顯著的抑制作用,且對正常肺上皮細胞生長影響較小[4-5]。提示其可能成為具有高效低毒特點的抗肺癌候選藥物,但其作用機制尚不完全明確。有研究發現,哺乳動物雷帕霉素靶蛋白(mTOR)/真核細胞翻譯起始因子4E(eIF4E)結合蛋白1(4E-BP1)信號通路在細胞的生存、生長與增殖中起中心調控作用,該信號通路的傳導異常與多種惡性腫瘤有關[6],已成為腫瘤治療的新靶點。為進一步明確蒼耳亭的抗肺癌的作用及機制,本研究構建了荷Lewis肺癌大鼠模型,觀察蒼耳亭對肺癌大鼠腫瘤、能量代謝及mTOR/4E-BP1信號通路的影響,現將研究結果報道如下。
1 材料與方法
1.1 實驗動物40只清潔級雄性大鼠,體質量(180±20)g,購自常州卡文斯實驗動物有限公司,許可證號:SCXK(蘇)2016-0003。在實驗室適宜溫濕度的環境中對大鼠適應性喂養7 d,自由飲水攝食。
1.2 藥物、試劑與儀器蒼耳亭,購自南京世洲有限公司,分子結構見圖1,純度98.5%,批號:26791-73-1,使用前用二甲基亞砜(DMSO)配制,存于-20℃冰箱中備用。mTOR抗體、磷酸化(p)-4E-BP1抗體(美國Abcam公司);三磷酸腺苷(ATP)、二磷酸腺苷(ADP)、一磷酸腺苷(AMP)(美國Sigma公司);線粒體膜電位(MMP)檢測試劑盒(JC-1法)(上海碧云天生物技術有限公司)。GTR16-2型冷凍離心機(北京時代北利離心機有限公司);DMI3000B倒置顯微鏡(德國Leica公司);TC-100B恒溫搖床(上海領成生物科技有限公司);E2695-2489高效液相色譜儀(美國Waters公司)。

圖1 蒼耳亭化學結構Figure 1 Chemical structure of Xanthatin
1.3 動物造模大鼠Lewis肺癌細胞(購自美國ATCC公司),于37℃、5%CO2培養箱中以含10%胎牛血清的高糖培養基培養,14 d后取生長狀態最佳的細胞,用生理鹽水調節其密度為5×106個/mL,以每只0.2 mL在大鼠右腋下接種。接種7 d后,造模大鼠右腋下可觸及瘤塊。測量瘤體質量和體積。40只大鼠在10 d后均成瘤,提示肺癌模型制備成功。
1.4 動物分組與給藥將40只成模大鼠隨機分為模型組,蒼耳亭低、中、高劑量組,每組10只。模型制備成功后第2天開始進行給藥干預:模型組給予等體積的生理鹽水灌胃;蒼耳亭低、中、高劑量組大鼠分別給予10、20、40 mg/kg蒼耳亭灌胃。每天給藥1次,連續給藥14 d。
1.5 觀察指標與方法
1.5.1 蘇木素-伊紅(HE)染色觀察肺癌組織病理形態 取大鼠肺癌組織,4%多聚甲醛固定,脫水后石蠟包埋,切片(厚度為5μm)。每組取3張切片,常規脫蠟至水,蘇木素染色1 min,自來水沖洗切片1 min,鹽酸-酒精分色3 s,流水沖洗5 min,伊紅染色10 s,梯度酒精上行脫水,二甲苯Ⅰ、Ⅱ透明各20 min,中性樹膠封片。光學顯微鏡下觀察。
1.5.2 末端脫氧核苷酸轉移酶介導的d UTP缺口末端標記(TUNEL)法測定肺癌細胞凋亡率 取“1.5.1”項切片,經脫蠟、梯度乙醇溶液浸泡后,參照TUNEL染色試劑盒說明書的步驟進行染色,經漂洗、脫水、透明后,用中性樹膠封片,光學顯微鏡下觀察切片并拍照,每個切片隨機選取5個視野。
1.5.3 高效液相色譜法(HPLC)檢測肺癌組織中ATP、ADP和AMP含量 取大鼠肺癌組織,加入0.4 mol/L冰預冷的高氯酸(肺癌組織∶高氯酸=1∶5),采用超聲粉碎機粉碎、制成勻漿。于4℃、10 000 r/min離心(離心半徑6.2 cm)10 min,取上清液100μL,加入1 mol/L碳酸鉀與甲醇混合液(體積比4∶1)中和高氯酸50μL。于4℃、10 000 r/min(離心半徑6.2 cm)離心10 min,取上清液100μL加水100μL稀釋,應用HPLC儀檢測。色譜柱:Phenomenex Luna C18柱;進樣量:20μL;柱溫:室溫;樣品溫度:4℃;檢測波長:254 nm;流動相A:磷酸二氫鈉溶液;流動相B:甲醇。
1.5.4 JC-1法檢測肺癌組織MMP水平 組織線粒體的分離及JC-1染色工作液的配制均按照試劑盒說明書操作。JC-1染色緩沖液將染色工作液稀釋成原來的5倍,在稀釋后的JC-1染色工作液中加入純化的線粒體。在MMP較高時,產生紅色熒光,JC-1為聚合物;MMP較低時,產生綠色熒光,JC-1為單體。MMP水平的變化情況可通過熒光顏色的變化來進行觀察。采用流式細胞儀分別測定單體和聚合物的值,以聚合物與單體的比值表示MMP水平。
1.5.5 蛋白質免疫印跡(Western Blot)法檢測肺癌組織中mTOR、p-4E-BP1蛋白表達 取肺癌組織置于冰上,剪碎放入研磨器中,加入200μL蛋白裂解液和2μL PMSF,冰上研磨1 min直至充分裂解。以14 000 r/min離心(離心半徑10 cm)10 min得到上樣緩沖液,用二喹啉甲酸(BCA)法測定上樣緩沖液中總蛋白濃度。將樣品稀釋到20μL相同濃度,加入4μL上樣緩沖液,混勻后煮沸5 min。加入電泳緩沖液至電泳槽中,穩定電壓80 V電泳。電泳結束后,將分離的蛋白條帶轉印至轉移膜上。封閉,在封閉液中放入轉移膜,置于37℃恒溫搖床上,低速搖動2 h。分別加入TBS稀釋的一抗mTOR、p-4E-BP1(1∶2 000稀釋),內參β-actin(1∶2 000稀釋)4℃過夜。洗膜后加辣根過氧化物酶(HRP)標記的山羊抗兔免疫球蛋白(IgG)二抗(1∶10 000稀釋),室溫搖床反應2 h。TBS洗滌后,滴加化學發光試劑,曝光,拍攝蛋白顯影條帶,應用ImageJ軟件分析目的蛋白相對表達量。
1.6 統計方法采用SPSS 19.0統計軟件進行數據分析,所有計量資料以均數±標準差(±s)表示,多組比較采用單因素方差分析,用t檢驗比較2組的差異性。以P<0.05為差異有統計學意義。
2 結果
2.1 各組大鼠瘤體質量和體積比較與模型組比較,蒼耳亭低、中、高劑量組大鼠瘤體的質量和體積均顯著減小(P<0.05),且隨劑量增加呈逐漸遞減趨勢,其中,高劑量組瘤體質量和體積降低最為明顯。見表1。
表1 各組大鼠瘤體質量和體積比較Table 1 Comparison of mass and volume of tumor body between various groups of rats(±s)
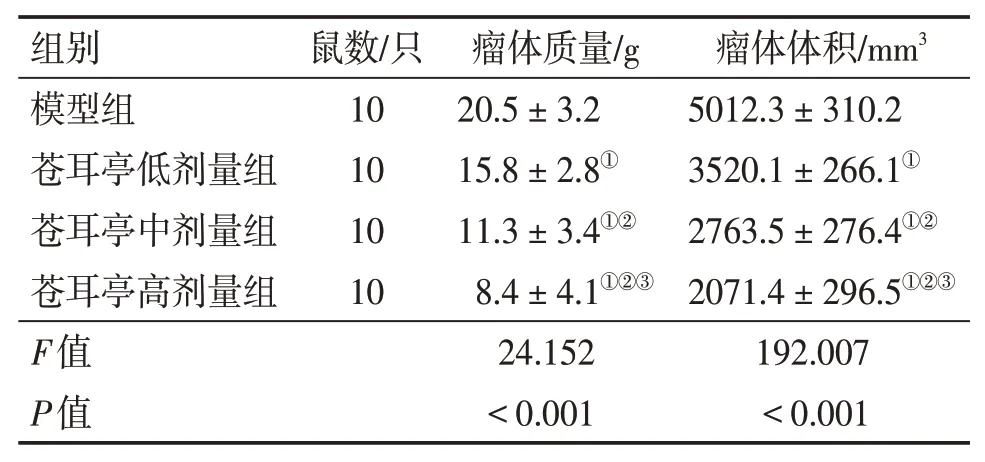
表1 各組大鼠瘤體質量和體積比較Table 1 Comparison of mass and volume of tumor body between various groups of rats(±s)
①P<0.05,與模型組比較;②P<0.05,與蒼耳亭低劑量組比較;③P<0.05,與蒼耳亭中劑量組比較
組別模型組蒼耳亭低劑量組蒼耳亭中劑量組蒼耳亭高劑量組F值P值鼠數/只10 10 10 10瘤體質量/g 20.5±3.2 15.8±2.8①11.3±3.4①②8.4±4.1①②③24.152<0.001瘤體體積/mm3 5012.3±310.2 3520.1±266.1①2763.5±276.4①②2071.4±296.5①②③192.007<0.001
2.2 各組大鼠肺癌組織病理形態學變化比較模型組和蒼耳亭低劑量組大鼠肺組織可觀察到細胞形態大小不一,且排列無規則,有明顯的癌巢出現,細胞分化差,核大深染,多見核分裂相,且肺組織形態破壞嚴重;蒼耳亭中劑量組和高劑量組未見明顯癌巢,肺組織形態完整,細胞形態均一、分化較好,且蒼耳亭高劑量組肺組織情況優于中劑量組。結果見圖2。
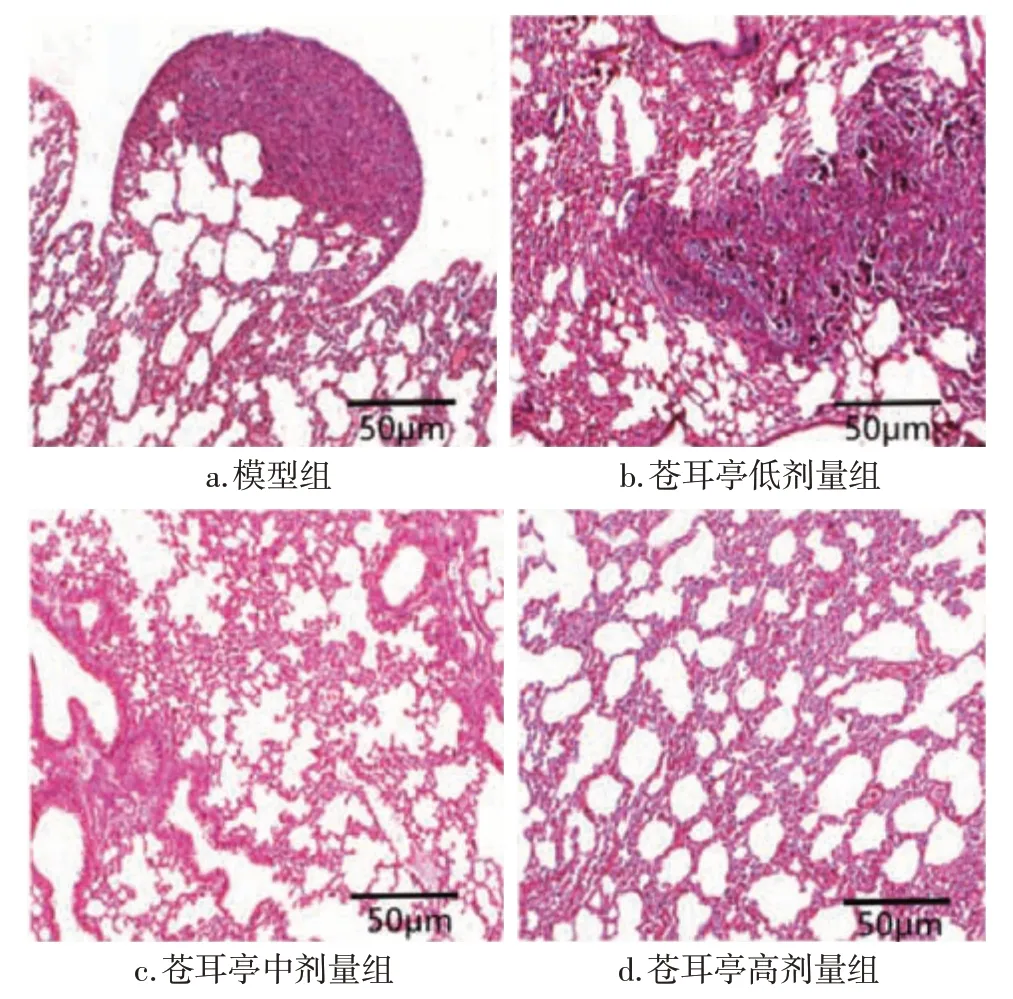
圖2 各組大鼠肺癌組織病理形態學變化比較(HE染色,×200)Figure 2 Comparison of pathologicalchanges of lung tissues between various groups of rats(by HE staining,×200)
2.3 各組大鼠肺癌細胞凋亡情況比較模型組,蒼耳亭低、中、高劑量組均可見凋亡細胞散在于癌細胞之間,胞漿減少,核內可見棕黃色顆粒物質,呈核碎裂、核固縮,或核溶解現象。見圖3。與模型組比較,蒼耳亭低、中、高劑量組的細胞凋亡指數均明顯增加(P<0.05),且隨劑量增加呈逐漸遞增趨勢,其中,蒼耳亭高劑量組細胞凋亡指數明顯高于低劑量組和中劑量組(P<0.05)。結果見表2。
2.4 各組大鼠肺癌組織ATP含量及ADP/ATP、AMP/ATP值比較與模型組比較,蒼耳亭低、中、高劑量組大鼠ATP含量顯著降低,ADP/ATP、AMP/ATP比值均顯著升高(P<0.05),且隨劑量增加效果越強,其中蒼耳亭高劑量組ATP含量顯著低于低、中劑量組(P<0.05),ADP/ATP、AMP/ATP比值顯著高于低、中劑量組(P<0.05)。結果見表3。
2.5 各組大鼠肺癌組織MMP水平比較與模型組比較,蒼耳亭低、中、高劑量組肺癌組織MMP水平均明顯降低(P<0.05),且隨著蒼耳亭劑量增加呈逐漸遞減趨勢,蒼耳亭高劑量組肺癌組織MMP水平低于低、中劑量組(P<0.05)。見表4。JC-1熒光圖像結果顯示:模型組綠色熒光明顯減弱,紅色熒光明顯增強;蒼耳亭低、中、高劑量組綠色熒光逐漸增強,紅色熒光逐漸降低。結果見圖4。
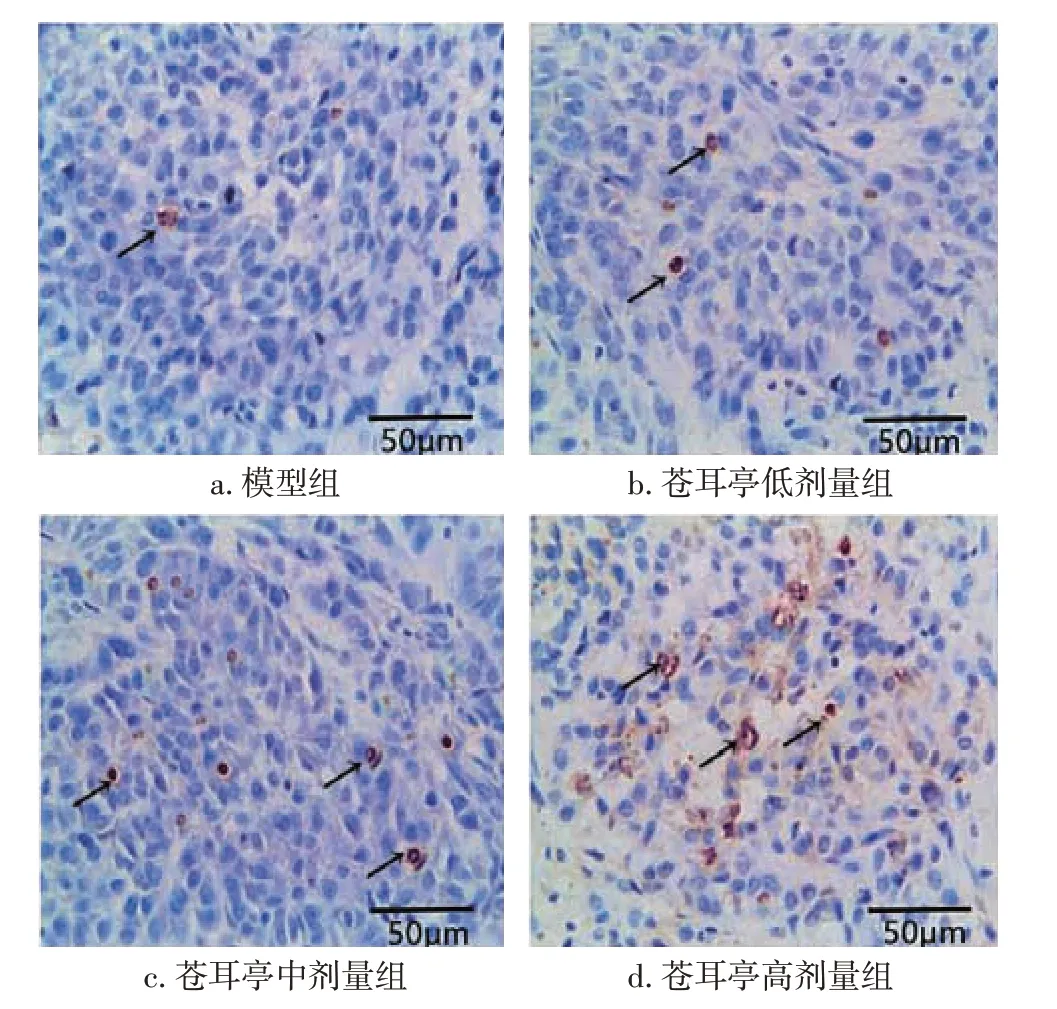
圖3 各組大鼠肺癌細胞凋亡情況(TUNEL染色,×200)Figure 3 Apoptosis of cancer cells between various groups of rats(by TUNEL staining,×200)
表2 各組大鼠肺癌細胞凋亡指數比較Table 2 Comparison of apoptosis index of lung cancer cells between various groups of rats(±s)
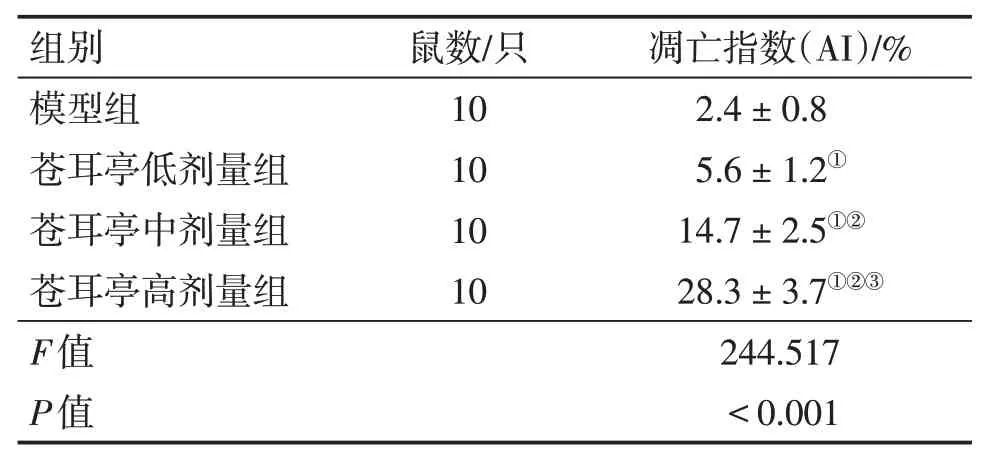
表2 各組大鼠肺癌細胞凋亡指數比較Table 2 Comparison of apoptosis index of lung cancer cells between various groups of rats(±s)
①P<0.05,與模型組比較;②P<0.05,與蒼耳亭低劑量組比較;③P<0.05,與蒼耳亭中劑量組比較
組別模型組蒼耳亭低劑量組蒼耳亭中劑量組蒼耳亭高劑量組F值P值鼠數/只10 10 10 10凋亡指數(AI)/%2.4±0.8 5.6±1.2①14.7±2.5①②28.3±3.7①②③244.517<0.001
2.6 各組大鼠肺癌組織中mTOR、p-4E-BP1蛋白表達比較與模型組比較,蒼耳亭低、中、高劑量組大鼠肺癌組織mTOR、p-4E-BP1蛋白表達水平均顯著降低(P<0.05),隨著蒼耳亭劑量增加呈逐漸遞減趨勢,且高劑量組降低最為顯著(P<0.05)。結果見圖5。
表3 各組大鼠肺癌組織三磷酸腺苷(ATP)含量及二磷酸腺苷(ADP)/ATP、一磷酸腺苷(AMP)/ATP比值比較Table 3 Comparison of ATP content and ADP/ATP and AMP/ATP ratios in lung cancer tissues between various groups of rats(±s)
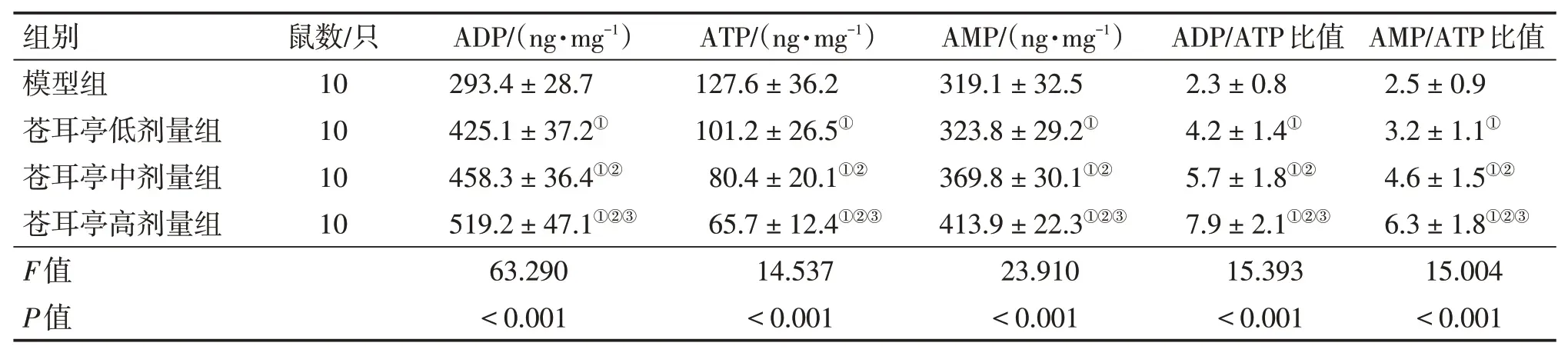
表3 各組大鼠肺癌組織三磷酸腺苷(ATP)含量及二磷酸腺苷(ADP)/ATP、一磷酸腺苷(AMP)/ATP比值比較Table 3 Comparison of ATP content and ADP/ATP and AMP/ATP ratios in lung cancer tissues between various groups of rats(±s)
①P<0.05,與模型組比較;②P<0.05,與蒼耳亭低劑量組比較;③P<0.05,與蒼耳亭中劑量組比較
組別模型組蒼耳亭低劑量組蒼耳亭中劑量組蒼耳亭高劑量組F值P值鼠數/只10 10 10 10 ADP/(ng·mg-1)293.4±28.7 425.1±37.2①458.3±36.4①②519.2±47.1①②③63.290<0.001 ATP/(ng·mg-1)127.6±36.2 101.2±26.5①80.4±20.1①②65.7±12.4①②③14.537<0.001 AMP/(ng·mg-1)319.1±32.5 323.8±29.2①369.8±30.1①②413.9±22.3①②③23.910<0.001 ADP/ATP比值2.3±0.8 4.2±1.4①5.7±1.8①②7.9±2.1①②③15.393<0.001 AMP/ATP比值2.5±0.9 3.2±1.1①4.6±1.5①②6.3±1.8①②③15.004<0.001
表4 各組大鼠肺癌組織線粒體膜電位(MMP)水平比較Table 4 Comparison of MMP levels in lung cancer tissues between various groups of rats(±s)
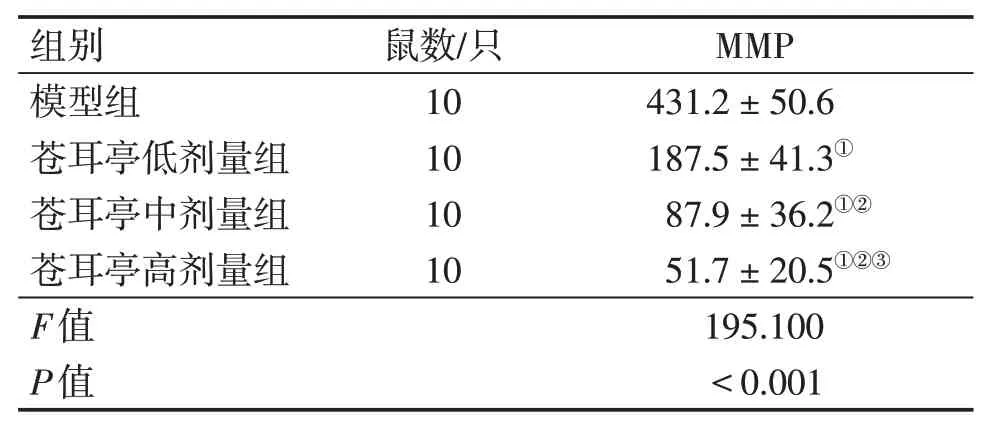
表4 各組大鼠肺癌組織線粒體膜電位(MMP)水平比較Table 4 Comparison of MMP levels in lung cancer tissues between various groups of rats(±s)
①P<0.05,與模型組比較;②P<0.05,與蒼耳亭低劑量組比較;③P<0.05,與蒼耳亭中劑量組比較
組別模型組蒼耳亭低劑量組蒼耳亭中劑量組蒼耳亭高劑量組F值P值鼠數/只10 10 10 10 MMP 431.2±50.6 187.5±41.3①87.9±36.2①②51.7±20.5①②③195.100<0.001
3 討論
本研究以肺癌模型大鼠為研究對象,以蒼耳亭干預可顯著降低肺癌大鼠瘤體質量和體積,改善肺癌組織病理形態,使癌巢消失,增加肺癌細胞凋亡指數,且隨著蒼耳亭濃度的增加,效果越顯著,提示蒼耳亭可有效抑制肺癌的生長。
氧化磷酸化是細胞能量代謝的主要途徑之一,腫瘤細胞在不斷增殖的過程中能生成大量三磷酸腺苷(adenosine triphosphates,ATP),可為其持續生長提供能量[7]。因此,欲抑制腫瘤細胞的增殖可先抑制其能量的生成。ATP及其代謝產物二磷酸腺苷(ADP)和一磷酸腺苷(AMP)的濃度是描述細胞代謝的主要參數,可直接反映機體能量代謝水平的高低[8]。本研究結果顯示,蒼耳亭可降低大鼠肺癌組織ATP的含量,增加肺組織ADP/ATP比值和AMP/ATP比值。ATP合成減少則腫瘤細胞能量代謝水平減弱,獲能減少,提示蒼耳亭可能通過抑制肺癌細胞能量代謝發揮抗肺癌作用。
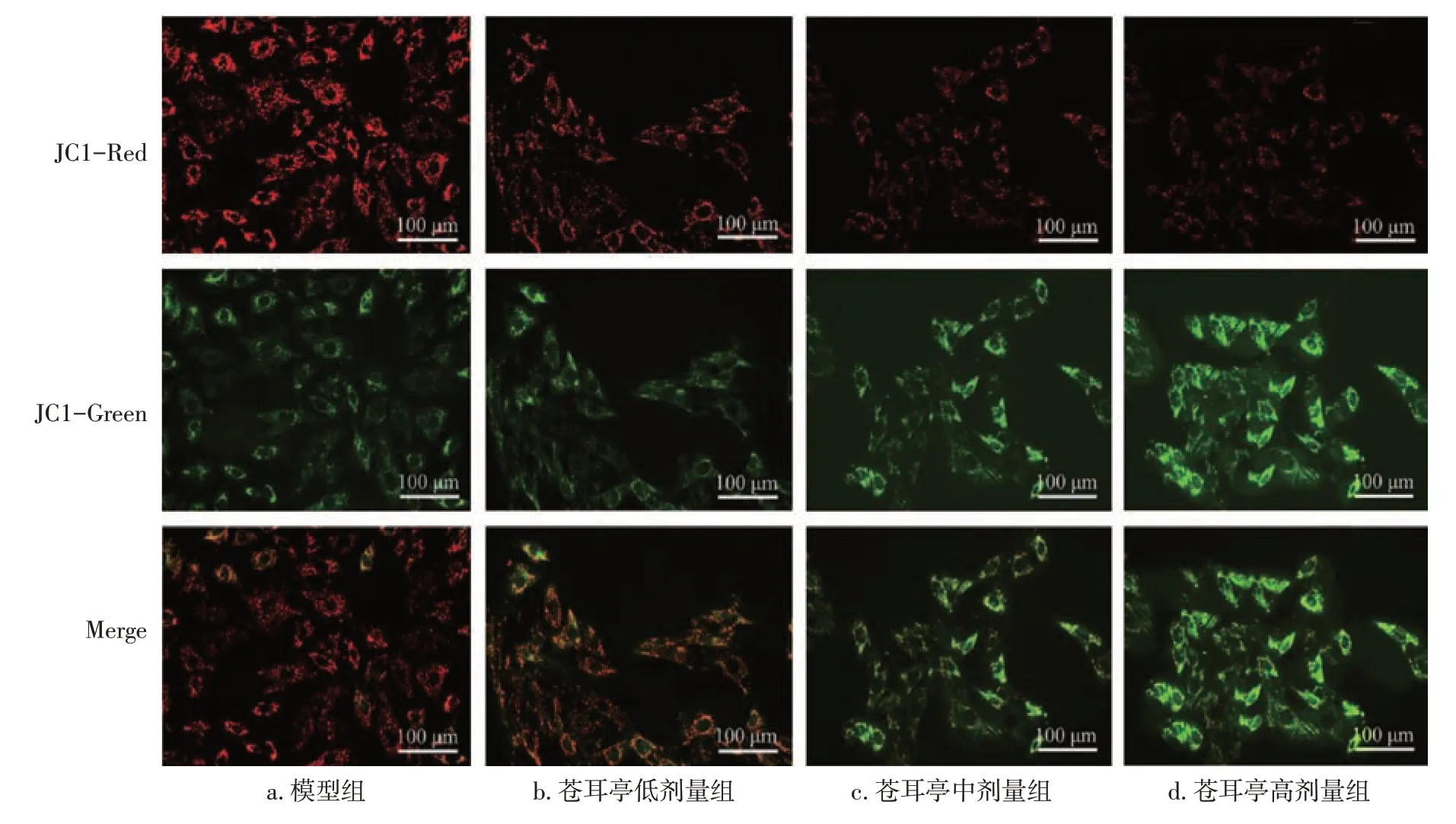
圖4 各組JC-1熒光圖像比較(JC-1染色,×400)Figure 4 Comparison of JC-1 fluorescence images between various groups(by JC-1 staining,×400)
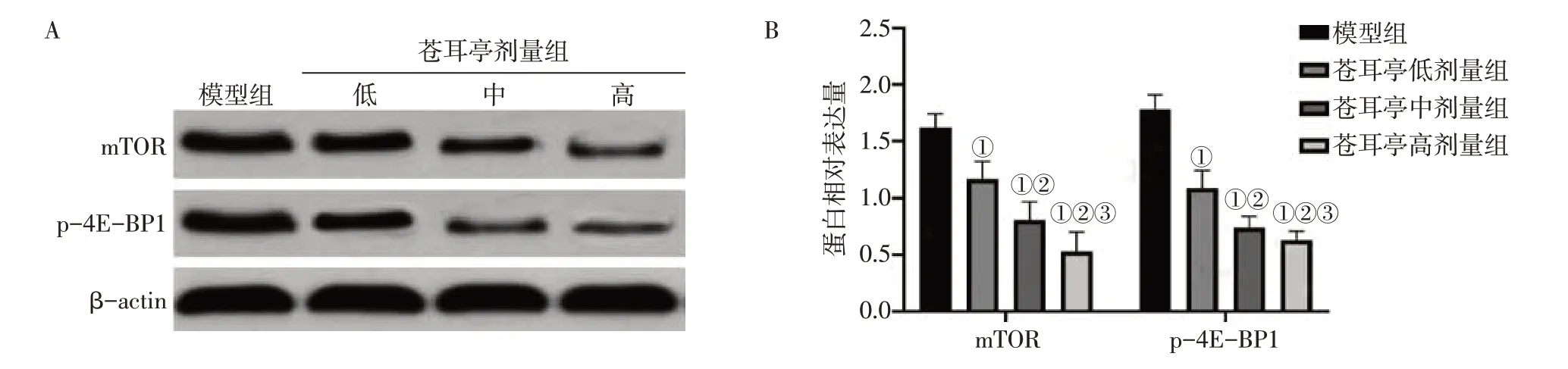
圖5 各組大鼠肺癌組織中mTOR、p-4E-BP1蛋白表達比較Figure 5 Comparison of mTOR and p-4E-BP1 protein expression in lung cancer tissues between various groups of rats
線粒體膜電位(MMP)的正常是維持線粒體進行氧化磷酸化的先決條件[9]。線粒體是由雙層膜包被的囊狀結構,外膜有較高通透性,內膜則通透性低,但這種不通透性對ATP的生成和MMP的維持起重要作用[10]。MMP是線粒體在氧化呼吸過程中內膜兩側離子濃度不同所產生的跨膜電位差,MMP的穩定有利于維持細胞的正常生理功能,MMP異常可導致線粒體膜的功能和狀態發生改變,從而影響線粒體進行氧化磷酸化,使細胞能量代謝異常[11-12]。本研究結果顯示,蒼耳亭能下調大鼠肺癌組織MMP,隨著蒼耳亭濃度的升高,MMP下降越顯著。MMP降低,則膜電位的電勢能降低,ATP的合成亦減少。提示蒼耳亭可通過降低MMP,減少肺癌細胞的ATP合成,從而抑制肺癌生長。
已有研究表明,蒼耳亭能通過誘導糖原合成酶激酶-3β(GSK-3β)磷酸化失活引發細胞周期阻滯及凋亡[5]。研究發現,mTOR/4E-BP1是GSK-3β上游的信號通路,激活其信號通路可介導細胞增殖,且與多種癌癥密切相關[13-14]。mTOR是一種絲氨酸-蘇氨酸蛋白激酶,激活狀態的mTOR可以磷酸化真核細胞下游的關鍵翻譯因子4E-BP1[15]。mTOR/4E-BP1通路調節功能的異常與人類惡性腫瘤的發展密不可分。當腫瘤細胞內mTOR/4E-BP1被激活,可使腫瘤細胞增殖失控、凋亡抗拒,從而引起腫瘤細胞的代謝改變[16]。本研究結果顯示,蒼耳亭可下調大鼠肺癌組織mTOR和p-4E-BP1蛋白表達水平,且隨著蒼耳亭濃度的增加,其對mTOR和p-4E-BP1蛋白的抑制效果越顯著,表明蒼耳亭可通過抑制肺癌組織mTOR/4E-BP1信號通路的活化,起到抗肺癌的作用。
綜上所述,祛風解表蒼耳子的主要活性成分蒼耳亭可通過降低癌細胞能量代謝,抑制癌細胞mTOR/4E-BP1信號通路的活化,抑制大鼠肺癌。

