丙泊酚通過JAK激酶-信號轉導及轉錄活化因子信號通路抑制類風濕關節炎大鼠炎癥反應及滑膜細胞凋亡
李帆,祖麗婭提?阿熱甫江,陳紅
類風濕關節炎(RA)是一種以慢性、對稱性、周圍性為主要臨床表現的自身免疫性疾病,JAK激酶(JAK)-信號轉導及轉錄活化因子(STAT)信號通路主要參與細胞的生長、存活、分化以及抗病原性等生理活動,近年來,研究表明RA的發病機制與JAKSTAT信號通路表達異常有關[1-11]。近年來有研究發現丙泊酚能夠通過調節JAK-STAT信號通路抑制大鼠體內的炎癥反應[12-15],但丙泊酚對于RA的作用及對滑膜細胞凋亡的影響目前尚未有明確報道。從2018年7月至2019年7月,本研究通過建立RA大鼠模型,研究丙泊酚對RA大鼠的作用及其體內JAK-STAT信號通路的影響,為RA的治療提供新的參考和依據。
1 材料與方法
1.1材料健康Wistar大鼠36只,雄性,SPF級別,7~8周齡,體質量(230±20)g,購于新疆醫科大學實驗動物中心,動物房溫度(22±2)℃,濕度(50±10)%,自由飲食,光照周期12 h,適應性喂養1周后進行實驗。本研究符合一般動物實驗倫理學原則。酶標儀購自北京島津公司,雙垂直電泳儀、轉印電泳儀、凝膠成像儀均購自伯樂生命醫學產品有限公司,全自動生化分析儀購自北京島津公司。丙泊酚購自上海德默醫藥科技有限公司,牛Ⅱ型膠原、完全弗氏佐劑、不完全弗氏佐劑購自深圳欣博盛生物科技有限公司,JAK2、STAT3和甘油醛-3-磷酸脫氫酶(GAPDH)抗體均購自美國Proteintech公司,膜聯蛋白V-異硫氰酸熒光素(Annexin V-FITC)細胞凋亡檢測試劑盒、RIPA蛋白裂解液、腫瘤壞死因子-α(TNFα)、白細胞介素-6(IL-6)及白細胞介素-1β(IL-1β)檢測酶聯免疫吸附測定(ELISA)試劑盒購自上海碧云天公司,ECL顯色液購自Thermo公司。
1.2RA大鼠模型的建立及給藥36只Wistar雄性大鼠,采用隨機數字表法分為對照組、模型組、甲氨蝶呤組、丙泊酚低、中、高劑量組,6只/組。采用Ⅱ型膠原誘導法建立RA大鼠模型[16]:使用0.05 mol/L的冰醋酸將牛Ⅱ型膠原溶解,使其終濃度為2.0 g/L,4℃備用,向其中加入含有1 g/L滅活的結核分枝桿菌的完全弗氏佐劑,注射器乳化后采用尾部皮內注射0.1 mg/0.1 mL的牛Ⅱ型膠原。第21天再次尾部皮內注射0.1 mg/0.1 mL膠原進行加強免疫,對照組大鼠不做特殊處理。參照文獻[17]標準,隔日按照以下標準對各組大鼠進行關節炎評分:無紅斑或腫脹,記0分;踝關節有輕微的紅斑或1個趾的腫脹,記1分;踝關節出現紅斑和超過1個趾的腫脹,記2分;踝關節以下的足爪腫脹,記3分;包括踝關節在內的全部足爪腫脹,記4分。每個大鼠四肢累計積分之和為關節炎評分。評分>6分者,視為造模成功。造模完成后,丙泊酚低、中、高劑量組分別腹腔注射10 mg/kg、20 mg/kg、40 mg/kg丙泊酚[12-15],甲氨蝶呤組腹腔注射甲氨蝶呤(7.5 mg/kg),對照組及模型組給予生理鹽水,1次/天,連續28 d,最后一次給藥24 h后,再次進行關節炎評分。
1.3大鼠血清TNF-α、IL-6及IL-1β水平測定末次給藥24 h后,眼眶靜脈叢取血至不含肝素的玻璃管中,4℃靜置4 h,4℃,3 500 r/min離心10 min。取上清液,使用ELISA檢測TNF-α、IL-6及IL-1β水平。
1.4各組大鼠脾臟及胸腺臟器指數頸椎脫臼處死大鼠后分離脾臟及胸腺,4℃生理鹽水灌流清洗,濾紙吸干水分后稱重,計算臟器指數。臟器指數=甲狀腺濕重(mg)/大鼠體質量(g)×100%。
1.5流式細胞術檢測滑膜細胞凋亡率參照文獻[18]方法,頸椎脫臼處死大鼠后,兩側滑膜組織在無菌條件下取出,用無Mg2+、Ca2+的D-Hank’s液沖洗3次后,制成約1 mm3的小塊。用吸管吸取數小塊組織,均勻排列在培養皿上,置于37℃、5%二氧化碳培養箱內培養7 h,使其貼壁。取出培養瓶后,加入含10%小牛血清的DMEM培養液4 mL,再置于37℃、5%二氧化碳培養箱中繼續培養。每隔24 h更換1次培養液,待滑膜細胞長出組織塊,繼續培養至細胞融合度達90%,用胰蛋白酶消化細胞后,進行3次傳代培養。用不含EDTA的胰蛋白酶消化收集細胞,并以1 000 r/min離心5 min,棄上清,加入適量培養基重懸細胞后,2 000 r/min離心5 min,棄上清液,加入195μL Annexin V-FITC結合液,再加入5μL的Annexin V-FITC,避光孵育15 min,然后加入10μL碘化丙啶(PI)染色液,避光孵育20 min,隨后置于冰浴中,用流式細胞儀檢測。
1.6蘇木精-伊紅(HE)染色頸椎脫臼處死大鼠后,迅速分離大鼠踝關節,放入4%中性甲醛中固定過夜,脫鈣液脫鈣處理,常規HE染色,在顯微鏡下觀察。
1.7蛋白質印跡法取大鼠踝關節滑膜組織,蛋白裂解液裂解后,12 000 r/min,4℃離心10 min,取上清液加入十二烷基硫酸鈉(SDS)上樣緩沖液,100℃水浴變性,測定蛋白總濃度,取50μg蛋白進行電泳分離,轉膜,5%牛血清白蛋白室溫封閉1 h,經JAK2、STAT3及GAPDH兔抗體(1∶1 000)4℃孵育過夜。PBST洗膜3次,每次5 min,加入二抗(1∶2 000)室溫孵育1 h,再次清洗3次后顯色液顯影,利用凝膠成像儀成像,對各蛋白灰度值定量分析,并以GAPDH為內參,計算各蛋白相對表達量。
1.8統計學方法以SPSS 19.0軟件分析所有數據,Graphpad prism 5作圖。計量資料用±s表示,多組間比較采用單因素方差分析,多組間的兩兩比較采用LSD法。P<0.05表示差異有統計學意義。
2 結果
2.1丙泊酚對RA大鼠關節評分的改善作用造模完成后,與對照組比較,模型組、丙泊酚低、中、高劑量組及甲氨蝶呤大鼠關節評分顯著升高(P<0.05);給藥結束后,與模型組比較,丙泊酚低、中、高劑量組及甲氨蝶呤組RA大鼠關節評分顯著降低(P<0.05),且丙泊酚各劑量組大鼠隨著丙泊酚劑量的增加,其關節評分顯著降低。見表1。
表1 各組大鼠造模完成后與給藥結束后關節評分比較/±s
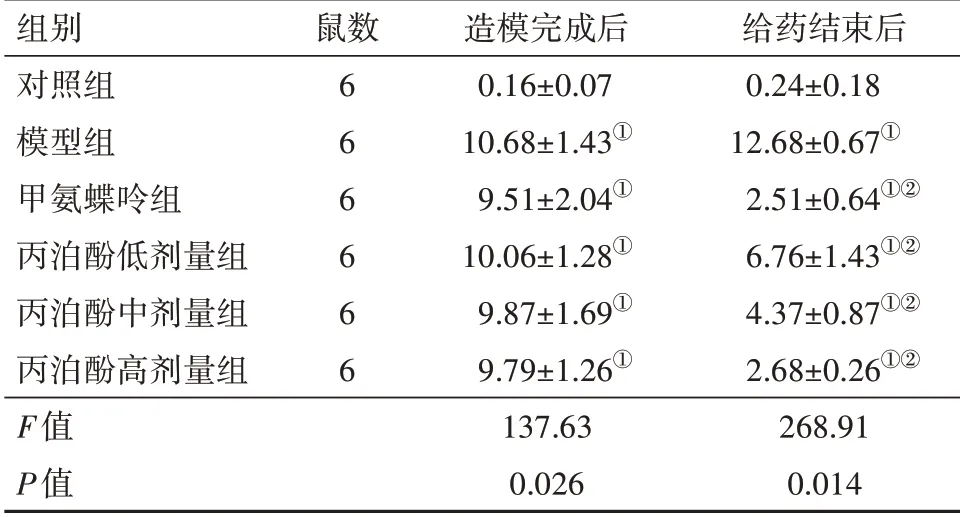
表1 各組大鼠造模完成后與給藥結束后關節評分比較/±s
注:①與對照組比較,P<0.05。②與模型組比較,P<0.05。
組別對照組模型組甲氨蝶呤組丙泊酚低劑量組丙泊酚中劑量組丙泊酚高劑量組F值P值鼠數6 6 6 6 6 6造模完成后0.16±0.07 10.68±1.43①9.51±2.04①10.06±1.28①9.87±1.69①9.79±1.26①137.63 0.026給藥結束后0.24±0.18 12.68±0.67①2.51±0.64①②6.76±1.43①②4.37±0.87①②2.68±0.26①②268.91 0.014
2.2丙泊酚對RA大鼠體內炎性因子水平的影響與對照組比較,模型組TNF-α、IL-6及IL-1β水平顯著升高(P<0.05);與模型組比較,丙泊酚低、中、高劑量組及甲氨蝶呤組TNF-α、IL-6及IL-1β水平均顯著降低(P<0.05),且隨著丙泊酚劑量的增加,大鼠體內TNF-α、IL-6及IL-1β水平逐漸降低。見表2。
表2 各組大鼠體內TNF-α、IL-6及IL-1β水平比較/(ng/L,±s)
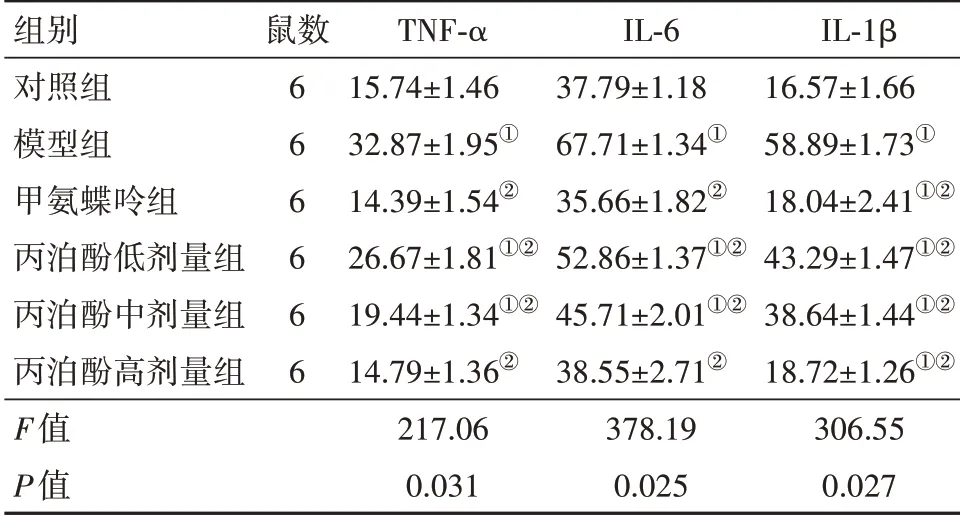
表2 各組大鼠體內TNF-α、IL-6及IL-1β水平比較/(ng/L,±s)
注:TNF-α為腫瘤壞死因子α,IL-6為白細胞介素-6,IL-1β為白細胞介素-1β。①與對照組比較,P<0.05。②與模型組比較,P<0.05。
組別對照組模型組甲氨蝶呤組丙泊酚低劑量組丙泊酚中劑量組丙泊酚高劑量組F值P值鼠數6 6 6 6 6 6 TNF-α 15.74±1.46 32.87±1.95①14.39±1.54②26.67±1.81①②19.44±1.34①②14.79±1.36②217.06 0.031 IL-6 37.79±1.18 67.71±1.34①35.66±1.82②52.86±1.37①②45.71±2.01①②38.55±2.71②378.19 0.025 IL-1β 16.57±1.66 58.89±1.73①18.04±2.41①②43.29±1.47①②38.64±1.44①②18.72±1.26①②306.55 0.027
2.3丙泊酚對RA大鼠臟器指數的影響與對照組比較,模型組脾臟及胸腺臟器指數顯著升高(P<0.05);與模型組比較,丙泊酚低、中、高劑量組及甲氨蝶呤組大鼠脾臟及胸腺臟器指數均顯著降低(P<0.05),且隨著丙泊酚劑量的增加,大鼠脾臟及胸腺臟器指數逐漸下降,同時,丙泊酚高劑量組大鼠脾臟及胸腺臟器指數與對照組大鼠差異無統計學意義(P>0.05)。見表3。
表3 各組大鼠脾臟及胸腺臟器指數比較/(%,±s)

表3 各組大鼠脾臟及胸腺臟器指數比較/(%,±s)
注:①與對照組比較,P<0.05。②與模型組比較,P<0.05。
組別對照組模型組甲氨蝶呤組丙泊酚低劑量組丙泊酚中劑量組丙泊酚高劑量組F值P值鼠數6 6 6 6 6 6脾臟18.26±1.52 38.64±4.68①25.51±2.39①②33.27±2.84①②28.44±1.66①②18.73±1.18②269.78 0.022胸腺8.14±0.81 14.62±1.37①10.11±0.97①②12.32±1.03①②10.67±0.81①②9.42±0.75②199.71 0.018
2.4丙泊酚對RA大鼠滑膜細胞凋亡的影響對照組、模型組、丙泊酚低、中、高劑量組及甲氨蝶呤組大鼠滑膜細胞凋亡率分別為(5.22±1.23)%、(41.85±3.97)%、(31.71±1.91)%、(24.84±1.91)%、(16.33±2.32)%、(15.62±2.52)%(F=171.93,P=0.012)。與對照組,模型組細胞凋亡率顯著升高(P<0.05);與模型組相比,丙泊酚低、中、高劑量組及甲氨蝶呤組細胞凋亡率顯著降低(P<0.05),且隨著丙泊酚劑量的增加,滑膜細胞凋亡率逐漸降低。
2.5丙泊酚對RA大鼠踝關節組織病理學的影響模型組大鼠較對照組表現出踝關節滑膜組織增生,壞死細胞脫落及炎癥細胞浸潤;與模型組比較丙泊酚低、中劑量組大鼠踝關節細胞壞死及脫落明顯減輕,炎癥細胞浸潤減少,細胞排列相對整齊,滑膜細胞相對完整,丙泊酚高劑量組大鼠踝關節偶見細胞壞死脫落,炎性浸潤少見,細胞排列整齊,病理改變明顯緩解。
2.6丙泊酚對RA大鼠滑膜組織JAK-STAT信號通路的影響與對照組比較,模型組踝關節滑膜組織JAK2、STAT3水平顯著升高(P<0.05);與模型組比較,丙泊酚低、中、高劑量組及甲氨蝶呤組JAK2、STAT3水平均顯著降低(P<0.05),且丙泊酚各劑量組RA大鼠隨著丙泊酚劑量的增加,滑膜組織JAK2、STAT3水平降低。見圖1,表4。
表4 各組大鼠踝關節滑膜組織JAK2、STAT3水平比較/±s
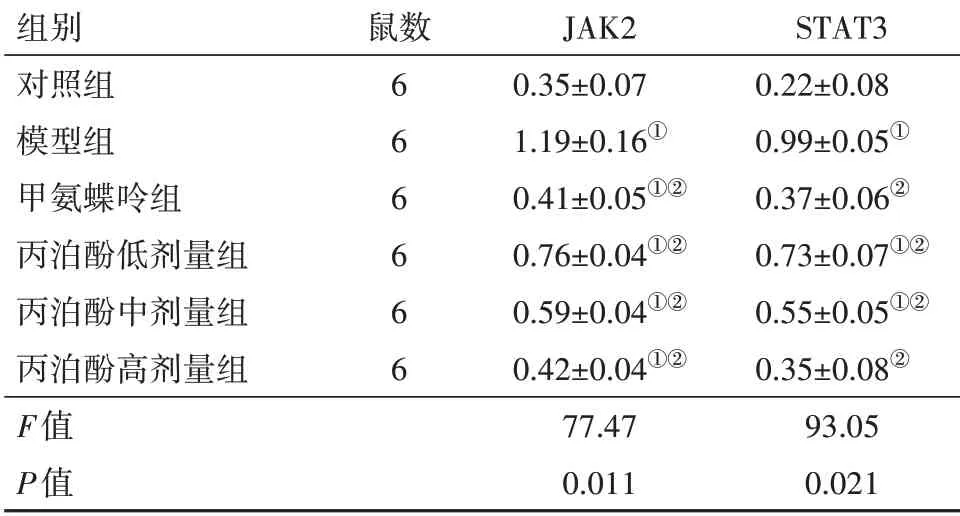
表4 各組大鼠踝關節滑膜組織JAK2、STAT3水平比較/±s
注:JAK2為JAK激酶2,STAT3為信號轉導及轉錄活化因子3。①與對照組比較,P<0.05。②與模型組比較,P<0.05。
組別對照組模型組甲氨蝶呤組丙泊酚低劑量組丙泊酚中劑量組丙泊酚高劑量組F值P值鼠數6 6 6 6 6 6 JAK2 0.35±0.07 1.19±0.16①0.41±0.05①②0.76±0.04①②0.59±0.04①②0.42±0.04①②77.47 0.011 STAT3 0.22±0.08 0.99±0.05①0.37±0.06②0.73±0.07①②0.55±0.05①②0.35±0.08②93.05 0.021
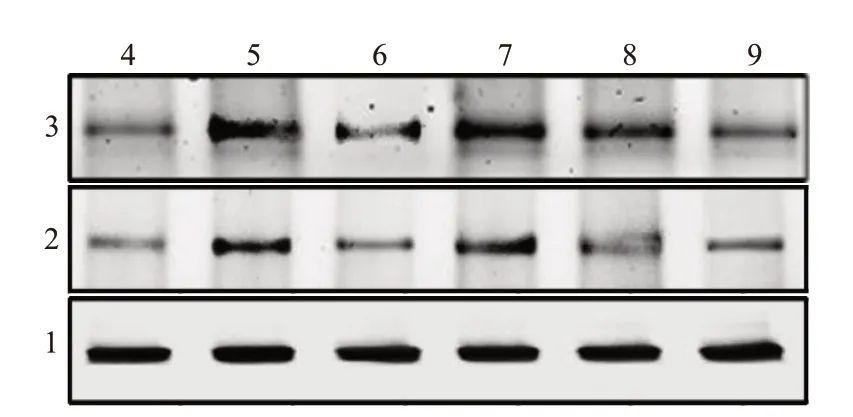
圖1 蛋白質印跡法檢測各組大鼠踝關節滑膜組織JAK2、STAT3水平
3 討論
RA作為一種以慢性、對稱性、周圍性為主要臨床表現的異質性、系統性、自身免疫性疾病,其病因尚未明確,其主要特征是手、足小關節的多關節、對稱性、侵襲性關節炎癥,隨著疾病進展會導致關節畸形及功能喪失。研究表明,RA主要受感染、免疫調節紊亂、內分泌紊亂、遺傳因素及環境因素等的影響[1-3]。目前臨床常用甲氨蝶呤等免疫抑制劑、非甾體抗炎藥、糖皮質激素等藥物進行RA的治療,但由于這些藥物長期使用存在較多不良反應且部分病人治療效果并不理想,所以對于治療RA藥物的開發仍是目前臨床亟須解決的問題之一。
近年來研究表明,丙泊酚具有顯著的氧化應激及炎癥反應抑制作用,能夠顯著抑制膿毒癥大鼠體內炎癥反應及氧化應激損傷,同時,具有調節JAKSTAT信號通路,誘導乳腺癌細胞凋亡、抑制肺癌細胞炎癥因子水平等藥理作用[12-15],但丙泊酚對于RA的作用及對滑膜細胞凋亡的影響目前尚不明確。血清TNF-α、IL-6及IL-1β水平在RA的發病機制中,TNF-α、IL-6及IL-1β起著關鍵性作用。成骨細胞受到刺激后,會促進機體TNF-α、IL-6及IL-1β水平的升高,并刺激炎性因子的釋放,進而誘導并加重自身免疫性損傷,胸腺及臟器指數則能夠反應機體自身免疫反應的強弱,滑膜細胞凋亡數則直接反映了機體關節的損傷程度[1-3]。本研究通過使用牛Ⅱ型膠原誘導建立RA大鼠模型,考察連續28 d給予不同劑量的丙泊酚對RA大鼠的作用。結果表明:與模型組相比,丙泊酚低、中、高劑量組RA大鼠關節炎評分、體內TNF-α、IL-6及IL-1β水平、胸腺及臟器指數、滑膜細胞凋亡率均顯著降低,提示丙泊酚能夠呈劑量依賴性地緩解RA大鼠關節腫脹程度,防止大鼠RA進一步加重,降低RA大鼠關節評分,同時降低炎性因子水平、臟器指數,抑制滑膜細胞凋亡,延緩疾病進展,改善大鼠RA疾病預后,抑制疾病進一步加重,進而改善RA大鼠的疾病進展及轉歸,促進RA大鼠關節功能的恢復。組織病理學檢查結果表明,丙泊酚能夠呈劑量依賴性地顯著改善RA大鼠踝關節病理組織學變化,提示丙泊酚能夠顯著改善RA大鼠踝關節組織病理學狀態,促進大鼠踝關節功能恢復。
JAK-STAT信號通路主要參與細胞的生長、存活及抗病原性等生理活動[19-20]。研究表明,JAKSTAT信號通路的異常激活可以誘發自身免疫疾病及炎癥的發生[7-11]。近年來研究表明,RA的發病機制與JAK-STAT信號通路表達異常密切相關,且抑制大鼠體內JAK-STAT信號通路的表達,能夠顯著改善大鼠RA的疾病狀態及相關指標[4-6]。本研究結果表明,給予RA大鼠不同劑量的丙泊酚后,丙泊酚低、中、高劑量組大鼠組織JAK2、STAT3水平均顯著降低,提示丙泊酚能夠呈劑量依賴性地降低RA大鼠踝關節滑膜組織JAK2、STAT3水平,進而抑制大鼠滑膜組織JAK-STAT信號通路的過表達,從而推測丙泊酚可能通過調節RA大鼠體內的JAK-STAT信號通路,進而調節其體內的炎性因子水平,改善大鼠的關節評分及臟器指數,降低滑膜細胞凋亡率。但由于時間及資金有限,對于丙泊酚對RA大鼠的靶向基因調控機制及丙泊酚在臨床中的應用優勢,需要在今后的研究中繼續進行深入探討。
綜上所述,丙泊酚能夠抑制RA大鼠體內炎癥反應及滑膜細胞凋亡,其作用機制可能與調節RA大鼠體內JAK-STAT信號通路有關。

