蓯蓉舒痙顆粒在正常與帕金森病大鼠中體內藥動學的比較
劉秀棉, 陳 丹*, 洪麗婷, 熊朝棟, 余文靜, 蔡 晶
(1.福建中醫藥大學藥學院,福建 福州 350122;2.福建中醫藥大學中西醫結合學院,福建 福州 350122)
帕金森病是一種因多巴胺能神經元變性引起的錐體外系疾病[1-2],肌強直為其主要臨床癥狀之一,中醫藥治療本病時大多通過整體施治來改善臨床癥狀,具有療效確切、不良反應小等特點[3]。蓯蓉舒痙方由酒蓯蓉、酒黃精、丹參、赤芍、牡丹皮等藥材組成,是源于經典方地黃飲子,結合實驗和長期臨床實踐的有效方劑,課題組前期以此方為基礎,研制出抗帕金森肌強直癥的顆粒劑,松果菊苷、芍藥苷、丹酚酸B、毛蕊花糖苷、丹參酮ⅡA等成分為該制劑特征效應組分群[4]。
在中藥新藥研究過程中,考察藥效組分群的體內生物利用度[5-6]和血藥濃度,了解它們在生物體內數量和質量的變化及藥動學特性,對安全合理使用中藥及正確評價其質量具有重要意義[7]。本實驗比較蓯蓉舒痙顆粒在正常與帕金森病大鼠中的體內藥動學,篩選藥代標示物,以期為科學制訂該制劑質量標準、指導其臨床合理用藥奠定實驗基礎。
1 材料
1.1 儀器 Waters ACQUITY UPLC TQD 超高效液相色譜-三重四級桿質譜聯用儀,配置自動進樣器、柱溫箱、TQD檢測器三重四級桿、ESI電離源、四元高壓泵、在線脫氣機、Masslynx4.1工作站控制系統(美國Waters公司);TGL-18G-C高速臺式離心機(上海安亭科學儀器廠);SK-1快速混勻器(常州國華電器有限公司);XS205電子天平[十萬分之一,梅特勒-托利多儀器(上海)有限公司]。
1.2 試劑與藥物 蓯蓉舒痙顆粒(自制,批號20190411、20190412、20190413);烏拉坦(國藥集團化學試劑有限公司,批號20180831)。蘆丁對照品(上海源葉生物科技有限公司,純度≥98%,批號B20771);松果菊苷對照品(成都埃法生物科技有限公司,純度>98%,批號AB0185-0020);毛蕊花糖苷(批號S01675)、丹參酮ⅡA(批號S01209)、丹酚酸B(批號S01203)、芍藥苷(批號S01794)對照品(南京狄爾格醫藥科技有限公司,純度>98%)。甲醇、乙腈為色譜純(德國Merck公司);水為超純水。
1.3 動物 清潔級SD大鼠24只,雄性,體質量(250±20)g,購自上海斯萊克實驗動物有限責任公司,實驗動物生產許可證號SCXK(滬)2017-0005。大鼠在溫度(22±2)℃、相對濕度(55±5)%的條件下適應性飼養7 d,自由進食飲水,保持室內自然通風,清潔級醫學實驗動物環境設施由福建中醫藥大學實驗動物中心提供,實驗動物使用許可證號SYXK(閩)2014-0005。大鼠處理方法符合《關于善待實驗動物的指導性意見》要求。
2 方法與結果
2.1 分組與造模 24只大鼠隨機分為正常組和模型組,每組12只,正常組大鼠皮下注射葵花油乳化液(1.5 mg/kg),每天1次,共14 d;模型組大鼠皮下注射魚藤酮葵花油乳化液(1.5 mg/kg),每給藥7 d休息1 d,共15 d。按表1評分標準[8],發現14 d后模型組大鼠均出現2分及2分以上的行為學表現,提示造模成功。

表1 行為學評分標準
2.2 空白血漿制備 取正常組、模型組大鼠各6只,禁食12 h,自由飲水,腹腔注射20%烏拉坦(5 mL/kg)麻醉,腹主動脈采血,血液置于預先肝素化的離心管中,室溫靜置30 min,3 500 r/min離心10 min,取上清液,即得,置于-20 ℃冰箱中冷凍保存。
2.3 溶液制備
2.3.1 對照品溶液 精密稱取松果菊苷、毛蕊花糖苷對照品適量,50%甲醇超聲溶解,制成分別含兩者1.268、1.207 mg/mL的貯備液;精密稱取芍藥苷、丹參酮ⅡA對照品適量,甲醇超聲溶解,制成分別含兩者1.328、1.234 mg/mL的貯備液;精密稱取丹酚酸B對照品適量,甲醇-水(8∶2)超聲溶解,制成含1.282 mg/mL該成分的貯備液。取上述5種貯備液適量,50%甲醇制成分別含126 819 ng/mL松果菊苷、2 657 ng/mL芍藥苷、2 563 ng/mL丹酚酸B、603.5 ng/mL毛蕊花糖苷、137.1 ng/mL丹參酮ⅡA的對照品溶液,置于4 ℃冰箱中貯存,臨用前用甲醇稀釋成所需質量濃度。
2.3.2 內標溶液 精密稱取蘆丁對照品適量,置于100 mL量瓶中,甲醇超聲溶解并稀釋至刻度,搖勻,得到貯備液(質量濃度0.305 mg/mL),置于4 ℃冰箱中貯存,臨用前取150 μL,甲醇稀釋至100 mL,即得(每1 mL含457.5 ng蘆丁)。
2.4 色譜條件 ACQUITY UPLC BEH C18色譜柱(2.1 mm×100 mm,1.7 μm);流動相乙腈(A)-0.1%甲酸(B),梯度洗脫(0~1.5 min,14%~30%A;1.5~3.0 min,30%~70%A;3.0~5.0 min,70%~90%A;5.0~6.0 min,90%A;6~6.1 min,90%~14%A;6.1~7.0 min,14%A);體積流量0.3 mL/min;柱溫40 ℃;進樣量2 μL。
2.5 質譜條件 電噴霧電離源(ESI);毛細管電離電壓3.5 kV;離子源溫度110 ℃;去溶劑氣N2,體積流量800 L/h,溫度500 ℃;反吹氣N2,體積流量50 L/h;碰撞氣Ar,體積流量0.13 mL/min;質譜數據采集及處理軟件采用Masslynx4.1工作站,多反應離子監測(MRM)模式,質譜參數見表2。

表2 各成分質譜參數
2.6 樣品前處理 取大鼠血漿200 μL,置于1.5 mL離心管中,加入內標溶液30 μL、6 mol/L甲酸50 μL、乙腈600 μL,渦旋混合2 min,17 000 r/min離心15 min,精密吸取上清液800 μL至另一離心管中,45 ℃氮氣吹干,殘留物加50%甲醇80 μL,渦旋復溶,17 000 r/min離心15 min,取上清液。
2.7 給藥與取樣 取正常組、模型組大鼠各6只,給藥前12 h禁食,自由飲水,灌胃給予等劑量顆粒混懸液(10 g/kg,生理鹽水配制,用時溫水浴加熱至37 ℃),給藥后于0.083、0.167、0.25、0.5、0.75、1、2、4、6、8、12、24、36 h眼眶取血各約0.5 mL,置于預先肝素化的離心管中靜置30 min,3 500 r/min離心10 min,取上層血漿,置于-20 ℃冰箱中貯存,待測。
2.8 方法學考察
2.8.1 專屬性試驗 取正常組大鼠空白血漿、模型組大鼠空白血漿、正常組大鼠空白血漿加對照品、模型組大鼠空白血漿加對照品、給藥后正常組大鼠血漿、給藥后模型組大鼠血漿各200 μL,按“2.6”項下方法處理,在“2.4”“2.5”項條件下進樣測定,結果見圖1。由此可知,各成分色譜峰與內標色譜峰分離度良好,內源性物質無干擾,表明該方法專屬性良好。
2.8.2 線性關系考察 精密吸取對照品溶液適量,甲醇稀釋至系列質量濃度,分別精密吸取200 μL,置于1.5 mL離心管中,45 ℃氮氣吹干,精密加入空白血漿200 μL,渦旋混合3 min,制得血漿對照品溶液,按“2.6”項下方法處理,在“2.4”“2.5”項條件下進樣測定。以對照品質量濃度為橫坐標(X),對照品、內標峰面積比值為縱坐標(Y)進行回歸,結果見表3,可知各成分在各自范圍內線性關系良好。再配制質量濃度處于標準曲線低濃度端的血漿對照品溶液,并逐漸稀釋,平行5份,以S/N=10測定最低定量濃度,平行5次,以相對誤差<20%、準確度在真實質量濃度80%~120%范圍內的質量濃度為定量限,測得松果菊苷、毛蕊花糖苷、芍藥苷、丹酚酸B、丹參酮ⅡA其數值分別為140.9、0.670 5、2.953、2.847、0.152 3 ng/mL,可滿足檢測要求。

a.松果菊苷 b.毛蕊花糖苷 c.內標(蘆丁) d.芍藥苷 e.丹酚酸B f.丹參酮ⅡAa.echinacoside b.acteoside c.internal standard(rutin) d.paeoniflorin e.salvianolic acid B f.tanshinone IIA圖1 各成分MRM色譜圖Fig.1 MRM chromatograms of various constituents

表3 各成分線性關系(n=7)
2.8.3 精密度試驗 精密吸取對照品溶液適量,按“2.8.2”項下方法處理,制備高、中、低質量濃度的含內標血漿對照品溶液,平行5份,同一天在“2.4”“2.5”項條件下進樣測定,計算日內精密度;連續測定3 d,每天1次,計算日間精密度。結果,各成分精密度RSD均小于11.0%,表明該方法精密度良好,符合生物樣品分析要求。
2.8.4 方法回收率試驗 精密吸取對照品溶液適量,按“2.8.2”項下方法處理,制備高、中、低質量濃度的含內標血漿對照品溶液,平行5份,在“2.4”“2.5”項條件下進樣測定,將測定值與對應質量濃度的理論值進行比較,計算方法回收率,結果見表4,可知該方法準確度良好,符合生物樣品分析要求。
2.8.5 提取回收率試驗 精密吸取對照品溶液適量,按“2.8.2”項下方法處理,制備高、中、低質量濃度的含內標血漿對照品溶液,平行5份,在“2.4”“2.5”項條件下進樣測定,得峰面積A;另取空白血漿,按“2.6”項下方法處理,加入對應質量濃度的含內標對照品溶液,平行5份,在“2.4”“2.5”項條件下進樣測定,得峰面積B,計算提取回收率,公式為提取回收率=(A/B)×100%,結果見表4,可知該方法提取回收率良好,符合生物樣品分析要求。
2.8.6 基質效應考察 取正常組、模型組大鼠空白血漿,按“2.6”項下方法處理,制備高、中、低質量濃度的含內標對照品溶液,平行5份,在“2.4”“2.5”項條件下進樣測定,得峰面積C;另取對應質量濃度的含內標對照品溶液,按“2.8.2”項下方法處理(以水代替空白血漿),平行5份,在“2.4”“2.5”項條件下進樣測定,得峰面積D,計算基質效應,公式為基質效應=(C/D)×100%,同法考察內標基質效應,結果見表4,可知各成分及內標無明顯離子抑制或增強作用,內源性物質對測定無干擾,符合生物樣品分析要求。

表4 各成分方法回收率、提取回收率、基質效應試驗結果(n=5)
2.8.7 穩定性試驗 精密吸取對照品溶液適量,按“2.8.2”項下方法處理,制備高、中、低質量濃度的含內標血漿對照品溶液,平行5份,在“2.4”“2.5”項條件下進樣測定,分別考察室溫放置(8 h)、反復凍融(1周內進行5次)、長期凍融(在-20 ℃下保存15 d)時的穩定性,結果見表5,可知各成分在不同條件下均呈現良好的穩定性。

表5 各成分穩定性試驗結果(n=5)
2.9 體內藥動學研究 采用DAS 2.0軟件處理藥動學數據,并通過非房室模型進行分析,結果見表6、圖2。由此可知,給藥后模型組芍藥苷Tmax短于正常組,其他成分均保持不變;各成分血藥濃度均在0.25 h達到最高,AUC均高于正常組;毛蕊花糖苷Cmax低于正常組,其他成分均高于正常組,提示在帕金森病狀態下蓯蓉舒痙顆粒口服吸收后進入體循環的相對量更高,以丹酚酸B更明顯,而毛蕊花糖苷在不同生理狀態下的差異較小;各成分t1/2均短于正常組,以丹酚酸B更明顯;松果菊苷、丹酚酸B MRT短于正常組,芍藥苷、丹參酮ⅡA更長,而毛蕊花糖苷無明顯變化;各成分消除速度快于正常組,以丹酚酸B更明顯,提示在帕金森病狀態下蓯蓉舒痙顆粒效應組分群的半衰期縮短,消除速度提升,其原因可能是發病時產生相應的應激內源性物質,提高細胞色素P450活性[9-11],從而促進特征效應組分群的代謝和消除。
綜上所述,蓯蓉舒痙顆粒的藥動學標志物是松果菊苷、芍藥苷、毛蕊花糖苷、丹酚酸B、丹參酮ⅡA,即為體內外共有組分群中的特征效應組分,并且在帕金森病狀態下口服吸收后其血藥濃度、Cmax、生物利用度明顯提高,從而發揮更好的作用。
3 討論

預實驗篩選去蛋白方法時發現,溶劑沉淀法效果較優。再比較了甲醇、乙腈、甲醇-乙腈(1∶2),發現乙腈去除蛋白較徹底,而且樣品回收率較高,故以其為蛋白沉淀溶劑。
結果顯示,蓯蓉舒痙顆粒特征效應組分群在帕金森病大鼠中的藥動學產生一定變化,血藥濃度、達峰濃度、口服生物利用度升高,并且正常與帕金森病大鼠血漿中各成分吸收峰均呈單一峰。由于藥物口服生物利用度決定于胃腸道吸收量,而腸道轉運蛋白和代謝酶又是決定藥物胃腸道吸收的重要因素,故腸道菌群的改變會導致藥物在體內代謝產物、代謝途徑甚至藥動學特征發生改變。文獻[12]報道,帕金森病小鼠腸道微生物呈現紊亂狀態,腸桿菌科細菌(如毛螺旋菌科、腔隙桿菌屬等)數量顯著增多;患者腸道中α-突觸核蛋白累積[13-14]會導致腸黏膜屏障通透性增加[15]。由此推測,在帕金森病狀態下可能由于小腸絨毛上皮細胞屏障通透性增加,腸道酶菌群系統排斥作用減弱,可提高蓯蓉舒痙顆粒中效應組分群的吸收,從而使該制劑能更好地發揮藥效。
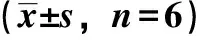
表6 各成分主要藥動學參數

圖2 各成分血藥濃度-時間曲線(n=6)Fig.2 Plasma concentration-time curves for various constituents (n=6)

