類葉升麻苷對疊氮鈉誘導的PC12細胞線粒體凋亡的保護作用
高 莉, 李建梅, 阿娜古麗·馬合木提, 閆 明
(新疆維吾爾自治區維吾爾醫藥研究所,新疆維吾爾醫方劑學重點實驗室,新疆 烏魯木齊 830011)
大多數神經退行性疾病都存在神經細胞線粒體功能異常、細胞骨架的破壞和神經細胞凋亡等與腦內線粒體功能障礙密切相關的重要病理生理改變[1-2],其中細胞色素C氧化酶(即線粒體呼吸鏈復合體Ⅳ,COX)作為線粒體的標志酶,是維持線粒體功能,進行細胞能量代謝的關鍵,它的缺陷被認為可能是神經退行性疾病的特異改變[3-4]。疊氮鈉(NaN3)是COX的抑制劑,用NaN3損傷PC12細胞或神經母細胞瘤細胞,可劑量依賴性地使COX活性下降,造成細胞線粒體功能障礙,產生氧化應激,導致多種凋亡因子的釋放和細胞膜的損傷,引起細胞死亡[5]。
類葉升麻苷是苯乙醇苷類化合物,在洋丁香、車前草、肉蓯蓉等79種植物中廣泛存在,資源豐富,具有抗氧化、抗炎、神經保護、改善認知障礙等多種功效[6-7]。前期研究發現,類葉升麻苷具有抗氧化、抗炎、調節ADP/ATP比值以及保護神經元的作用,但其是否通過線粒體保護途徑[8-9]發揮作用尚不明確。因此,本實驗以NaN3誘導PC12細胞建立線粒體損傷細胞模型,探討類葉升麻苷對線粒體損傷的細胞線粒體凋亡途徑的影響。
1 材料
1.1 試劑與藥物 類葉升麻苷(新疆維吾爾自治區維吾爾醫藥研究所自制,批號20130401,純度≥98%)。RPMI-1640培養基、胰蛋白酶(美國Gibco公司);胎牛血清(美國Thermo公司);氨芐青霉素鈉、硫酸鏈霉素(北京索萊寶科技有限公司);MTT(美國Sigma公司);乳酸脫氫酶(LDH)測試盒(南京建成生物工程研究所);細胞色素C氧化酶(COX)活性檢測試劑盒(上海杰美基因醫藥科技有限公司);細胞凋亡檢測試劑盒(美國BD公司);anti-Bax抗體、anti-Bcl-2抗體、anti-caspase-3抗體、anti-caspase-9抗體、山羊抗兔IgG(北京中杉金橋生物技術有限公司)。疊氮鈉(上海埃彼化學試劑有限公司,批號20120618,純度≥99%);丙酮酸鈉(天津市光復精細化工研究所);其他試劑均為分析純。
1.2 儀器 YJ-875型超凈工作臺(上海蘇凈實業有限公司);37XB型倒置顯微鏡(上海光學儀器六廠);MCO-18AIC型CO2培養箱(北京索萊寶科技有限公司);Multiskan Go 1510型酶標儀、LEGEND MICRO 21R型臺式高速冷凍離心機、Nanodrop little型核酸濃度檢測儀(美國Thermo公司);FACS Aria Ⅱ型流式細胞儀(美國BD公司);GeneAmp PCR system 9700型PCR儀(美國Perkin Elmer公司);SDS-PAGE電泳系統(北京六一生物科技有限公司);125-BR垂直電泳儀、凝膠成像系統(美國Bio-Rad公司)。
1.3 細胞 鼠腎上腺嗜鉻細胞瘤(PC12)細胞由中國科學院上海細胞庫提供。
2 方法
2.1 細胞培養 將PC12細胞以5×104/mL密度接種于含10%胎牛血清、0.11 g/L丙酮酸鈉、2.5 g/L葡萄糖、1.5 g/L NaHCO3、100 U/mL青霉素、100 U/mL鏈霉素的RPMI-1640培養基中,置于37 ℃、5% CO2培養箱中培養,每隔3 d換傳代1次。
2.2 模型建立 以MTT值為指標,細胞存活率達到40%~60%作為評價指標。將細胞接種于96孔板,待70%~80%融合時加入NaN3,使其終濃度分別為0、50、100、200 mmol/L,在37 ℃、5% CO2恒溫培養箱中繼續培養4 h,采用MTT法計算細胞存活率,確定NaN3劑量。
2.3 類葉升麻苷與NaN3損傷PC12細胞共孵育 培養貼壁PC12細胞,吹打懸浮后以5×104/mL密度接種到96孔板或細胞瓶中(空白組不含細胞,加入等體積PBS溶液),培養過夜,待70%~80%融合時吸取原培養液,模型組、給藥組加入150 μL含100 mmol/L NaN3的1640培養液(空白組加入等體積不含NaN3的PBS溶液,對照組加入等體積不含NaN3的培養液),在37 ℃下恒溫孵育4 h后,吸取各組培養液,給藥組再加入200 μL含有不同濃度(1、10、100 μmol/L)類葉升麻苷的培養液(空白組加入等體積PBS溶液,對照組及模型組加入等體積培養液)孵育24 h,顯微鏡下觀察細胞形態并取樣進行后續檢測。
2.4 MTT法檢測細胞存活率 取對數生長期PC12細胞,接種于96孔培養板培養48 h,空白組每孔加入20 μL PBS溶液,其余組每孔加入20 μL MTT(5 g/L),繼續培養4 h,吸出培養液,空白組每孔加入150 μL PBS溶液,其余組每孔加入等體積DMSO,振蕩溶解后,在490 nm波長處測定光密度(OD)值,計算細胞存活率。
2.5 細胞培養上清液中LDH酶活性檢測 取對數生長期PC12細胞,接種于96孔培養板,按“2.3”項下方法分組給藥,收集細胞培養上清液,每組10孔,按照試劑盒說明書檢測LDH活性。
2.6 細胞線粒體COX活性檢測 取對數生長期PC12細胞,培養于25 cm2細胞培養瓶,按“2.3”項下方法分組給藥,收集細胞,按照試劑盒說明書檢測COX活性,重復4次,檢測總蛋白濃度后,待測樣品以50 μg總蛋白為標準進行檢測。
2.7 細胞凋亡率檢測 采用Annexin V-FITC/PI雙染色法,以RPMI 1640培養基調節細胞密度至5×104/mL,接種至25 cm2培養瓶培養中48 h,加入100 mmol/L NaN3損傷4 h,按“2.3”項下方法分組給藥,將細胞自瓶壁上輕輕吹打下來,制成單細胞懸液后移入離心管中,1 000 r/min離心10 min,棄上清液,加入預冷PBS清洗3次,Binding Buffer重懸浮細胞,調整細胞密度為1.0×106/mL,取100 μL細胞懸液,加入FITC標記的Annexin V、PI溶液各5 μL,輕輕混勻,室溫避光染色20 min,加入Binding Buffer 400 μL,混勻,采用流式細胞儀檢測細胞凋亡率。
2.8 細胞Bax、Bcl-2、caspase-3、caspase-9蛋白表達檢測 取對數生長期PC12細胞,接種于6孔細胞培養板,按“2.3”項下方法分組給藥,收集細胞,提取總蛋白,BCA法檢測蛋白濃度,采用5%濃縮膠、10%分離膠進行電泳,濕轉至PVDF膜,脫脂奶粉溶液封閉2 h,一抗(1∶1 000)4 ℃孵育過夜,1×TBST洗滌,二抗(1∶3 000)孵育1 h,1×TBST洗滌,按1∶1比例避光加入發光液,立即用化學發光成像儀曝光,保存成像條帶,進行定量分析,重復3次。
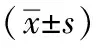
3 結果
3.1 NaN3對PC12細胞生長情況及細胞存活率的影響 與對照組比較,50、100、200 mmol/L NaN3作用4 h后,細胞形態均有不同程度的損傷,并隨著劑量增加更明顯,表現為細胞數目減少,軸突縮短、減少、消失,細胞變圓(圖1A),其中100、200 mmol/L NaN3組細胞存活率降低(P<0.01),細胞線粒體還原MTT的能力分別為對照組的(62.76±2.38)%、(40.64±6.45)%(圖1B)。根據損傷程度,后續實驗選擇造模條件為100 mmol/L NaN3作用PC12細胞4 h。
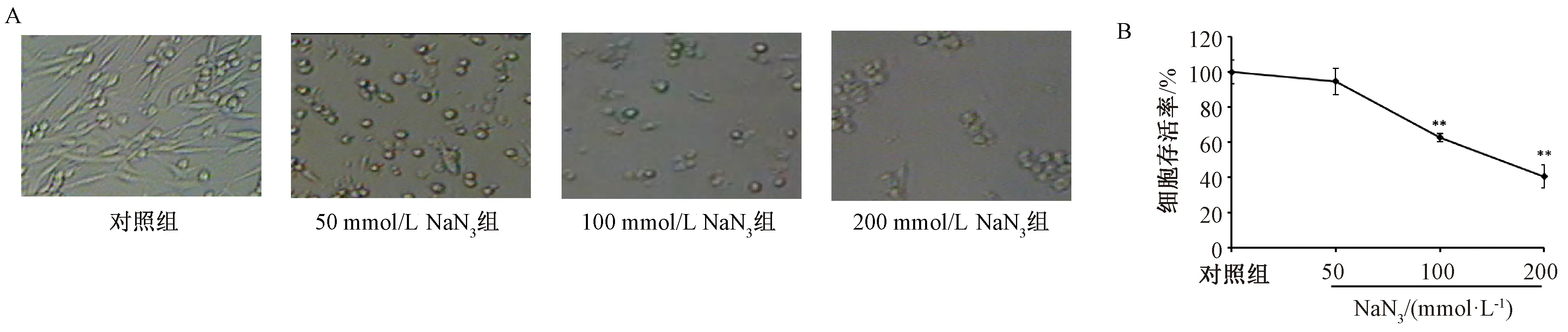
注:與對照組比較,**P<0.01。圖1 NaN3對PC12細胞生長(A)及存活率(B)的影響
3.2 類葉升麻苷對NaN3損傷后PC12細胞存活率和細胞膜損傷的影響 如圖2所示,與對照組比較,模型組細胞數減少,形態變圓變小,扁平,無光澤,軸突消失,細胞存活率降低(P<0.01),細胞培養上清液中LDH酶活性升高(P<0.01);與模型組比較,類葉升麻苷各劑量組細胞梭形、軸突、立體光澤等形態特征恢復,細胞存活率升高(P<0.01),細胞上清液中LDH釋放量降低(P<0.01),并呈現劑量依賴性。

注:與對照組比較,**P<0.01;與模型組比較,##P<0.01。圖2 類葉升麻苷對NaN3損傷后PC12細胞形態(A)、細胞存活率(B)及細胞膜損傷(C)的影響
3.3 類葉升麻苷對NaN3損傷后PC12細胞線粒體COX活性的影響 圖3顯示,與對照組比較,細胞經NaN3損傷后線粒體COX活性受到抑制(P<0.01);與模型組比較,1、10、100 μmol/L類葉升麻苷組細胞COX活性升高(P<0.05,P<0.01),并且劑量越低,效果越明顯。

注:與對照組比較,**P<0.01;與模型組比較,#P<0.05,##P<0.01。圖3 類葉升麻苷對NaN3損傷后PC12細胞線粒體COX活性的影響
3.4 類葉升麻苷對NaN3損傷后PC12細胞凋亡的影響 圖4顯示,對照組細胞早期凋亡率為(3.774±0.894)%,而模型組細胞與100 mmol/L NaN3共孵育4 h后增至(34.805±2.857)%(P<0.01);與模型組比較,類葉升麻苷各劑量組細胞早期凋亡率均降低(P<0.01),并呈現劑量依賴性。
3.5 類葉升麻苷對NaN3損傷后PC12細胞凋亡因子蛋白表達的影響 圖5顯示,與對照組比較,模型組細胞Bax、caspase-3、caspase-9蛋白表達升高(P<0.01),Bcl-2蛋白表達降低(P<0.01);與模型組比較,類葉升麻苷各劑量組細胞Bax、caspase-3、caspase-9蛋白表達降低(P<0.05,P<0.01),Bcl-2蛋白表達升高(P<0.01)。
4 討論
神經退行性疾病,如阿爾茨海默病、帕金森氏病和亨廷頓病等的發生與腦內線粒體缺陷密切相關,其患者體內均存在線粒體功能和線粒體DNA的異常,這一觀點已得到廣泛認同[10-11]。目前研究發現COX活性在阿爾茨海默病患者中下降30%~40%[12],且有研究證實輕度認知障礙患者和阿爾茨海默病患者腦內葡萄糖代謝紊亂導致腦能量代謝降低,并由此影響腦功能正常發揮,造成學習記憶能力缺陷[13]。
COX的特異性抑制劑NaN3作為工具藥已被廣泛地應用于制備模擬阿爾茨海默病的細胞和動物模型。研究證明,它可以損傷神經細胞使動物產生學習記憶障礙,其作用機制可能包括神經細胞骨架損傷、氧化損傷、離子內穩態破壞、細胞膜損傷、細胞凋亡和壞死等[14-15]。本實驗中選擇不同劑量NaN3與PC12細胞共同孵育4 h,通過考察細胞存活率,確定了在本實驗室環境下,采用100 mmol/L NaN3損傷PC12細胞4 h后PC12細胞存活率大約為60%的造模條件,確保了細胞模型既有損傷又能保證損傷不至于影響研究類葉升麻苷的藥效作用。實驗中建立的造模條件與文獻[5,16]報道的作用劑量和作用時間基本相似。

注:與對照組比較,**P<0.01;與模型組比較,#P<0.05,##P<0.01。圖4 類葉升麻苷對NaN3損傷后PC12細胞凋亡的影響

注:與對照組比較,**P<0.01;與模型組比較,#P<0.05,##P<0.01。圖5 類葉升麻苷對NaN3損傷后PC12細胞凋亡因子蛋白表達的影響
本實驗在建立NaN3造模條件的基礎上,研究不同劑量類葉升麻苷對NaN3損傷PC12細胞的影響。結果發現,不同劑量類葉升麻苷呈劑量依賴性地恢復PC12細胞受到的NaN3損傷,不同程度恢復PC12細胞的梭形、軸突等特征,提高細胞的存活率,增加COX活性。類葉升麻苷對細胞COX活性的影響呈現隨劑量降低效果增強的趨勢,一方面表明類葉升麻苷在改善NaN3抑制COX活性作用方面起效劑量低;另一方面也表現出類葉升麻苷抑制COX活性的作用時效可能較快,在較高劑量下也許可以快速調節細胞中COX活性抑制的狀態,并在作用24 h檢測之前,已經快速解除了COX活性抑制的狀態,激發了機體自我平衡的反饋抑制機制的反應。鑒于類葉升麻苷對于COX活性調節的敏感性,在今后的研究中,不僅應對其量效關系進行研究,更應開展其時效關系的深入研究。
線粒體可以介導細胞內凋亡通路的發生,當線粒體功能受到損傷時,其膜通透性改變,釋放細胞色素C,導致csapase-9活化,引起caspase通路級聯反應,通過線粒體凋亡途徑誘發細胞凋亡[17-18]。NaN3制備PC12線粒體損傷模型可以較好地模擬這一病理變化[19]。LDH是反映細胞損傷的重要指標,可以直接反應細胞膜的完整性和通透性,檢測細胞培養液中LDH活性,可以間接反應細胞的受損情況。流式細胞技術是目前研究細胞凋亡較靈敏和全面的實驗方法。因此,實驗中采用流式細胞技術檢測類葉升麻苷對NaN3損傷PC12細胞凋亡的作用,并采用Western blot方法對線粒體凋亡途徑相關凋亡蛋白表達進行檢測。研究結果發現,PC12細胞經NaN3損傷后,LDH的釋放量增加,細胞早期凋亡和晚期凋亡,凋亡因子Bax、caspase-3、caspase-9蛋白表達升高以及抗凋亡因子Bcl-2蛋白表達降低,然而將1、10、100 μmol/L類葉升麻苷與模型細胞共孵育24 h后,類葉升麻苷能降低PC12細胞的LDH釋放量,提高正常細胞比例和降低細胞早期凋亡率,降低細胞Bax、caspase-3、caspase-9蛋白表達以及升高Bcl-2蛋白表達,且呈劑量依賴性。提示,類葉升麻苷對NaN3損傷PC12細胞的細胞膜完整性和通透性具有保護作用,對線粒體受損PC12細胞的晚期凋亡無作用,但對細胞早期凋亡有抑制作用,能夠通過介入線粒體凋亡途徑改善模型細胞的早期凋亡增加的現象。
綜上所述,類葉升麻苷拮抗NaN3損傷細胞的機制可能為NaN3通過抑制COX活性導致線粒體跨膜電位降低,能量供應不足,引起細胞骨架的損傷,導致細胞膜通透性增加,繼而引發細胞凋亡,從而保護細胞的存活和增殖。類葉升麻苷能夠通過改善和保護線粒體功能起到防治線粒體功能障礙的神經退行性等疾病的作用,對此類疾病治療具有一定的應用前景。

