大黃素對內毒素誘導的牙齦成纖維細胞ROS/MAPK/AP-1通路及炎性因子表達的影響
楊桂梅 孫玉梅 顏淑云 郭瑋
大黃素是從中藥大黃中提取的有效活性成分,具有抗腫瘤、抗炎、抗氧化、抗菌、抗病毒等多種生理活性,研究表明大黃素可促進牙周膜細胞活性及增殖,對牙周炎癥相關疾病具有一定的緩解作用[1-2],具體作用機制仍不清晰。活性氧/絲裂原活化蛋白激酶/活化蛋白1(reactive oxygen species/mitogen-activated protein kinase/activator protein-1,ROS/MAPK/AP-1)通路與機體炎癥反應密切相關,細菌裂解后釋放的LPS可誘導ROS產生,并促進MAPK、AP-1的表達,并加速機體相關炎癥因子的表達[3-4]。本研究利用脂多糖誘導人牙齦成纖維細胞炎癥反應,初步探究大黃素作用機制,供臨床治療牙周病參考。
1 材料與方法
1.1 細胞
人牙齦成纖維細胞HGF-1(資源編號:BNCC339845)(北京貝納創聯生物技術研究院)。
1.2 主要試劑及儀器
大黃素(上海麥克林生化科技有限公司);牙齦卟啉單胞菌內毒素(廣東翁江化學試劑有限公司); ROS活性氧誘導劑/ROS誘導劑(上海貝博生物有限公司);抗MAPK、AP-1、GAPDH、山羊抗小鼠IgG(Abcam公司, 美國; p38-MAPK(武漢菲恩生物科技有限公司); 細胞培養箱(MCO-15AC, SANYO公司, 日本); 酶標儀(XElx800, Perkin Elmer公司, 美國);蛋白凝膠成像儀(GIS-500, 杭州Miulab公司)。
1.3 細胞培養
將HGF-1細胞株細胞復蘇,用含有10%FBS的DMEM培養液培養,培養箱條件設為37 ℃、 5% CO2,每兩天更新一次培養液。待培養瓶中細胞密度高于80%時進行0.25%胰蛋白酶消化傳代培養。取對數生長期細胞進行后續實驗。
1.4 大黃素溶液制備
大黃素用二甲基亞砜溶解,配置成50 mmol/L的母液,使用時用DMEM培養基稀釋成20、40、60、80、100、120 μmol/L的含藥培養基[5]。
1.5 大黃素對HGF-1細胞增殖的影響
采用CCK-8法測定大黃素對人牙齦成纖維細胞增殖的影響。收集對數生長期HGF-1細胞,接種于96 孔板,細胞約為1×104個/孔,分別加入不同濃度的(0、 20、 40、 60、 80、 100、 120 μmol/L)含大黃素培養基, 37 ℃、 5% CO2條件下培養24 h,更換新鮮培養基后每孔加入10 μL CCK-8溶液,繼續在培養箱中孵育1~4 h,測定各孔HGF-1細胞在450 nm處的吸光度,根據公式計算不同濃度大黃素對HGF-1細胞增殖的影響。細胞活力(%)=[A加藥-A空白]/[A對照-A空白]×100%,A加藥:含有細胞、含大黃素培養基、CCK-8溶液孔的吸光度值;A空白:有相應培養基、CCK-8溶液、無細胞孔的吸光度值;A加藥:含有細胞、CCK-8溶液、無藥培養基孔的吸光度值。
1.6 HGF-1細胞分組及藥物處理
收集對數生長期HGF-1細胞,隨機分為對照組(常規培養)、 LPS組(800 μg/L LPS培養24 h后更換普通培養基培養24 h)[6]、大黃素組(800 μg/L LPS培養24 h后更換60 μmol/L大黃素培養基培養24 h)、ROS誘導劑組(800 μg/L LPS培養24 h后加入稀釋比為1∶1 000的ROS培養1 h,然后換用普通培養基繼續培養24 h)、大黃素+ROS誘導劑組(800 μg/L LPS培養24 h后計入稀釋比為1∶1 000的ROS培養1 h,然后換用60 μmol/L大黃素培養基繼續培養24 h)。培養結束后采集各組細胞用于后續實驗。
1.7 各組HGF-1細胞活力檢測
收集各組HGF-1細胞,根據CCK-8試劑盒中的具體操作步驟測定各組HGF-1細胞的細胞活力。
1.8 各組HGF-1細胞中炎性因子及氧化應激因子表達水平檢測
收集各組HGF-1細胞,無菌條件下將細胞轉移至離心管中, 1 000 g離心后取上清液,根據白細胞介素(interleukin, IL)-6、IL-1β、腫瘤壞死因子-α(tumor necrosis factor-α, TNF-α)、超氧化物歧化酶(superoxide dismutase, SOD)、丙二醛(malonaldehyde, MDA)、乳酸脫氫酶(lactate dehydrogenase, LDH)相關試劑盒中檢測步驟進行測定。
1.9 各組HGF-1細胞中ROS含量測定
利用熒光探針DCFH-DA進行ROS檢測,收集各組HGF-1細胞,棄去培養液加入經DMEM培養基稀釋的DCFH-DA(1∶1 000), 37 ℃、5% CO2條件下孵育20 min,經DMEM培養基洗滌細胞后在熒光分光光度計中測定DCF的熒光強度。細胞內的ROS可將無熒光的DCFH氧化為有熒光的DCF,因此DCF熒光強度越高即代表細胞內ROS含量越多。
1.10 各組HGF-1細胞中ROS/MAPK/AP-1通路相關蛋白檢測
收集各組HGF-1細胞,棄培養液,移入無菌離心管中,低溫加入蛋白質提取試劑盒中RIPA裂解液,充分裂解后離心取上清液,根據BCA蛋白濃度測定試劑盒的操作步驟測定其中蛋白質含量,取20 μL各組待測樣品,通過SDS-PAGE電泳分離蛋白,然后轉移到PDVF膜上,用TBST漂洗,然后用5%的脫脂奶粉室溫封閉,加入MAPK(1∶1 000)、AP-1(1∶1 000)、GAPDH(1∶2 000)一抗, 4 ℃條件下孵育并過夜,用TBST漂洗,加入辣根過氧化酶標記的山羊抗小鼠IgG(1∶10 000)繼續孵育2 h,經顯色、曝光后分析各組HGF-1細胞中MAPK、 AP-1蛋白表達情況。
1.11 統計學分析
2 結 果
2.1 大黃素對HGF-1細胞增殖的影響
大黃素濃度在20~60 μmol/L時HGF-1細胞的細胞活力逐漸增強(P<0.05),濃度在80~120 μmol/L時細胞的細胞活力顯著下降(P<0.05),選擇60 μmol/L的大黃素濃度用于后續研究(表 1)。
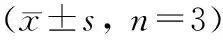
表 1 大黃素對HGF-1細胞增殖的影響
2.2 各組HGF-1細胞的細胞活力比較
與對照組相比,LPS組HGF-1細胞活力顯著降低(P<0.05);與LPS組相比,大黃素組HGF-1細胞活力顯著升高(P<0.05);與大黃素組相比,ROS誘導劑組及大黃素+ROS誘導劑組HGF-1細胞活力顯著降低(P<0.05);與ROS誘導劑組相比,大黃素+ROS誘導劑組HGF-1細胞活力顯著升高(P<0.05)(表 2)。
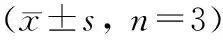
表 2 各組HGF-1細胞活力比較
2.3 各組HGF-1細胞中炎癥因子表達水平比較
與對照組相比,LPS組HGF-1細胞中IL-1β、IL-6、TNF-α表達水平顯著升高(P<0.05); 與LPS組相比,大黃素組HGF-1細胞中IL-1β、IL-6、TNF-α表達水平顯著降低(P<0.05);與大黃素組相比,ROS誘導劑組及大黃素+ROS誘導劑組HGF-1細胞中IL-1β、IL-6、TNF-α表達水平顯著升高(P<0.05);與ROS誘導劑組相比,大黃素+ROS誘導劑組HGF-1細胞中IL-1β、IL-6、TNF-α表達水平顯著降低(P<0.05)(表 3)。
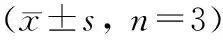
表 3 各組HGF-1細胞中炎癥因子表達水平比較
2.4 各組HGF-1細胞中氧化應激因子表達水平比較
與對照組相比,LPS組HGF-1細胞中SOD表達水平顯著降低(P<0.05),MDA、LDH表達水平顯著升高(P<0.05);與LPS組相比,大黃素組HGF-1細胞中SOD表達水平顯著升高(P<0.05),MDA、LDH表達水平顯著降低(P<0.05);與大黃素組相比,ROS誘導劑組及大黃素+ROS誘導劑組HGF-1細胞中SOD表達水平顯著降低(P<0.05),MDA、LDH表達水平顯著升高(P<0.05);與ROS誘導劑組相比,大黃素+ROS誘導劑組HGF-1細胞中SOD表達水平顯著升高(P<0.05),MDA、LDH表達水平顯著降低(P<0.05)(表 4)。
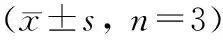
表 4 各組HGF-1細胞中氧化應激因子表達水平比較
2.5 各組HGF-1細胞中ROS含量比較
與對照組相比,LPS組HGF-1細胞中ROS含量顯著升高(P<0.05);與LPS組相比,大黃素組HGF-1細胞中ROS含量顯著降低(P<0.05);與大黃素組相比,ROS誘導劑組及大黃素+ROS誘導劑組HGF-1細胞中ROS含量顯著升高(P<0.05);與ROS誘導劑組相比,大黃素+ROS誘導劑組HGF-1細胞中ROS含量顯著降低(P<0.05)(表 5)。
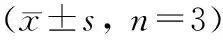
表 5 各組HGF-1細胞中ROS含量比較
2.6 各組HGF-1細胞中ROS/MAPK/AP-1通路相關蛋白表達比較
與對照組相比,LPS組HGF-1細胞中p38-MAPK、AP-1蛋白表達水平顯著升高(P<0.05);與LPS組相比,大黃素組HGF-1細胞中p38-MAPK、AP-1蛋白表達水平顯著降低(P<0.05);與大黃素組相比,ROS誘導劑組及大黃素+ROS誘導劑組HGF-1細胞中p38-MAPK、AP-1蛋白表達水平顯著升高(P<0.05);與ROS誘導劑組相比,大黃素+ROS誘導劑組HGF-1細胞中p38-MAPK、AP-1蛋白表達水平顯著降低(P<0.05)(表 6、 圖 1)。
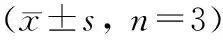
表 6 各組HGF-1細胞中MAPK、AP-1蛋白表達水平比較
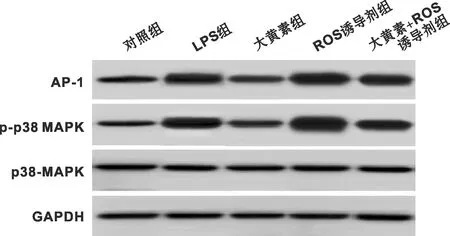
圖 1 各組HGF-1細胞中p38-MAPK、AP-1蛋白表達情況
3 討 論
牙周病是由粘附在牙齒表面的微生物群引起的慢性感染性疾病,人牙齦成纖維細胞是牙周組織主要的細胞類別之一,在牙周組織修復及再生中發揮重要作用,在病理狀態下,人牙齦成纖維細胞被炎癥介質激活,增加炎癥因子的釋放,進而影響患者口腔健康[7-8]。牙周組織中的細菌裂解后產生的脂多糖可作用于牙齦成纖維細胞及牙周膜細胞, 增強牙周組織炎癥反應,進而參與牙周病的產生與發展[9]。牙齦卟啉單胞菌是牙周病的重要致病菌之一,在整個炎癥反應過程中起到重要作用,用牙齦卟啉單胞菌LPS誘導牙齦成纖維細胞HGF-1發生炎癥反應的效果顯著[10]。本研究結果顯示,LPS顯著降低HGF-1的細胞活性,HGF-1細胞中IL-1β、IL-6、TNF-α等炎癥因子及MDA、LDH氧化應激因子表達水平顯著升高,SOD表達水平顯著降低,提示LPS可誘導牙齦成纖維細胞的炎性反應,并降低其抗氧化能力,Dronik等[11]研究表明脂質過氧化在牙周病患者牙周組織炎癥發生中起到重要作用,且與正常人相比,牙周炎患者血漿中沉積的MDA較多,抗氧化能力顯著較低。
大黃素是中藥大黃的有效成分之一,具有抗炎、抗氧化、抗菌等多種生物活性, Lee等[12]研究發現大黃素可顯著降低花生四烯酸誘導的HepG2肝細胞氧化應激反應,并顯著降低HepG2肝細胞中的ROS含量。張國華等[13]研究表明大黃素能顯著改善牙齦卟啉單胞菌誘導的大鼠牙周炎,并降低大鼠牙周組織中IL-6、TNF-α等炎癥因子的表達。本研究結果顯示,經過大黃素處理的HGF-1細胞的細胞活力較LPS處理細胞有顯著提升,IL-1β、IL-6、TNF-α等炎癥因子及MDA、LDH氧化應激因子表達水平顯著降低,SOD表達水平顯著升高,表明大黃素具有抑制LPS誘導的HGF-1細胞炎性反應,提高其抗氧化能力的作用。
多項研究表明ROS/MAPK/AP-1通路與機體炎癥反應及氧化應激反應密切相關,ROS在氧化劑應激及炎癥反應中具有重要作用,被促炎因子激活的成纖維細胞可產生大量ROS,引起機體氧化還原失衡,導致細胞發生過氧化損傷,進而降低細胞活性,促進細胞死亡[14-15],ROS會使下游的MAPK發生磷酸化,進而激活AP-1等多種轉錄因子[16],激活的AP-1可增加IL-1β、TNF-α等炎癥因子的表達[17],進而促進機體炎癥反應。蘇麗等[18]研究發現甘草次酸可通過抑制ROS/p38-MAPK/AP-1信號通路降低電離輻射誘導的小鼠巨噬細胞炎癥反應。本研究結果顯示,LPS組及ROS誘導劑組HGF-1細胞中ROS含量、ROS/MAPK/AP-1通路相關蛋白表達水平顯著高于對照組,表明HGF-1細胞的炎性反應及氧化應激反應可能與ROS/MAPK/AP-1通路的激活密切相關;與ROS誘導劑組相比,大黃素+ROS誘導劑組HGF-1細胞中ROS含量、ROS/MAPK/AP-1通路相關蛋白表達水平顯著降低,提示大黃素緩解LPS誘導的HGF-1細胞炎性反應及氧化應激反應與抑制ROS/MAPK/AP-1通路有關。
綜上所述,大黃素具有降低LPS誘導的HGF-1細胞炎性反應的作用,可能通過抑制ROS/MAPK/AP-1通路發揮作用。

